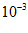北京市西城区2020-2021学年下学期高一年级期末考试化学试卷
本试卷共100分。考试时长90分钟。
第一部分(选择题
共50分)
每小题只有一个选项符合题意(1~25小题,每小题2分)
1. 高粱酿酒过程中的部分流程如下,其中能说明转化过程中放出热量的是
A | B | C | D |
|
|
|
|
“蒸粮”时加热 | “拌曲”前摊晾 | “堆酵”时升温 | “馏酒”时控温 |
2. 下列过程属于人工固氮的是
A. 工业合成氨 B. 分离液态空气制N2
C. 闪电时N2转化为NO D. 豆科植物的根瘤菌将N2转化为氨
3. 常温下,下列溶液可用铁质容器盛装的是
A. 稀硝酸 B. 浓硝酸 C. 稀硫酸 D. 稀盐酸
4. 下图为酸雨形成的示意图。下列说法中,不正确的是
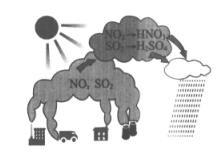
A. 酸雨的pH小于5.6
B. 酸雨会加速建筑物的腐蚀
C. 含硫煤的燃烧是导致酸雨的原因之一
D. 酸雨形成过程中不涉及氧化还原反应
5. 下列金属中,通常用加热分解法冶炼的是
A. 铁 B. 银 C. 铜 D. 铝
6. 下列化学用语表达不正确的是
A. 葡萄糖的分子式:C6H12O6
B. 丁烷的结构式:CH3(CH2)2CH3
C. 甲烷的电子式: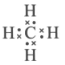
D. 丙烷分子的球棍模型:
7. 下列说法中,不正确的是
A. 食醋可除去水壶中的水垢 B. 液氨可用作制冷剂
C. 纤维素是人体重要的供能物质 D. 二氧化硫常用于漂白纸浆
8. 正丁烷与异丁烷互为同分异构体的依据是
A. 具有相似的化学性质
B. 具有相似的物理性质
C. 分子的空间结构相同
D. 分子式相同但分子内碳原子的连接方式不同
9. 下列过程属于物理变化的是
A. 石油分馏 B. 煤的干馏 C. 煤的气化 D. 乙烯聚合
10. 下列做法与调控化学反应速率无关的是
A. 用冰箱冷藏以保鲜食物 B. 食盐中添加碘酸钾预防缺碘
C. 用煤粉代替煤块使炉火更旺 D. 食品包装内放置除氧剂延长保质期
11. 下列说法中,正确的是
A. 糖类都可以发生水解反应 B. 油脂属于天然高分子
C. 葡萄糖和果糖互为同分异构体 D. 蛋白质遇到浓硫酸会显黄色
12. 下图为石墨烯–硅太阳能电池结构模型。下列说法中,不正确的是
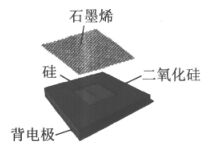
A. 石墨烯属于烯烃
B. 硅是应用广泛的半导体材料
C. 二氧化硅可用来生产光导纤维
D. 石墨烯–硅太阳能电池可将太阳能转化为电能
13. 取一支试管,收集半试管CH4和半试管Cl2,在光照下得到的取代产物是
①CH3Cl ②CH2Cl2
③CHCl3
④CCl4
A. 只有① B. 只有④
C. ①②③的混合物 D. ①②③④的混合物
14. 实验室用乙酸、乙醇和浓硫酸制取乙酸乙酯的装置如下图。下列说法中,不正确的是
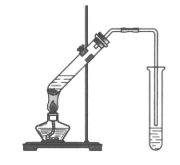
A. 右侧试管中盛放的是饱和Na2CO3溶液
B. 右侧试管中导管不伸入液面下,是为了防止倒吸
C. 加入过量乙醇,可使乙酸完全转化为乙酸乙酯
D. 实验结束,右侧试管内液体上层为无色透明的油状液体
15. 下列物质或方法中,不能用来鉴别乙醇和乙酸的是
A. 扇闻气味 B. 蒸馏水 C. 碳酸钠溶液 D. 石蕊溶液
16. 汽车的启动电源常用铅酸蓄电池,其结构如下图所示。放电时的电池反应:
PbO2+Pb+2H2SO4=2PbSO4+2H2O。下列说法中,正确的是
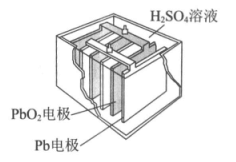
A. Pb作电池的负极
B. PbO2作电池的负极
C. PbO2得电子,被氧化
D. 电池放电时,溶液酸性增强
17. 碳化硅(SiC)俗称金刚砂,它的化学性质稳定,硬度大,还具有优异的高温抗氧化性能。由此推断,它与下列哪种物质可能有相似的结构
A. 金刚石 B. 干冰 C. 石墨 D. 纯碱
18. 某有机物的结构简式为CH2=CHCH(OH)CH2CH3,不能与该有机物发生反应的物质有
A. Na B. H2
C. NaOH溶液 D. 酸性KMnO4溶液
19. 实验室进行氨溶于水的喷泉实验(如图)。下列说法中,不正确的是
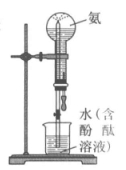
A. 该实验证明氨气极易溶于水
B. 红色喷泉说明氨水显碱性
C. 形成喷泉的原因是氨气溶于水后,烧瓶内的气压大于大气压
D. 烧瓶充满二氧化硫,胶头滴管和烧杯中加入浓碱液也可形成喷泉
20. 为了除去粗盐中的Ca2+、Mg2+、SO42-,可将粗盐溶于水,然后进行下列操作①过滤
②加过量NaOH溶液
③加适量稀盐酸
④加过量Na2CO3溶液
⑤加过量BaCl2溶液。其中操作顺序正确的是
A. ①④②⑤③ B. ②④⑤①③ C. ④①②⑤③ D. ⑤②④①③
21. 下列关于甲烷和乙烯的说法中,不正确的是
A. 二者均是无色、难溶于水的气体
B. 二者均可以使溴的四氯化碳溶液褪色
C. 甲烷属于饱和烃,乙烯属于不饱和烃
D. 甲烷分子具有正四面体结构,乙烯分子具有平面结构
22. N2转化为NH3的微观过程示意图如图。下列说法中,不正确的是
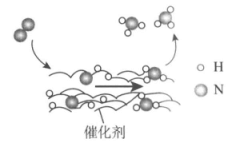
A. 催化剂能改变该反应速率
B. 催化剂表面只发生了极性共价键的断裂和形成
C. 在催化剂表面形成氮氢键时,有电子转移
D. 该反应的原子利用率可达到100%
23. HI常用作有机反应中的还原剂,受热发生反应:2HI(g) H2(g)+I2(g)。一定温度时,向1L密闭容器中充入1mol HI,体系中c(HI)与反应时间t的关系如图。下列说法中,不正确的是
H2(g)+I2(g)。一定温度时,向1L密闭容器中充入1mol HI,体系中c(HI)与反应时间t的关系如图。下列说法中,不正确的是
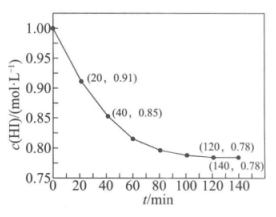
A. HI的还原性与-1价碘元素有关
B. 20min时,n(HI)=0.91mol
C. 40 min时,有85%的HI发生分解
D. 120 min时,反应达到了平衡状态
24. 用下图所示装置探究铜丝与过量浓硫酸的反应。下列说法中,不正确的是
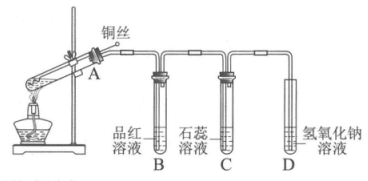
A. 向外拉铜丝可终止反应
B. B中品红溶液褪色,C中石蕊溶液变红
C. D中NaOH溶液可以吸收多余的SO2
D. 为确认生成CuSO4,向试管A中加水,观察颜色
25. 下列实验结论与实验现象不对应的一组是
选项 | 实验 | 现象 | 结论 |
A | 向某盐溶液中加入KSCN溶液 | 溶液变为红色 | 该溶液中含有Fe3+ |
B | 向某盐溶液中加入浓NaOH溶液,加热 | 产生的气体能使湿润的红色石蕊试纸变蓝 | 该溶液中含有NH4+ |
C | 向蔗糖中滴加浓硫酸 | 蔗糖变黑 | 浓硫酸具有脱水性 |
D | 向淀粉溶液中加入少量稀H2SO4,加热,冷却后加NaOH溶液至碱性,再加少量新制的Cu(OH)2,加热 | 生成砖红色沉淀 | 淀粉完全水解 |
第二部分(非选择题
共50分)
26. (3分)化学能在一定条件下可转化为电能。
(1)如图所示装置中,锌片上的电极反应式是___________________,能证明产生电能的实验现象是_________________________。
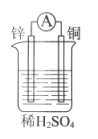
(2)下列反应通过原电池装置,可实现化学能直接转化为电能的是__________(填序号)。
a. 2H2+O2 2H2O b. NaOH+HCl=NaCl+H2O
2H2O b. NaOH+HCl=NaCl+H2O
27. (4分)某实验小组设计了下图装置(实验前U形管中液面左右相平),探究化学能与热能的转化。
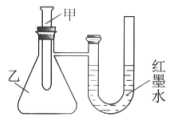
(1)若在甲试管中加入适量CaO固体与水,可观察到U形管中的现象是_____________,反应的化学方程式是_______________________。
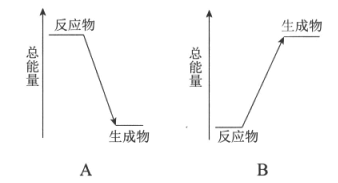
(2)若甲试管中发生Ba(OH)2·8H2O晶体与NH4Cl晶体的反应,该反应属于___________(填”吸热”或”放热”)反应,其能量变化可用下图中的____________(填序号)表示。
28. (4分)A、B、C、D四种物质的相互转化关系如下图(部分反应条件及产物略去)。
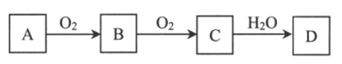
(1)若A是黄色固体单质,则B为__________,D的浓溶液与铜反应的化学方程式是__________________。
(2)若A是空气中的主要成分,C是红棕色气体,则A的电子式为_______________,D的浓溶液需保存在棕色试剂瓶中,并放置在阴凉处,原因是_________________(用化学方程式表示)。
29. (5分)实验室常用如图所示装置制取干燥的NH3。
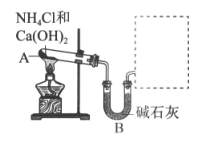
(1)A中反应的化学方程式是_____________________。
(2)B中碱石灰的作用是____________________。
(3)在右图方框内画出用试管收集NH3的示意图。
(4)若将A中固体换成NH4Cl固体,_____________(填”能”或”不能”)制取NH3,原因是_________________(用化学方程式表示)。
30. (8分)利用催化技术可将汽车尾气中的CO和NO转化为CO2和N2,化学方程式:
2NO+2CO  2CO2+N2。
2CO2+N2。
(1)某温度下,在容积不变的密闭容器中通入CO和NO,测得不同时间CO的浓度如下表:
时间/s | 0 | 1 | 2 | 3 | …… |
c(CO)/× | 3.60 | 3.05 | 2.85 | 2.75 | …… |
用CO的浓度变化表示0~2 s的平均反应速率为____________mol·L-1·s-1。
(2)下列可说明反应达到平衡状态的是_____________。
a. CO的浓度不再改变
b. 容器中的气体质量保持不变
c. NO、CO、CO2、N2的浓度之比为2:2:2:1
d. 相同时间内,反应消耗2 molNO同时消耗1 molN2
(3)反应物初始浓度相同时,实验温度为280℃和360℃,进行以下实验:
实验编号 | 实验目的 | T/℃ | 同种催化剂的比表面积m2/g | 达平衡时所用的时间/s |
Ⅰ | 对照实验 | 280 | 80 | t1 |
Ⅱ | a | 280 | 120 | t2 |
Ⅲ | 研究温度对尾气转化速率的影响 | b | c | t3 |
【实验分析与结论】
①补全表格a. __________,b. __________,c. __________。
②测得t3<t1,对比实验Ⅰ、Ⅲ,可得结论:催化剂的比表面积相同时,______________。
③通过实验可得到”温度相同时,增大催化剂的比表面积,可增大尾气的转化速率”的结论,证据是对比实验Ⅰ、Ⅱ,t2__________t1(填”>”、”<“或”=”)。
31. (8分)餐厨垃圾在酶的作用下可获得乙醇,进一步反应可制备有机物C和高分子材料G,转化关系如下:
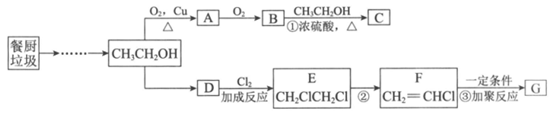
(1)乙醇含有的官能团是______________。
(2)A的结构简式是______________。
(3)反应①的化学方程式是______________。
(4)D的结构简式是______________。
(5)下列说法中,不正确的是___________。
a. D、E、F均属于烃 b. E和一氯甲烷互为同系物 c. 反应②为取代反应
(6)反应③的化学方程式是______________。
32. (5分)某化学小组利用下图装置进行实验(夹持仪器略去,气密性已检查),对比NO通入浓、稀硝酸的现象,探究浓、稀硝酸氧化性的相对强弱。
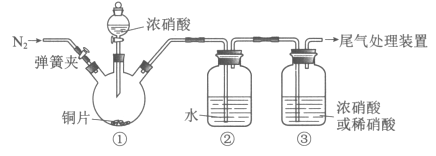
(1)铜与浓硝酸反应的化学方程式是______________。
(2)装置②中发生反应的化学方程式是______________。
(3)滴加浓硝酸前需先通入N2,目的是______________。
(4)滴加浓硝酸后,当③中为稀硝酸时,其液面上方气体仍为无色;当③中为浓硝酸时,其液面上方气体由无色变为红棕色。由此得出的结论是______________。
33. (6分)溴及其化合物应用广泛,以下两种方法均可从海水中提取溴。
(1)吹出法(主要流程如下):
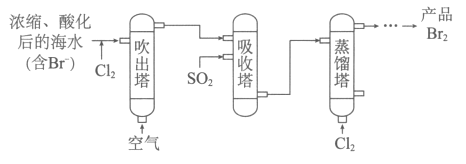
①海水中的Br-被Cl2氧化的离子方程式是______________。
②补全吸收塔中反应的化学方程式□Br2+□______+□______=口_________+□HBr
③蒸馏塔中控制温度不超过100℃,原因是______________。
④经该方法处理后,1m3海水最终得到38.4g Br2,若总提取率为60%,则原海水中溴的浓度是__________mg·L-1。
(2)聚四氟乙烯气态膜法(基本原理如图所示):
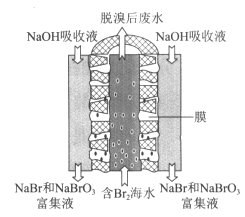
①经处理后的含Br2海水透过膜孔与NaOH吸收液发生反应,离子方程式是______________。得到富集液后再加酸、精馏可得Br2。
②聚四氟乙烯气态膜法与吹出法相比,优点是______________(写出一条即可)。
34. (7分)某同学为研究浓硝酸与KSCN溶液的反应,进行如下实验:
实验操作 | 实验现象 |
Ⅰ. 取1支试管,加入2 mL浓硝酸,滴加5滴1 mol·L-1KSCN溶液 | 溶液立即变红 |
Ⅱ. 将试管静置一段时间 | 突然剧烈反应,红色迅速褪去,放出大量红棕色气体 |
Ⅲ. 将Ⅱ中的气体通入Ba(OH)2和NaOH的混合溶液中 | 有白色沉淀生成 |
资料:SCN-能被氧化为(SCN)2,(SCN)2迅速聚合为红色的(SCN)x。
(1)KSCN中,C、N元素的化合价分别为+4价和-3价,则S元素的化合价为___________。
(2)Ⅰ中溶液立即变红是因为生成了______________(填化学式)。
(3)研究SCN-的最终转化产物。
①取少量Ⅱ中试管内的溶液,______________(填操作和现象),证明SCN-中S元素的转化产物是SO42-。
②经检验Ⅱ中”红棕色气体”含有NO2,但不能说明NO2一定是SCN-中N元素的转化产物,原因是______________。
③Ⅲ中,NO2转化为NO2-、NO3-,离子方程式是______________。
④将Ⅲ中沉淀过滤、洗涤,取少量于试管中,加入过量的稀硝酸,沉淀完全溶解,再滴加少量KMnO4溶液,不褪色。证明了红棕色气体中不含SO2。
综合上述实验,SCN-的最终转化产物中一定有______________。
(4)Ⅱ中,”静置一段时间后,突然剧烈反应”的可能原因是______________(写出一条即可)。
【试题答案】
第一部分
选择题(每小题只有一个选项符合题意,共25个小题,每小题2分,共50分)
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
答案 | C | A | B | D | B | B | C | D | A | B | C | A | D |
题号 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
答案 | C | B | A | A | C | C | D | B | B | C | D | D |
第二部分
非选择题(共9个小题,共50分)其他合理答案均可给分。
26. (3分)
(1)Zn-2e-=Zn2+
电流表指针偏转
(2)a
27. (4分)
(1)左管液面降低,右管液面升高 CaO+H2O=Ca(OH)2
(2)吸热 B
28. (4分)
(1)SO2 Cu+2H2SO4(浓)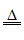 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(2)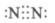 4HNO3(浓)
4HNO3(浓) 4NO2↑+O2↑+2H2O
4NO2↑+O2↑+2H2O
29. (5分)
(1)2NH4Cl+Ca(OH)2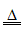 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
(2)干燥NH3
(3)
(4)不能 NH3+HCl=NH4Cl
30. (8分)
(1)3.75×10-4
(2)a、d
(3)①a. 研究催化剂的比表面积对汽车尾气转化速率的影响 b. 360 c. 80
②升高温度,可以增大尾气的转化速率
③<
31. (8分)
(1)羟基
(2)CH3CHO
(3)CH3COOH+CH3CH2OH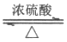 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
(4)CH2=CH2
(5)a、b、c

32. (5分)
(1)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
(2)3NO2+H2O=2HNO3+NO
(3)赶尽O2,防止NO转化为NO2
(4)浓硝酸的氧化性强于稀硝酸
33. (6分)
(1)①Cl2+2Br-=2Cl-+Br2
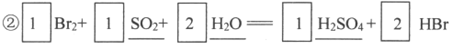
③温度过高会蒸出较多水蒸气,降低产品Br2的纯度
④64
(2)①3Br2+6OH-=5Br-+BrO3-+3H2O
②操作简便、绿色环保、节能
34. (7分)
(1)-2 (2)(SCN)x
(3)①加入稀盐酸,再加入BaCl2溶液,生成白色沉淀
②NO2也可能是浓硝酸发生还原反应得到的
③2NO2+2OH-=NO2-+NO3-+H2O
④SO42-、CO2
(4)反应放热、生成的产物对该反应有催化作用