本试卷共19个小题;答题时间为90分钟;请将答案写在答题纸上,交答题纸。
Ⅰ卷
选择题(共 42 分)
每小题只有一个选项符合题意。每小题 3 分,共 42 分。
1. 1861年德国人基尔霍夫(G.R.Kirchhoff)和本生(R.W.Bunsen)研究锂云母的某谱时,发现在深红区有一新线,从而发现了铷元素,他们研究的某谱是
A. 原子光谱 B. 质谱 C. 红外光谱 D. 核磁共振氢谱
2. 某原子的电子排布式为 1s22s22p63s23p63d54s2,下列说法中不正确的是
A. 该元素原子中共有 25 个电子 B. 该元素原子核外有 4 个能层
C. 该元素原子最外层共有 2 个电子 D. 该元素原子 M 电子层共有 8 个电子
3. 磷酸铁锂(LiFePO4)电极材料主要用于各种锂离子电池。下列说法错误的是
A. Li 位于周期表s区
B. 基态 Fe2+的价层电子排布式为 3d6
C. 基态 P 原子的未成对电子数为 5
D. 基态 O 原子核外电子占据的最高能级的电子云轮廓图为哑铃形
4. 元素 X 的各级电离能数据如下:
I1 | I2 | I3 | I4 | I5 | I6 | |
I/kJ•mol-1 | 578 | 1817 | 2745 | 11578 | 14831 | 18378 |
元素 X 的常见价态是
A. +1 B. +2 C. +3 D. +4
5. σ 键可由两个原子的 s 轨道、一个原子的 s 轨道和另一个原子的 p 轨道以及一个原子的 p 轨道和另一个原子的 p 轨道以“头碰头“方式重叠而成。则下列分子中的 σ 键是由一个原子的 s 轨道和另一个原子的 p 轨道以“头碰头“方式重叠构建而成的是
A. H2 B. HF C. Cl2 D. F2
6. 下列 Li 原子的电子轨道表示式的对应状态,能量由低到高的顺序是
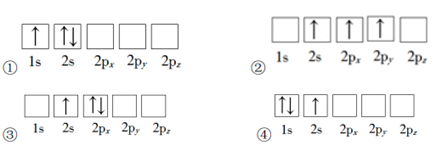
A. ④①②③ B. ③②①④ C. ④②①③ D. ①②③④
7. 二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如下图所示。常温下,S2Cl2
遇水易与水发生反应,并产生能使品红褪色的气体,下列说法中错误的是
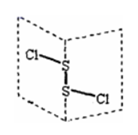
A. S2Cl2的结构式为 Cl—S—S—Cl
B. S2Cl2与水反应时只有 S—Cl 断裂
C. S2Br2含有极性键和非极性键
D. S2Cl2与 H2O 反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl
8. 已知各共价键的键能如下表所示,下列说法正确的是
共价键 | H-H | F-F | H-F | H-Cl | H-I |
键能 E (kJ/mol) | 436 | 157 | 568 | 432 | 298 |
A. 键的极性大小顺序: H-I>H-Cl>H-F
B. 表中最稳定的共价键是 F-F 键
C. 432kJ/mol>E(H-Br)>298kJ/mol
D. 上述键能可以说明热稳定性的顺序是:HF<HCl<HI
9. 下列说法不正确的是
A. 淀粉和纤维素是糖类中的天然高分子,完全水解后的产物都是葡萄糖
B. 核酸和蛋白质是生命活动中的重要的高分子化合物,它们都含有氮元素
C. 油脂是提供人体活动所需能量的高分子化合物
D. 塑料、合成纤维、合成橡胶是三大合成高分子材料
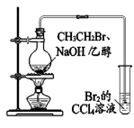
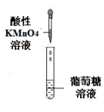
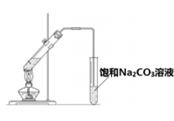
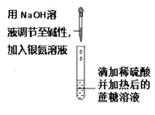
10. 下列实验方案中,不能达到相应实验目的的是
实验方案 |
|
|
|
|
目的 | A. 检验溴乙烷消去反应的产物 | B. 证明葡萄糖中含有羟基 | C. 实验室制备和收集乙酸乙酯 | D. 检验蔗糖水解产物的还原性 |
11. 高分子 M 广泛用于牙膏、牙科粘合剂等口腔护理产品,合成路线如下:
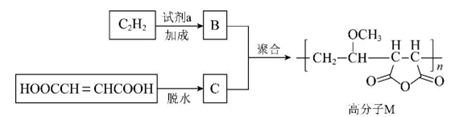
下列说法不正确的是
A. 试剂 a 是甲醇 B. 化合物 B 不存在顺反异构体
C. 化合物 C 的核磁共振氢谱有一组峰 D. 合成 M的聚合反应是缩聚反应
12. 烃类化合物(a) 、(b)
、(b)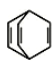 、(c)
、(c)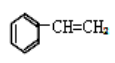 ,关于它们的说法不正确的是
,关于它们的说法不正确的是
A. a、b、c 互为同分异构体
B. b 的二氯代物有三种
C. 只有 a 不能发生加聚反应
D. 只有 c 的所有原子可能处于同一平面
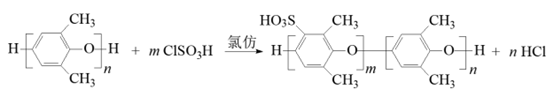
13. 磺化聚苯醚(SPPO)质子交换膜在燃料电池领域有广阔的应用前景。合成聚苯醚(PPO)并将其改性制备 SPPO 的路线如下:
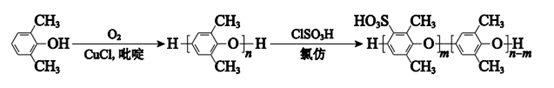
2,6-二甲基苯酚
聚2,6-二甲基苯醚(PPO) 磺化聚苯醚(SPPO)
下列说法正确的是
A. 2,6-二甲基苯酚能与饱和溴水发生加成反应
B. 常温下 2,6-二甲基苯酚易溶于水
C. 2,6-二甲基苯酚与 O2发生氧化反应生成 PPO
D. PPO 合成 SPPO 的反应方程式是:
14. 北京航空航天大学教授偶然中发现米虫吃塑料,受此启发进行了系列实验,证实黄粉虫的肠道微生物可降解聚苯乙烯(PS),蜡虫可降解聚乙烯(PE)。聚苯乙烯在虫肠内降解的示意图如下,下列说法正确的是
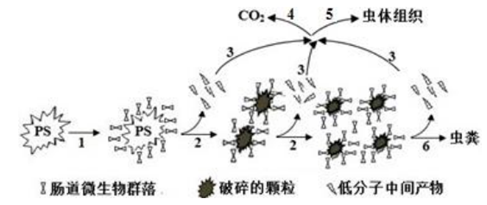
A. 在虫肠内微生物作用下,聚苯乙烯断裂碳碳双键
B. 在虫肠内微生物作用下,聚苯乙烯直接降解为 CO2 分子
C. 在虫肠内微生物作用下,聚苯乙烯发生降解,分子量降低
D. 聚乙烯与聚苯乙烯是同系物,具有烯烃的性质
II 卷
非选择题(共 58 分)
15. (10 分)
(1)石墨烯是一种零距离半导体,而且有非常好的热传导性能,是由碳原子构成的单层片状结构的新材料(结构示意图如下),可由石墨剥离而成,具有很好应用前景。
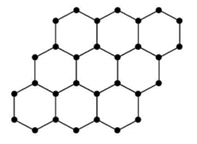
①石墨烯中碳碳键的键角为________。
②已知几种常见化学键的键能如下表:
化学键 | Si—O | H—O | O=O | Si—Si | Si—C |
键能/kJ·mol-1 | 368 | 467 | 498 | 226 | x |
i 比较 Si—Si 键与 Si—C 键的键能大小:x_____(填“>””<“或“=”)226 kJ·mol-1。
ii H2
被誉为 21 世纪人类最理想的燃料,而更有科学家提出硅是“21 世纪的能源“、“未来的石油“的观点。已知 1 mol 单质硅含有 2 mol Si—Si 键,1 mol SiO2含 4 mol Si—O 键,试计算:1 mol Si 完全燃烧放出的热量约为_______。
(2)立体异构是有机化合物和无机化合物中都存在的同分异构现象。N2F2
存在顺式和反式两种同分异构体,据此事实,判断N2F2分子中两个氮原子之间的键型组成为_______。
A. 仅有一个 σ 键 B. 仅有一个 π 键 C. 一个 σ 键,一个 π 键 D. 两个 σ 键
写出 N2F2分子的顺式异构体的结构式_______。
16. (9 分)已知 a、b、c、d、e、f 是中学化学中常见的七种元素,其结构或者性质信息如下表所示:
元素 | 结构或者性质信息 |
a | 原子的 L 层上 s 能级电子数等于 p 能级电子数 |
b | 非金属元素,其单质为气态,有多种氧化物且都是大气污染物 |
c | 原子的最外层电子数是内层电子数的 3 倍 |
d | 元素的正三价离子的 3d 能级为半充满 |
e | 元素基态原子的 M 层全充满,N 层没有成对电子,只有一个未成对电子 |
f | 单质常温、常压下是易挥发的液体,基态原子的 N 层上有 1 个未成对的 p 电子 |
(1)元素 a 的原子核外共有______种不同运动状态的电子,有______种不同能级的电子。
(2)请比较 a、b、c 的电负性大小顺序为______(填元素符号)。a、c 的气态氢化物中,更稳定的是______(填化学式)。
(3)e 元素基态原子的简化电子排布式为______,f 元素基态原子的价电子轨道表示式是______。
(4)df2
与过量的 b 的最高价氧化物对应水化物的稀溶液反应,其中生成物有 HfO3和一种遇空气显红棕色的气体,试写出反应的化学方程式:______,若有 1 mol df2 参加反应,则转移的电子的物质的量为______。
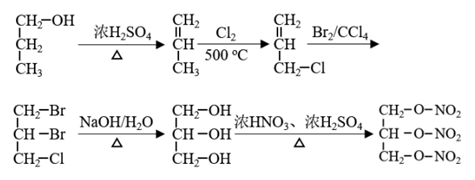
17. (7 分)药物合成是有机合成的重点发展领域之一。硝酸甘油(三硝酸甘油酯)是临床上常用的治疗心绞痛药物,其结构简式是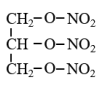
该药可以以丙醇为原料合成,请写出以1-丙醇为原料,通过五步合成硝酸甘油的合成路线(无机试剂任选,流程图示例: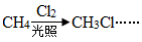 )。
)。
已知:CH2=CHCH3+Cl2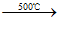 CH2=CHCH2Cl+HCl
CH2=CHCH2Cl+HCl
18.
(16 分)抗癌药托瑞米芬的前体K的合成路线如下。
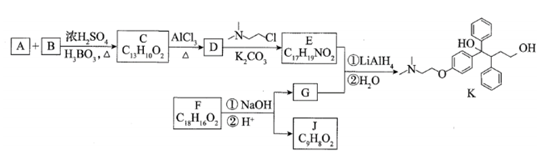
已知:ⅰ. 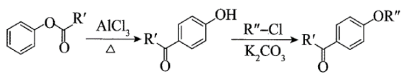
ⅱ. 有机物结构可用键线式表示,如(CH3)2NCH2CH3的键线式为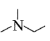
(1)有机物A能与Na2CO3溶液反应产生CO2,其钠盐可用于食品防腐。有机物B能与Na2CO3溶液反应,但不产生CO2;B加氢可得环己醇。A和B反应生成C的化学方程式是__________________________________________,反应类型是_____________。
(2)D中含有的官能团:________________________。
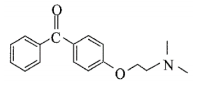
(3)E的结构简式为____________________________。
(4)F是一种天然香料,经碱性水解、酸化,得G和J。J经还原可转化为G。J的结构简式为_________________________________。
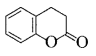
(5)M是J的同分异构体,符合下列条件的M的结构简式是___________________。
①包含2个六元环
②M可水解,与NaOH溶液共热时,1mol M最多消耗2mol NaOH
(6)推测E和G反应得到K的过程中,反应物LiAlH4和H2O的作用是_________。
(7)由K合成托瑞米芬的过程:
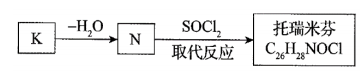
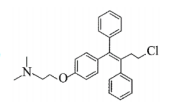
托瑞米芬具有反式结构,其结构简式是_________________
19. (16 分)实验小组探究KI 与 Cu(NO3)2的反应,进行实验一:
实验一
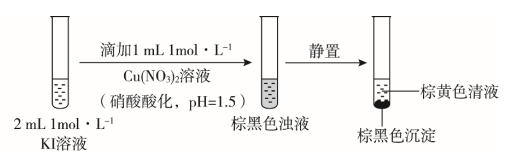
注:本实验忽略 Cu2+在此条件下的水解。
(1)取棕黄色清液,加入少量______溶液(试剂 a),清液变为______色,说明生成了 I2。
(2)探究生成 I2
的原因。
①甲同学进行如下实验:向2 mL
1 mol·L-1 KI 溶液中加入1 mL ______溶液(硝酸酸化,pH=1.5),再加入少量试剂 a,观察到与(1)相同的现象。甲同学由此得出结论:实验一中生成 I2
的原因是酸性条件下,NO3–氧化了I–。
②乙同学认为仅由甲的实验还不能得出相应结论。他的理由是该实验没有排除_____氧化I–的可能性。
③若要确证实验一中是NO3–氧化了 I–,应在实验一的基础上进行检验______的实验。
(3)探究棕黑色沉淀的组成。
①查阅资料得知:CuI为难溶于水的白色固体。于是对棕黑色沉淀的组成提出两种假设:a.CuI吸附 I2;b. _________吸附 I2。
为证明上述假设是否成立,取棕黑色沉淀进行实验二:
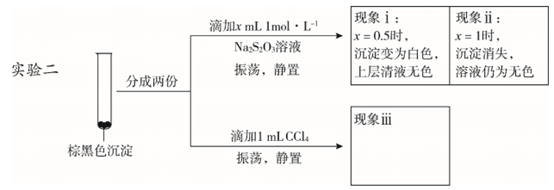
已知:
CuI难溶于CCl4;I2+2S2O32-===2I–+S4O62-(无色);Cu+ + S2O32-===Cu(S2O3)23-(无色)。
由实验二得出结论:棕黑色沉淀是CuI 吸附I2形成的。
②现象 iii 为________。
③用化学平衡移动原理解释产生现象 ii 的原因:________。
④由实验二可推知,Cu(NO3)2
与 KI 反应过程中,一定发生的反应的离子方程式为____________________。
参考答案
一、选择题(共 14 题,3 分/题,共 42 分)
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
答案 | A | D | C | C | B | A | B |
题号 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
答案 | C | C | B | D | B | C | C |
二、非选择题(共 58 分)
15. (10 分)
(1)
①120° ②i. > ii. 522 kJ
(2)C 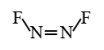
16. (9 分)
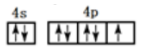
(1)6 3
(2)O>N>C H2O
(3)[Ar]3d 104s1
(4)3FeBr2 + 22HNO3 = 3Fe(NO3)3 + 6HBrO3 + 13NO↑ + 8H2O 13mol
17. (7 分)
18. (16 分)
(1)
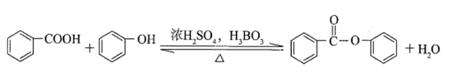
取代反应(或酯化反应)
(2)羟基、酮羰基
(3)
(4)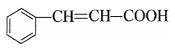
(5)
(6)还原(加成)
(7)
19. (16 分)
(1)淀粉
蓝(两空各 1 分)
(2)①2 mol·L−1 NaNO3(或KNO3)
②溶液中的 Cu2+,空气中的 O2
③NO3–的还原产物(NO、NO2
等)
(3)①Cu
②棕黑色固体颜色变浅,溶液变为紫红色
③CuI 在溶液中存在沉淀溶解平衡:CuI(s)
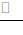 Cu+ (aq) + I– (aq),加入足量 Na2S2O3溶液后,S2O32-与 Cu+反应生成 Cu(S2O3)23-使 c(Cu+)减小,平衡右移从而使白色沉淀溶解
Cu+ (aq) + I– (aq),加入足量 Na2S2O3溶液后,S2O32-与 Cu+反应生成 Cu(S2O3)23-使 c(Cu+)减小,平衡右移从而使白色沉淀溶解
④2Cu2+ + 4I–===2CuI↓+ I2