本试卷共100分。考试时长90分钟。
可能用到的相对原子质量:
H 1 He 4 C 12 N 14 O 16 Na 23 K 39 Ca 40 Fe 56
第一部分(选择题
共50分)
每小题只有一个选项符合题意(1~25小题,每小题2分)
1.合金的应用促进了人类社会的发展。下列不属于合金的是
A.铝合金硬币 | B.青花瓷瓶 | C.钛合金鱼竿 | D.不锈钢盆 |
|
|
|
|
2.下列元素中,不属于第三周期的是
A.O B.Na C.Mg D.Cl
3.用洁净的铂丝蘸取NaCl溶液放在煤气灯外焰里灼烧,可观察到火焰的颜色为
A.紫色 B.绿色 C.黄色 D.红色
4.下列仪器不能加热的是
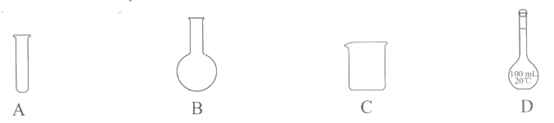
5.下列物质中,含有共价键的是
A.Cl2 B.KCl C.NaBr D.MgO
6.下列基本反应类型中,一定属于氧化还原反应的是
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
7.下列物质与Cl2反应,能发出苍白色火焰的是
A.H2 B.Na C.Fe D.Cu
8.下列粒子不具有氧化性的是
A.H+ B.O2 C.Mg D.CO2
9.下列物质能与水反应生成碱并放出气体的是
A.Na2O B.Na2O2 C.NaHCO3 D.Na2CO3
10.下列关于物质的分类的说法中,不正确的是
A.HNO3属于酸 B.NaOH属于碱
C.SO2属于氧化物 D.石灰水属于纯净物
11.当光束通过下列分散系时,能观察到丁达尔效应的是
A.NaCl溶液 B.蔗糖溶液 C.CuSO4溶液 D.Fe(OH)3胶体
12.下列物质中,属于电解质的是
A.Cu B.K2SO4 C.稀HNO3 D.酒精
13.元素钕(Nd)是稀土永磁材料中的一种重要元素。下列关于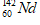 的说法中,不正确的是
的说法中,不正确的是
A.质子数为60 B.中子数为60 C.核外电子数为60 D.质量数为142
14.下列电离方程式书写不正确的是
A.HNO3=H++NO3– B. KOH=K++OH–
C.FeCl3 =Fe3++Cl– D. NH4NO3=NH4++NO3–
15.实验室中,下列行为不符合安全要求的是
A.在通风橱内制备有毒气体 B.将过期的化学药品直接倒入下水道
C.熄灭酒精灯时,用灯帽盖灭 D.用干燥沙土覆盖少量燃着的金属钠
16.下列物质的电子式书写不正确的是
A.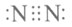 B.
B.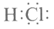 C.
C.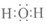 D.
D.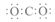
17.下列物质间的转化,不能一步实现的是
A.Na→Na2O B.Al→AlCl3 C. Fe→Fe3O4 D.Fe2O3→Fe(OH)3
18.下列各组离子能在溶液中大量共存的是
A.K+、NO3–、Cl– B.Na+、H+、CO32-
C.Na+、Cl–、Ag+ D.Fe2+、SO42-、OH–
19.铯是制造光电管的主要材料,铯元素的部分信息如图所示。下列关于铯的说法中,不正确的是

A.原子序数为55 B.是IA族元素
C.相对原子质量是132.9 g·mol-1 D.金属性比钠强
20.我国铝材工业水平处于世界领先行列。下列说法中,不正确的是
A.铝制餐具不宜长时间盛放酸性食物
B.常温下,铝制品耐腐蚀是因为铝不活泼
C.铝合金密度小、强度高,广泛应用于航空领域
D.工业上可以用NaOH溶液去除铝表面的氧化膜
21.下列反应能用H++OH–=H2O表示的是
A.2NaOH+CO2=Na2CO3+H2O B.NaOH+HCl=NaCl+ H2O
C.Cu(OH)2+2HCl=CuCl2+2H2O D.Ca(OH)2+ H2SO4=CaSO4↓+2H2O
22.下列说法中,正确的是
A.1 mol CO2中含有的原子数为NA
B.1 mol N2与1 mol O2的质量比为7:8
C.常温常压下,1 mol CO的体积是22.4 L
D.0.1 mol·L-1 Na2SO4溶液中含有0.2 mol Na+
23.下列图示中,表示在同温同压下等质量的氢气与氦气的混合气体的是
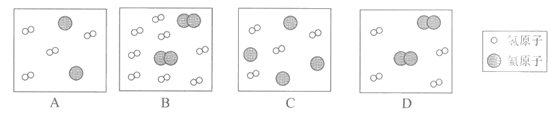
24.某同学向一定体积的Ba(OH)2溶液中滴加稀硫酸,测得混合溶液的导电能力随时间变化如图所示。下列说法中,正确的是
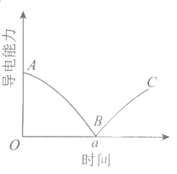
A.实验过程中反应的离子方程式为Ba2++ OH–+ SO42-+ H+=BaSO4↓+H2O
B.AB段溶液的导电能力减弱,说明生成的BaSO4不是电解质
C.a时刻Ba(OH)2溶液与稀硫酸恰好完全中和
D.BC段溶液的导电能力增大,主要是由于过量的Ba(OH)2电离出的离子导电
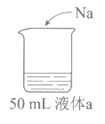
25.为研究Na的性质,进行如下实验
装置 | 实验 | |
| 液体a | 现象 |
蒸馏水 | I.Na浮在液面上,剧烈反应,产生少量白雾 | |
0.1 mol·L-1盐酸 | II.Na浮在液面上,反应比I中剧烈,产生白雾 | |
浓盐酸 | III.Na浮在液面上,反应比I中缓慢,产生大量白雾,烧杯底部有白色固体 | |
下列说法中,不正确的是
A.I中现象说明Na与水反应放热
B.I中反应的离子方程式为2Na+2H2O=2Na++2OH–+H2↑
C.III中白雾比II中多,说明III中反应放热比II中更多
D.推测III中反应缓慢可能与c(Cl–)以及生成的白色固体有关
第二部分(非选择题
共50分)
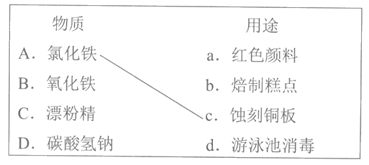
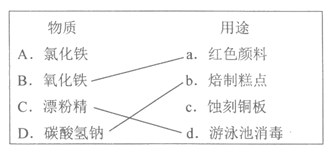
26.(3分)补齐物质与其用途之间的连线。
27.(4分)煤的气化是煤炭综合利用的重要途径之一,主要反应为
C+H2O(g)
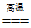 CO+H2。
CO+H2。
(1)该反应中,化合价升高的元素是_____________(填元素符号),氧化剂是_____________(填化学式)。
(2)若消耗了1 mol C,则生成CO的体积约是______________L(标准状况),转移电子的物质的量为_____________mol。
28.(4分)实验室用NaCl固体配制100 mL 2.00 mol·L-1的NaCl溶液,回答下列问题。
(1)需要称取NaCl固体_____________g。 [M (NaCl) =58.5g·mol-1]
(2)配制溶液时,必须用到的玻璃仪器有烧杯、胶头滴管、玻璃棒、量筒、_____________。
(3)下列操作中,正确的是_____________(填字母)。
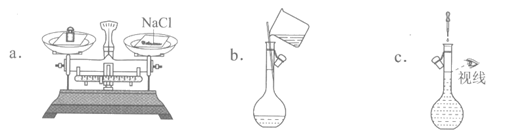
29.(3分)Na2CO3和NaHCO3是两种常见的钠盐。
(1)下列关于Na2CO3和NaHCO3的说法中,正确的是_____________(填字母)。
a.Na2CO3和NaHCO3的溶液均显碱性
b.相同温度下,NaHCO3的溶解度大于Na2CO3
c.向等质量的Na2CO3和NaHCO3固体中分别滴加足量的盐酸,相同条件下产生CO2的体积也相同
(2)按下图所示装置实验,可得到“Na2CO3的热稳定性比NaHCO3强“的结论,证据是_________________。
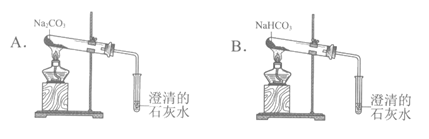
30.(5分)下表是元素周期表的一部分,请参照元素①~⑤在表中的位置,回答下列问题:
(1)①的原子结构示意图是_____________。
(2)②、③、④三种元素的原子半径最小的是_____________(写元素符号)。
(3)②和⑤可形成离子化合物,用电子式表示其形成过程_____________。
(4)下列事实能判断②和③的金属性强弱的是 _____________(填字母,下同)。
a.常温下单质与水反应置换出氢的难易程度
b.最高价氧化物对应的水化物的碱性强弱
c.相同温度下,最高价氧化物对应的水化物的溶解度大小
(5)硒(Se)位于第四周期,与①同主族。下列推断正确的是_____________。
a.SeO2只具有还原性
b.Se的最低负化合价是-2价
c.Se的气态氢化物的稳定性比①的强
31.(6分)阅读下面一段材料并回答问题。
高铁酸钾使用说明书 【化学式】K2FeO4 【性状】暗紫色具有金属光泽的粉末,无臭无味 【产品特点】干燥品在室温下稳定,在强碱溶液中稳定,随着pH减小,稳定性下降,与水反应放出氧气 K2FeO4通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。K2FeO4与水反应还能产生具有强吸附性的Fe(OH)3胶体,可除去水中细微的悬浮物,有净水作用 【用途】主要用于饮用水消毒净化、城市生活污水和工业污水处理 【用量】消毒净化1L水投放5 mg K2FeO4即可达到卫生标准 …… |
(1) K2FeO4中铁元素的化合价为_________________。
(2)制备K2FeO4需要在_____________(填“酸性“、“碱性“或“中性“)环境中进行。
(3)下列关于K2FeO4的说法中,不正确的是_____________。
a.是强氧化性的盐
b.固体保存需要防潮
c.其消毒和净化水的原理相同
d.其净水优点有:作用快、安全性好、无异味
(4)将K2FeO4与水反应的化学方程式补充完整:
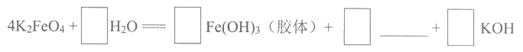
(5)消毒净化500 m3水,至少需要K2FeO4的质量为_____________kg。
32.(9分)某同学用下图装置制取Cl2并探究性质,回答下列问题:
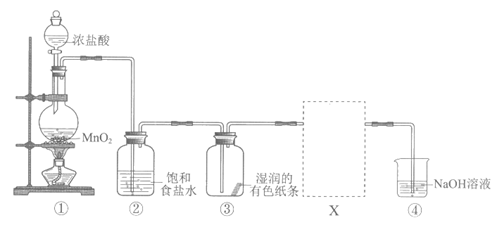
(1)装置①用于制取Cl2,反应的化学方程式是_____________。
(2)装置②的作用是_____________。
(3)装置③中的现象是_____________。
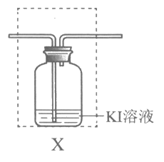
(4)为验证Cl2的氧化性强于I2,在③、④之间增加装置X,将装置X补充完整并标明所用试剂,装置X中发生反应的离子方程式是_____________。
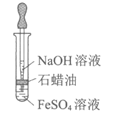
(5)装置④中发生反应的离子方程式是_____________。
33.(9分)某实验小组在实验室进行Fe(II)与Fe(III)相互转化的实验:
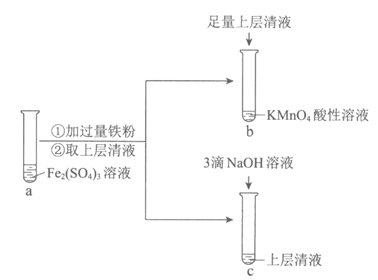
(1)检验试管a的溶液中含有Fe3+的实验方案为:在试管中加入少量a中溶液,_____________(填操作和现象),说明其中含有Fe3+。
(2)向试管a中加入过量铁粉的离子方程式是_____________。
(3)试管b中的实验现象是_____________。
(4)试管c中产生白色沉淀,一段时间后部分沉淀变为红褐色。写出白色沉淀变为红褐色的化学方程式__________________________。
(5)实验小组为探究反应物浓度对Fe(OH)2制备效果的影响,以Fe(OH)2沉淀白色持续时间(t)为指标,t越大,实验效果越好。部分实验数据如下:
实验 | 序号 | w (FeSO4)/% | w (NaOH) /% | t/s |
| i | 2.5 | 15 | 149 |
ii | 5 | 15 | 138 | |
iii | 10 | 15 | 93 | |
iv | 5 | 25 | 142 | |
v | 5 | 35 | 180 |
①实验i、ii、iii的目的是_________________。
②小组同学通过实验推断:其他条件不变时,所用NaOH溶液的浓度越大,实验效
果越好。推断的证据是_____________。
34.(7分)过氧化钙(CaO2)微溶于水,可作医用防腐剂、消毒剂,以下是制备CaO2的一种方法。
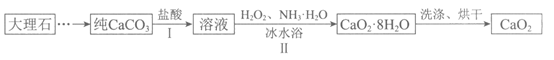
回答下列问题:
(1)步骤I中反应的离子方程式是_____________。
(2)步骤II中反应的化学方程式是:_____________=CaO2·8H2O↓+2NH4Cl
反应在冰水浴中进行,是为了防止NH3·H2O挥发、_____________(答1条即可)。
(3)待CaO2·8H2O结晶析出后通过_____________(填操作)分离。
(4) CaO2与水缓慢反应,常用作鱼塘的供氧剂,其反应的化学方程式是_________________。CaO2还可用于长途运输鱼苗,这体现了CaO2的_____________ (填字母)性质。
a.可缓慢供氧 b.能吸收鱼苗呼出的CO2 c.能潮解 d.可抑菌
(5) CaO2久置于空气中会生成CaCO3。为测定某CaO2样品的纯度,取10 g样品加入足量稀盐酸,测得生成CO2的质量为2.2 g,则样品中CaO2的质量分数为_____________。
参考答案
第一部分
选择题(每小题只有一个选项符合题意,共25个小题,每小题2分,共50分)
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
答案 | B | A | C | D | A | C | A | C | B | D | D | B | B |
题号 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
答案 | C | B | D | D | A | C | B | B | B | A | C | C |
第二部分
非选择题(共9个小题,共50分)其他合理答案均可给分
26.(3分)
27.(4分)
(1) C H2O (2) 22.4 2
28.(4分)
(1) 11.7 (2) 100 mL容量瓶 (3)b
29.(3分)
(1)a
(2)分别加热相同的时间后,A中澄清石灰水不变浑浊,B中澄清石灰水变浑浊
30.(5分)
(1)
 (2) Al (3)
(2) Al (3)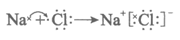
(4)a、b (5)b
31.(6分)(1) +6 (2)碱性 (3) C
(4)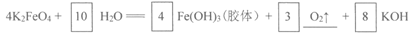
(5) 2.5
32.(9分)
(1) MnO2+4HCl(浓)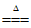 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(2)除去Cl2中混有的HCl气体
(3)黄绿色气体进入③中,湿润的有色纸条褪色
(4)
Cl2+ 2I–= 2Cl–+I2
(5) Cl2 +2OH–=Cl–+ClO–+H2O
33.(9分)
(1)滴加少量KSCN溶液,溶液变红色
( 2) 2Fe3++ Fe=3Fe2+
(3) KMnO4酸性溶液紫色褪去
(4) 4Fe(OH)2+O2+2H2O=4Fe(OH)3
(5)①探究其他条件相同时,制备Fe(OH)2所用FeSO4溶液的浓度对Fe(OH)2沉淀制备效果的影响
②沉淀白色持续时间v>iv>ii
34.(7分)
(1) CaCO3+2H+=Ca2++H2O+CO2↑
(2) CaCl2+H2O2+2NH3·H2O+6H2O
防止H2O2分解或有利于CaO2·8H2O结晶
(3)过滤
(4) 2CaO2+2H2O=2Ca(OH)2+O2↑ a、b、d
(5)50%