本试卷共100分。考试时长90分钟。
可能用到的相对原子质量:H 1 C 12 O 16 Sb 122
第一部分(共42分)
本部分共14小题,每小题3分,共42分。在每小题列出的4个选项中,选出最符合题目要求的一项。
1. 下列生活垃圾的处理方法不涉及化学变化的是
|
|
|
|
A. 堆肥发酵 | B. 焚烧发电 | C. 二次分拣 | D. 催化降解 |
2. 下列说法正确的是
A. O2和O3互为同位素
B. HCl的电子式为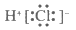
C. CO2的球棍模型为
D. 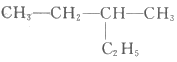 的名称为2-乙基丁烷
的名称为2-乙基丁烷
3. 下列物质的应用与氧化还原反应无关的是
A. 呼吸面具中用过氧化钠作供氧剂
B. 面团中加入小苏打,蒸出的馒头疏松多孔
C. 葡萄糖在人体内代谢,可为生命活动提供能量
D. 维生素C能促进补铁剂(有效成分FeSO4)的吸收
4. 下列实验室制取气体的方法不合理的是
A. 锌粒与稀硫酸反应制H2 B. 氯化铵受热分解制NH3
C. 电石与饱和食盐水反应制C2H2 D. 二氧化锰与浓盐酸共热制Cl2
5. 下列反应的离子方程式书写正确的是
A. 用Na2S除去废水中的Hg2+:S2-+Hg2+=HgS↓
B. 用FeCl3溶液刻蚀电路板上的铜:Fe3++Cu=Cu2++Fe2+
C. 用过量NaOH溶液脱除烟气中的SO2:OH-+SO2=HSO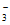
D. 用食醋处理水垢[主要成分CaCO3和Mg(OH)2]:2H++CaCO3=Ca2++CO2↑+H2O
2H++Mg(OH)2=Mg2++2H2O
6. 已知Cl、Se、Br在元素周期表中的位置如下图所示。下列说法不正确的是
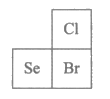
A. 原子半径:Se>Br>Cl-
B. 还原性:Br->Se2->Cl-
C. 酸性:HClO4>HBrO4>H2SeO4
D. 气态氢化物的稳定性:HCI>HBr>H2Se
7. 下列说法正确的是
A. 常温常压下,28g乙烯中氢原子的数目约为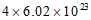
B. 含1mol Na2CO3的溶液中,CO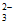 的数目约为
的数目约为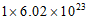
C. 25℃时,pH=11的氨水中,OH-的数目约为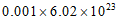
D. 在反应3NO2+H2O=2HNO3+NO中,每生成1mol HNO3转移的电子数约为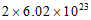
8. CO2与H2在催化剂作用下制CH3OH,主要涉及的反应有:
①CO2(g)+3H2(g)=CH3OH(g)+H2O(g)
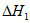 =-49.0kJ/mol
=-49.0kJ/mol
②CO2(g)+H2(g)=CO(g)+H2O(g)
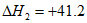 kJ/mol
kJ/mol
下列说法正确的是
A. ①为吸热反应
B. 若①中水为液态,则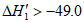 kJ/nol
kJ/nol
C. ②中反应物的总能量比生成物的总能量高
D. CO(g)+2H2(g)=CH3OH(g)
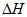 =-90.2kJ/mol
=-90.2kJ/mol
9. 下列实验能达到实验目的且操作正确的是
A | B | C | D |
证明氯化银的溶解度大于碘化银的溶解度 | 配制一定物质的量浓度的硫酸溶液 | 检验淀粉水解生成了葡萄糖 | 鉴别溴乙烷和苯 |
|
|
|
|
10. 某温度下N2O5按下式分解:2N2O5(g)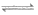 4NO2(g)+O2(g)。测得恒容密闭容器内,N2O5的浓度随时间的变化如下表:
4NO2(g)+O2(g)。测得恒容密闭容器内,N2O5的浓度随时间的变化如下表:
t/min | 0 | 1 | 2 | 3 | 4 | 5 | …… |
c(N2O5)/(mol/L) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 | …… |
下列说法不正确的是
A. 4min时,c(NO2)=1.50mol/L
B. 5min时,N2O5的转化率为83%
C. 0~2min内平均反应速率v(O2)=0.125mol/(L·min)
D. 其他条件不变,若起始c(N2O5)=0.50mol/L,则2min时c(N2O5)<0.25mol/L
11. 一种自修复材料在外力破坏后能够复原,其结构简式(图1)和修复原理(图2)如下所示。
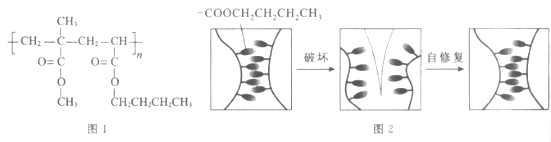
下列说法不正确的是
A. 该高分子可通过加聚反应合成
B. 合成该高分子的两种单体互为同系物
C. 使用该材料时应避免接触强酸或强碱
D. 自修复过程中”—COOCH2CH2CH2CH3“基团之间形成了化学键
12. 用下图装置探究原电池中的能量转化。图中注射器用来收集气体并读取气体体积,记录实验数据如下表:
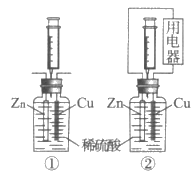
时间/min 据 | ① | ② | ||
气体体积/mL | 溶液温度/℃ | 气体体积/mL | 溶液温度/℃ | |
0 | 0 | 22.0 | 0 | 22.0 |
8.5 | 30 | 24.8 | 50 | 23.8 |
10.5 | 50 | 26.0 | - | - |
下列说法不正确的是
A. 两装置中反应均为Zn+H2SO4=ZnSO4+H2↑
B. 0~8.5min内,生成气体的平均速率①<②
C. 时间相同时,对比两装置的溶液温度. 说明反应释放的总能量①>②
D. 生成气体体积相同时,对比两装置的溶液温度,说明②中反应的化学能部分转化为电能
13. 25℃时,K2Cr2O7溶液中含铬微粒的浓度与溶液pH的关系(局部)如下图所示。K2Cr2O7溶液中存在平衡:Cr2O (橙色)+H2O
(橙色)+H2O 2CrO
2CrO (黄色)+2H+。
(黄色)+2H+。
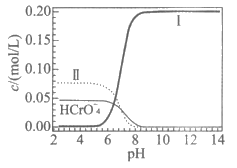
下列说法不正确的是
A. 曲线Ⅱ代表Cr2O 浓度
浓度
B. 改变溶液的pH,溶液颜色不一定发生变化
C. 溶液中存在c(HCrO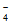 )+c(Cr2O
)+c(Cr2O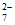 )+c(CrO
)+c(CrO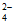 )=0.2mol/L
)=0.2mol/L
D. pH=7的K2Cr2O7和KOH混合溶液中存在c(K+)=c(HCrO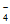 )+2c(Cr2O
)+2c(Cr2O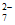 )+2c(CrO
)+2c(CrO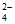 )
)
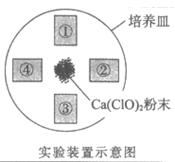
14. 用下图装置探究Cl2的漂白原理,其中红纸①是干燥的,红纸②~④分别用下表中的试剂润湿。向中心Ca(ClO)2粉末上滴加几滴盐酸,产生大量黄绿色气体,红纸变化如下:
| 红纸编号 | 试剂 | 红纸变化 |
① | —— | 不褪色 | |
② | 蒸馏水 | 逐渐褪色 | |
③ | 饱和食盐水 | 几乎不褪色 | |
④ | NaHCO3溶液(调至pH=7) | 快速褪色 |
已知酸性:H2CO3>HClO>HCO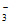 。
。
下列对于该实验的分析不正确的是
A. 对比①②的现象,说明红纸褪色涉及的反应是Cl2+H2O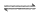 HCl+HClO
HCl+HClO
B. 对比②③的现象,说明能使红纸褪色的微粒是HClO
C. 对比②④的现象,说明能使红纸褪色的微粒一定不是H+
D. 对比②③④的现象,说明c(HClO)越大,漂白效果越好
第二部分(共58分)
本部分共5小题,共58分。
15. (10分)氯化钠是自然界中常见的盐,在生产生活中有着广泛的用途。
(1)自然界中的氯化钠
①从原子结构角度解释自然界中氯元素主要以Cl-形式存在的原因:_______________。
②海水晒制的粗盐中还含有泥沙、CaCl2、MgCl2以及可溶的硫酸盐等杂质,可以依次通过溶解、过滤、____________(选填字母序号;所加试剂均过量)、结晶等一系列流程得到精盐。
a. 加入Na2CO3溶液→加入NaOH溶液→加入BaCl2溶液→过滤→加入稀盐酸
b. 加入NaOH溶液→加入BaCl2溶液→加入Na2CO3溶液→加入稀盐酸→过滤
c. 加入BaCl2溶液→加入Na2CO3溶液→加入NaOH溶液→过滤→加入稀盐酸
③检验精盐中SO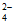 是否除净的原理是_____________(用离子方程式表示)。
是否除净的原理是_____________(用离子方程式表示)。
(2)食品加工中的氯化钠
①腌渍蔬菜时,食盐的主要作用是____________(选填字母序号)。
a. 着色剂 b. 防腐剂 c. 营养强化剂
②动物血制品富含蛋白质。在制作血豆腐的过程中,向新鲜动物血液中加入食盐,蛋白质发生了_____________(填”盐析”或”变性”)。
(3)氯碱工业中的氯化钠
①电解饱和食盐水总反应的化学方程式是______________。
②目前氯碱工业的主流工艺是离子交换膜法。阳极生成的气体中常含有副产物O2,结合下图解释O2含量随阳极区溶液的pH变化的原因:_______________________。
16. (15分)药物M可用于治疗动脉硬化,其合成路线如下。
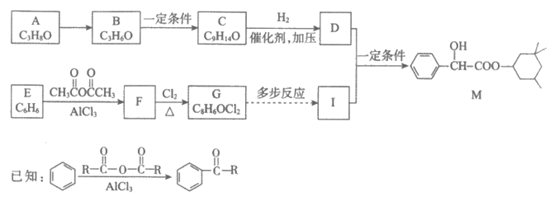
(1)M的官能团是______________。
(2)D与I通过酯化反应合成M的化学方程式是______________。
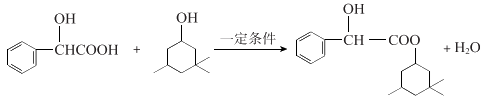
(3)B的核磁共振氢谱只有1个峰,A→B的化学方程式是______________。
(4)由C合成D的反应中n(C9H14O):n(H2)=__________________。
(5)E→F的反应类型是______________。
(6)已知: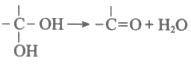
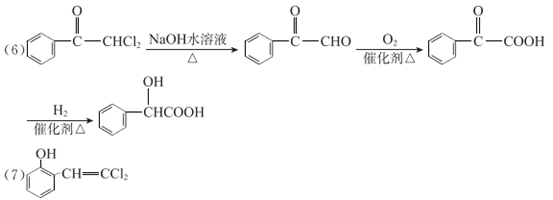
以G为原料,选择必要的无机试剂合成I2,设计合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件): ______________。
(7)G的同分异构体有多种,写出满足下列条件的同分异构体的结构简式:______________。
①不存在顺反异构
②结构中含有酚羟基
③苯环上有两个取代基且位于邻位
17.(10分)乙二醇锑[Sb2(OCH2CH2O)3]是一种无毒的白色晶状粉末,主要用作聚酯反应催化剂,其生产工艺流程如下:

(1)补全煅烧过程中的化学方程式: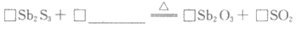
(2)醇化反应为可逆反应,其化学方程式是______________,为提高Sb2O3的平衡转化率,可采取的措施是______________(任写一条)。
(3)醇化时,最佳投料比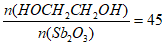 ,投料比过大导致产率降低的原因可能是__________________。
,投料比过大导致产率降低的原因可能是__________________。
(4)产品中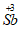 含量的测定:
含量的测定:
I.实验原理:用碘(I:)标准溶液将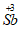 氧化为
氧化为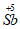 。
。
Ⅱ. 实验操作:称取m g产品置于锥形瓶中,用盐酸等试剂预处理后,再用a mol/L碘标准溶液滴定。接近终点时,加入2滴淀粉溶液,继续滴定至终点,消耗碘标准溶液体积为V mL。
①滴定终点的现象是______________。
②产品中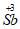 的质量分数是__________。
的质量分数是__________。
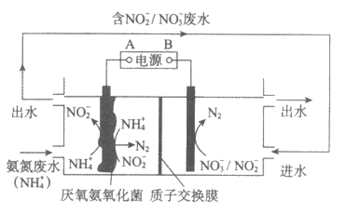
18. (11分)短程硝化–厌氧氨氧化工艺的目的是将氨氮(NH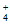 )废水中的氮元素转变为N2脱除,其机理如下:
)废水中的氮元素转变为N2脱除,其机理如下:

资料:氧气浓度过高时,NO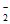 会被氧化为NO
会被氧化为NO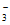 。
。
(1)该工艺中被氧化的微粒是______________。
(2)参与Ⅰ中反应的n(NH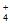 ):n(O2)=______________。
):n(O2)=______________。
(3)废水中的溶解氧浓度(DO)对氮的脱除率影响如图所示。当DO>2mg/L时,氮的脱除率为0,其原因可能是厌氧氨氧化菌被抑制,Ⅱ中反应无法发生;还有可能是______________。
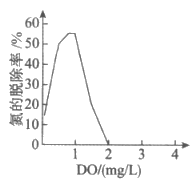
(4)经上述工艺处理后,排出的水中仍含有NO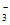 ,可以通过改进工艺提高氮的脱除率。
,可以通过改进工艺提高氮的脱除率。
①加入还原铁粉能有效除去NO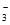 。该过程涉及的三个反应(a、b和c)如下:
。该过程涉及的三个反应(a、b和c)如下:
在整个反应过程中几乎监测不到NH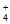 浓度的增加。试从化学反应速率的角度解释其原因:______________。
浓度的增加。试从化学反应速率的角度解释其原因:______________。
②采用微生物电解工艺也可有效除去NO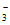 ,其原理如图所示。A是电源的____________极。结合电极反应式解释该工艺能提高氮的脱除率的原因:______________。
,其原理如图所示。A是电源的____________极。结合电极反应式解释该工艺能提高氮的脱除率的原因:______________。
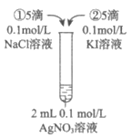
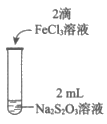
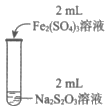
19.(12分)某实验小组对Na2S2O3分别与FeCl3、Fe2(SO4)3的反应进行实验探究。
实验药品:0.1mol/L Na2S2O3溶液(pH=7);0.1mol/L FeCl3溶液(pH=1);
0.05mol/L Fe2(SO4)3溶液(pH=1)。
实验过程:
实验编号 | Ⅰ | Ⅱ | Ⅲ |
实验操作 |
|
|
|
实验现象 | 溶液呈紫色,静置后紫色迅速褪去,久置后出现淡黄色浑浊 | 溶液呈紫色,静置后紫色褪去,久置后不出现淡黄色浑浊 | 溶液呈紫色,静置后紫色缓慢褪去,久置后不出现淡黄色浑浊 |
资料:i. Na2S2O3在酸性条件下不稳定,发生自身氧化还原反应;
ii. Fe3++S2O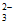
 Fe(S2O3)+,Fe2+遇S2O
Fe(S2O3)+,Fe2+遇S2O 无明显现象。
无明显现象。
暗紫色
(1)配制FeCl3溶液时,需要用盐酸酸化,结合离子方程式解释原因:______________。
(2)对实验Ⅰ中现象产生的原因探究如下:
①证明有Fe2+生成:取实验Ⅰ中褪色后的溶液,加入1~2滴K3[Fe(CN)6]溶液,观察到______________。
②实验Ⅰ中紫色褪去时S2O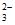 被氧化成S4O
被氧化成S4O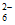 ,相关反应的离子方程式是___________。
,相关反应的离子方程式是___________。
③实验Ⅰ和Ⅱ对比,Ⅰ中出现淡黄色浑浊,而Ⅱ中不出现淡黄色浑浊的原因是______________。
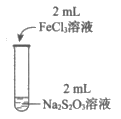
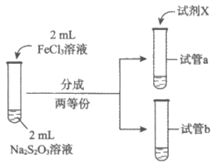
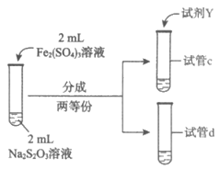
(3)为探究实验Ⅱ和Ⅲ中紫色褪去快慢不同的原因,设计实验如下:
实验编号 | Ⅳ | Ⅴ |
实验操作 |
|
|
实验现象 | 紫色褪去时间a>b | 紫色褪去时间c<d |
①试剂X是______________。
②由实验Ⅳ和实验Ⅴ得出的结论是______________。
【试题答案】
注:学生答案与本答案不符时,合理答案给分
第一部分(共42分)
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
答案 | C | C | B | B | A | B | A |
题号 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
答案 | D | D | D | D | C | C | B |
第二部分(共58分)
15.(10分)
(1)①氯原子结构示意图为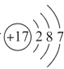 ,最外层为7个电子,且原子半径较小,易得1个电子形成稳定结构
,最外层为7个电子,且原子半径较小,易得1个电子形成稳定结构
②c ③Ba2++SO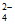 =BaSO4↓
=BaSO4↓
(2)①b ②盐析
(3)①2NaCl+2H2O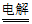 Cl2↑+H2↑+2NaOH
Cl2↑+H2↑+2NaOH
②随着溶液的pH增大,c(OH-)增大,OH-还原性增强,因此OH-更易在阳极放电,O2含量增大
16.(15分)
(1)酯基、羟基(或—COOR —OH)
(2)
(4)1:2
(5)取代反应
17.(10分)
(1)2Sb2S3+9O2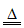 2Sb2O3+6SO2
2Sb2O3+6SO2
(2)3HOCH2CH2OH+Sb2O3
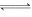 Sb2(OCH2CH2O)3+3H2O 分离出水蒸气(或适当增加乙二醇的用量)
Sb2(OCH2CH2O)3+3H2O 分离出水蒸气(或适当增加乙二醇的用量)
(3)投料比过大,导致生成的乙二醇锑浓度过低,不易结晶
(4)①溶液变为蓝色
②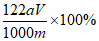
18.(11分)
(1)NH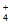
(2)2:3
(3)Ⅰ中产生的NO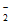 全部被氧化为NO
全部被氧化为NO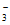 ,Ⅱ中反应因无反应物而无法发生
,Ⅱ中反应因无反应物而无法发生
(4)①NH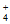 的消耗速率大于其生成速率,即反应速率c>b
的消耗速率大于其生成速率,即反应速率c>b
②正
阴极发生了2NO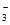 +12H++10e-=N2↑+6H2O,阳极区产生的NO
+12H++10e-=N2↑+6H2O,阳极区产生的NO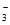 也能在阴极放电,使得废水中氮元素最终以N2的形式脱除
也能在阴极放电,使得废水中氮元素最终以N2的形式脱除
19.(12分)
(1)FeCl2溶液中存在平衡Fe3++3H2O 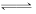 Fe(OH)3+3H+,加入盐酸,c(H+)增加,上述平衡左移,进而抑制Fe3+水解
Fe(OH)3+3H+,加入盐酸,c(H+)增加,上述平衡左移,进而抑制Fe3+水解
(2)①有蓝色沉淀生成
②2Fe3++2S2O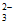 =2Fe2++S4O
=2Fe2++S4O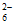 [或2Fe(S2O3)+=2Fe2++S4O
[或2Fe(S2O3)+=2Fe2++S4O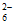 ]
]
③Ⅱ中Fe3+和S2O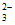 的物质的量之比为1:1,反应后S2O
的物质的量之比为1:1,反应后S2O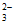 没有剩余;Ⅰ中S2O
没有剩余;Ⅰ中S2O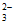 过量且溶液呈酸性,因此久置后溶液中发生反应2H++S2O
过量且溶液呈酸性,因此久置后溶液中发生反应2H++S2O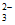 =S↓+SO2↑+H2O
=S↓+SO2↑+H2O
(3)①Na2SO4固体
②其他条件相同时,Cl-能加快Fe(S2O3)+发生反应,加速紫色褪去,而SO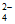 能减慢该反应
能减慢该反应