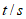本试卷共100分。考试时长90分钟。
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 Mn 55 Fe 56
第一部分
本部分共14题,每题3分,共42分。在每题列出的四个选项中,选出最符合题目要求的一项。
1. 2020年12月17日凌晨,嫦娥五号携带月壤等样本成功返回地球,完成中国探月工程的收官之战。下列说法不正确的是

A. 发射时使用液氢和液氧作推进剂,是利用了燃烧反应提供能量
B. 制造探测器中的瞄准镜时使用光导纤维,其主要成分是Si
C. 月壤中含有珍贵的3He,3He与4He互为同位素
D. 留在月球的国旗长时间不褪色、不分解,是利用了材料的稳定性
2. 下列物质在生活中的应用与氧化还原反应无关的是
A. CaO用作衣物防潮剂
B. 还原Fe粉用作食品脱氧剂
C. FeSO4补血剂与维生素C配合使用效果更佳
D. 用硅藻土中浸润的KMnO4吸收水果散发的乙烯
3. 下列化合物既含离子键又含共价键的是
A. H2O2 B. H2S C. NH4Cl D. KBr
4. 下列与事实对应的化学用语正确的是
A. Cl的非金属性强于I:2I-+Cl2=2Cl-+I2
B. C和O形成CO2的过程: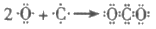
C. 0.1mol/L CH3COOH溶液的pH为3:CH3COOH=CH3COO-+H+
D. 用石墨电极电解CuCl2溶液:2Cl-+2H+ H2↑+Cl2↑
H2↑+Cl2↑
5. 中国化学会遴选了118名青年化学家作为”元素代言人”组成”中国青年化学家元素周期表”。元素Po(钋)与S同主族,由暨南大学陈填烽代言,其原子序数为84。下列说法正确的是
A. Po位于元素周期表的第4周期 B. 原子半径:Po<S
C. 210Po的中子数为126 D. PoO2只有还原性
6. 下列有关试剂保存和使用的措施不正确的是
A. 苯酚不慎滴到手上,用酒精清洗
B. 浓HNO3盛放在棕色试剂瓶中,避光保存
C. 保存FeSO4溶液时可加入少量铁粉和稀H2SO4
D. 配制1 mol/L NaOH溶液时,将称好的NaOH固体加入容量瓶中溶解
7. 用如图装置(夹持装置已略去)进行NH3制备及性质实验。下列说法不正确的是
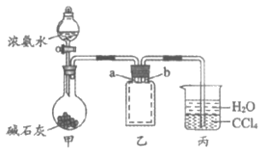
A. 甲中制备NH3利用了NH3·H2O的分解反应
B. 乙中的集气瓶内a导管短、b导管长
C. 若将丙中的CCl4换成苯,仍能防止倒吸
D. 向收集好的NH3中通入少量Cl2,可能观察到白烟
8. 高分子修饰指对高聚物进行处理,接上不同取代基改变其性能。我国高分子科学家对聚乙烯进行胺化修饰,并进一步制备新材料,合成路线如下图。
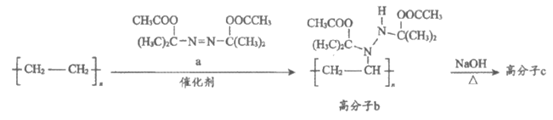
下列说法正确的是
A. a分子的核磁共振氢谱有4组峰
B. 生成高分子b的反应为加聚反应
C. 1mol高分子b最多可与2 mol NaOH反应
D. 高分子c的水溶性比聚乙烯的水溶性好
9. 下列各组微粒数目一定相等的是
A. 等体积的NO和NO2的N原子数目
B. 等质量的正丁烷和异丁烷的C-H键数目
C. 等物质的量浓度的KCl溶液和NaCl溶液的Cl-离子数目
D. 等质量的Cu分别与足量浓HNO3、稀HNO3反应生成的气体分子数目
10. 以黄铁矿(主要成分为FeS2,其中S的化合价为-1价)生产硫酸的工艺流程如下图。
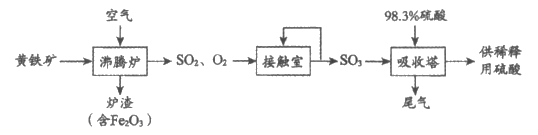
下列说法不正确的是
A. 将黄铁矿粉碎,可加快其在沸腾炉中的化学反应速率
B. 沸腾炉中每生成1 mol SO2,有11mol e-发生转移
C. 接触室中排放出的SO2、O2循环利用,可提高原料利用率
D. 吸收塔排放的尾气可通过氨吸收转化成氮肥
11. 研究者利用电化学法在铜催化剂表面催化还原CO制备乙烯,同时得到副产物乙醇,反应机理如下图。
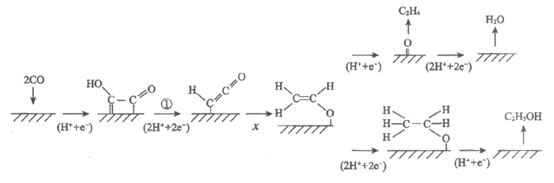
下列说法不正确的是
A. x为2H++e-
B. 步骤①中有H2O生成
C. 该电极上生成乙烯的总反应式为2CO+8H++8e-=C2H4+2H2O
D. 可通过增强催化剂的选择性来减少副反应的发生
12. 为研究沉淀的生成及转化,同学们进行下图所示实验。
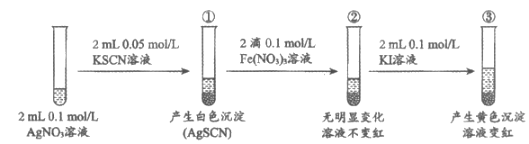
下列关于该实验的分析不正确的是
A. ①中产生白色沉淀的原因是c(Ag+)·c(SCN-)>Ksp(AgSCN)
B. ①中存在平衡:AgSCN(s) Ag+(aq)+SCN-(aq)
Ag+(aq)+SCN-(aq)
C. ②中无明显变化是因为溶液中的c(SCN-)过低
D. 上述实验不能证明AsSCN向AgI沉淀转化反应的发生
13. 室温下,向10mL 0.100mol/L Na2CO3溶液中逐滴滴加0.100 mol/L HCl溶液,整个反应过程中无气体逸出(溶解的CO2均表示为H2CO3)。测得混合溶液的pH随加入HCl溶液体积的变化如图。下列说法不正确的是
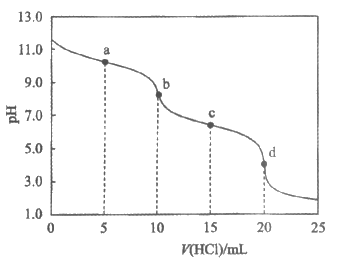
A. a点溶液的溶质主要为NaCl、Na2CO3、NaHCO3
B. b点溶液中c(CO )<c(H2CO3)
)<c(H2CO3)
C. c点溶液中c(Na+)+c(H+)=c(OH-)+c(HCO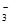 )+2c(CO
)+2c(CO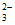 )
)
D. 取d点溶液加热至沸腾,然后冷却至室温,溶液的pH增大
14. 一定温度下,在容积恒为1L的容器中通入一定量N2O4,发生反应N2O4(g)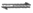 2NO2(g)
2NO2(g)
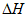 >0,体系中各组分浓度随时间(t)的变化如下表。
>0,体系中各组分浓度随时间(t)的变化如下表。
| 0 | 20 | 40 | 60 | 80 |
c(N2O4)/(mol/L) | 0.100 | 0.062 | 0.048 | 0.040 | 0.040 |
c(NO2)/(mol/L) | 0 | 0.076 | 0.104 | 0.120 | 0.120 |
下列说法正确的是
A. 0~60s,N2O4的平均反应速率为v=0.04 mol/(L·min)
B. 升高温度,反应的化学平衡常数值减小
C. 80s时,再充入NO2、N2O4各0.12mol,平衡不移动
D. 若压缩容器使压强增大,达新平衡后混合气颜色比原平衡时浅
第二部分
本部分共5题,共58分。
15. (10分)以下是生活中常用的几种消毒剂。
i. “84”消毒液,有效成分是NaClO。
ii. 消毒液A,其有效成分的结构简式为 (简称PCMX)。
(简称PCMX)。
iii. 双氧水消毒液,是质量分数为3%~25%的H2O2溶液。
(1)”84″消毒液需要在阴暗处密封保存,否则容易失效,用化学用语解释其原因:
①NaClO+H2O+CO2=NaHCO3+HClO;②________________。
(2)实验室通过测定不同pH环境中不同浓度NaClO溶液的细菌杀灭率(%),以探究”84″消毒液杀菌能力的影响因素,实验结果如下表。
NaClO溶液浓度 (mg/L) | 不同pH下的细菌杀灭率(%) | ||
pH=4.5 | pH=7.0 | pH=9.5 | |
250 | 98.90 | 77.90 | 53.90 |
500 | 99.99 | 97.90 | 65.54 |
①结合表中数据可推断,相同条件下,HClO的杀菌能力___________(填”强于””弱于”或”相当于”)NaClO的杀菌能力。
②下列关于”84″消毒液及其使用方法的描述中,正确的是__________(填字母序号)。
a. “84”消毒液的杀菌能力与其浓度有关
b. 长期用于对金属制品消毒,不会使金属腐蚀
c. 不能与洁厕灵(含HCl)混合使用,可能会导致安全事故
d. 喷洒在物品表面后适当保持一段时间,以达到消毒杀菌效果
(3)消毒液A常用于家庭衣物消毒。
①PCMX分子中的含氧官能团是___________(写名称)。
②若将消毒液A与”84″消毒液混合使用,会大大降低消毒效果,从物质性质的角度解释其原因为______________。
(4)研究小组将某”84″消毒液与双氧水消毒液等体积混合,有大量无色气体生成,经检验为氧气。用离子方程式表示生成氧气的可能原因:2H2O2=2H2O+O2↑、_________。
16. (14分)MnSO4是一种重要的化工产品。以菱锰矿(主要成分为MnCO3,还含有Fe3O4、FeO、CoO等)为原料制备MnSO4的工艺流程如下图。
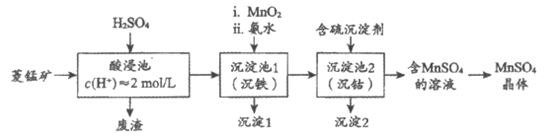
资料:金属离子沉淀的pH
金属离子 | Fe3+ | Fe2+ | Co2+ | Mn2+ |
开始沉淀 | 1.5 | 6.3 | 7.4 | 7.6 |
完全沉淀 | 2.8 | 8.3 | 9.4 | 10.2 |
(1)酸浸后所得溶液的金属阳离子包括Mn2+、Co2+、_____________。
(2)沉淀池1中,先加MnO2充分反应后再加氨水。写出加MnO2时发生反应的离子方程式:_______________________。
(3)沉淀池2中,不能用NaOH代替含硫沉淀剂,原因是______________________。
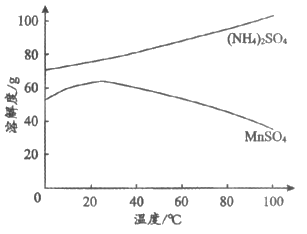
(4)下图为MnSO4和(NH4)2SO4的溶解度曲线。从”含MnSO4的溶液”中提取”MnSO4晶体”的操作为______________,洗涤干燥。
(5)受实际条件限制,”酸浸池”所得的废渣中还含有锰元素,其含量测定方法如下。
i. 称取ag废渣,加酸将锰元素全部溶出成Mn2+,过滤,将滤液定容于100mL容量瓶中;
ii. 取25.00mL溶液于锥形瓶中,加入少量催化剂和过量(NH4)2S2O8溶液,加热、充分反应后,煮沸溶液使过量的(NH4)2S2O8分解。
iii. 加入指示剂,用bmol/L(NH4)2Fe(SO4)2溶液滴定。滴定至终点时消耗(NH4)2Fe(SO4)2溶液的体积为c mL,MnO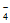 重新变成Mn2+。
重新变成Mn2+。
①补全步骤ii中反应的离子方程式:
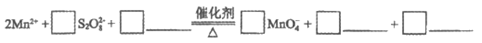
②废渣中锰元素的质量分数为______________。
(6)废渣长期露置于空气,其中的锰元素逐渐转化为MnO2。研究者用下图装置提取MnO2中的锰元素。图中”H·”代表氢自由基。实验测得电解时间相同时,随外加电流的增大,溶液中的c(Mn2+)先增大后减小,减小的原因可能是____________(写出两条)。
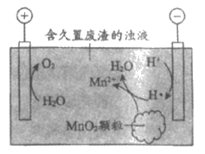
17. (10分)锂电池有广阔的应用前景。用”循环电沉积”法处理某种锂电池,可使其中的Li电极表面生成只允许Li+通过的Li2CO3和C保护层,工作原理如图1,具体操作如下。
i. 将表面洁净的Li电极和MoS2电极浸在溶有CO2的有机电解质溶液中。
ii. 0~5min,a端连接电源正极,b端连接电源负极,电解,MoS2电极上生成Li2CO3和C。
iii. 5~10min,a端连接电源负极,b端连接电源正极,电解,MoS2电极上消耗Li2CO3和C,Li电极上生成Li2CO3和C。步骤ii和步骤iii为1个电沉积循环。
iv. 重复步骤ii和步骤iii的操作,继续完成9个电沉积循环。
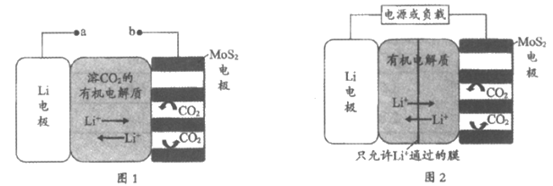
(1)步骤ii内电路中的Li+由____________向_____________迁移(填”Li电极”或”MoS2电极”)。
(2)已知下列反应的热化学方程式。
2Li(s)+2CO2(g)=Li2CO3(s)+CO(g)
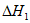 =-539 kJ/mol
=-539 kJ/mol
CO2(g)+C(s)=2CO(g) 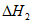 =+172 kJ/mol
=+172 kJ/mol
步骤ii电解总反应的热化学方程式为__________________。
(3)步骤iii中,Li电极的电极反应式为_________________________。
(4)Li2CO3和C只有在MoS2的催化作用下才能发生步骤iii的电极反应,反应历程中的能量变化如下图。下列说法正确的是_____________(填字母序号)。
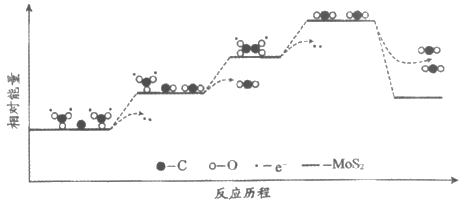
a. 反应历程中存在碳氧键的断裂和形成
b. 反应历程中涉及电子转移的变化均释放能量
c. MoS2催化剂通过降低电极反应的活化能使反应速率加快
(5)受上述”循环电沉积”法的启示,科学家研发了适用于火星大气(主要成分是CO2)的”Li—CO2“可充电电池,工作原理如图2。”Li-CO2“电池充电时,Li电极表面生成Li而不会形成Li2CO3和C沉积,原因是___________________________。
18. (12分)由C—H键构建C—C键是有机化学的热点研究领域。我国科学家利用N-苯基甘氨酸中的C—H键在O2作用下构建C—C键,实现了喹啉并内酯的高选择性制备。合成路线如下图。
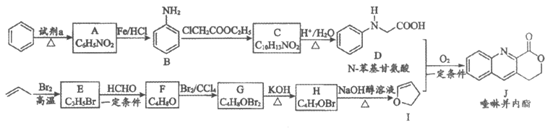
已知:
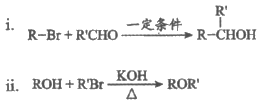
(1)试剂a为______________。
(2)B具有碱性,B转化为C的反应中,使B过量可以提高ClCH2COOC2H5的平衡转化率,其原因是_________________(写出一条即可)。
(3)C转化为D的化学方程式为____________________。
(4)G转化为H的化学方程式为________________;G生成H的过程中会得到少量的聚合物,写出其中一种的结构简式:__________________。
(5)已知:
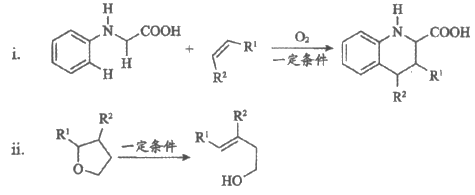
①D和I在O2作用下得到J的4步反应如下图(无机试剂及条件已略去),中间产物1中有两个六元环和—个五元环,中间产物3中有三个六元环。结合已知反应信息,写出中间产物1和中间产物3的结构简式。
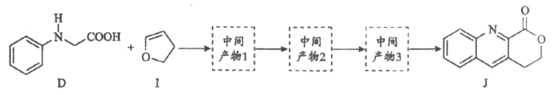
②D和I转化成J的反应过程中还生成水,理论上该过程中消耗的O2与生成的J的物质的量之比为______________。
19. (12分)某课外小组探究Cu(II)盐与Na2S2O3溶液的反应。
【查阅资料】
i. 2S2O +Cu2+
+Cu2+ [Cu(S2O3)2]2-(绿色),2S2O
[Cu(S2O3)2]2-(绿色),2S2O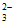 +Cu+
+Cu+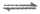 [Cu(S2O3)2]3-(无色);
[Cu(S2O3)2]3-(无色);
ii. 2NH3+Cu+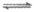 [Cu(NH3)2]
[Cu(NH3)2]
+(无色),[Cu(NH3)2]+遇空气容易被氧化成[Cu(NH3)4]2+(蓝色);
iii. S2O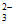 易被氧化为S4O
易被氧化为S4O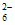 或SO
或SO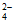 。
。
【猜想假设】
同学们根据资料认为Cu(II)盐与Na2S2O3可能会发生两种反应。
假设1:Cu2+与S2O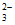 在溶液中发生络合反应生成[Cu(S2O3)2]2-;
在溶液中发生络合反应生成[Cu(S2O3)2]2-;
假设2:Cu(II)有__________性,与S2O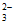 在溶液中发生氧化还原反应。
在溶液中发生氧化还原反应。
【实验操作及现象分析】
实验一:探究CuSO4与Na2S2O3溶液的反应。
实验操作 | 实验序号 | V1(mL) | V2(mL) | 逐滴加入Na2S2O3溶液时的实验现象 |
| a | 1.5 | 0.5 | 溶液逐渐变为绿色,静置无变化 |
b | 1.0 | 1.0 | 溶液先变为绿色,后逐渐变成浅绿色,静置无变化 | |
c | 0 | 2.0 | 溶液先变为绿色,后逐渐变浅至无色,静置无变化 |
(1)根据实验a的现象可推测溶液中生成的含Cu微粒是_____________(填化学符号)。
(2)甲同学认为实验一能证明假设2成立,他的理由是________________。
实验二:探究CuCl2与Na2S2O3溶液的反应。
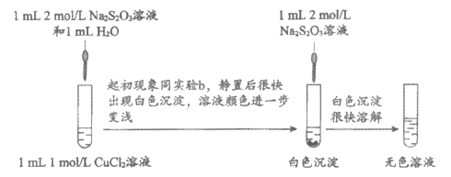
(3)乙同学利用已知资料进一步确证了实验二的无色溶液中存在Cu(I)。他的实验方案是:取少量无色溶液,__________________。
(4)经检验白色沉淀为CuCl,从化学平衡的角度解释继续加Na2S2O3溶液后CuCl沉淀溶解的原因:________________________。
(5)经检验氧化产物以S4O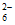 形式存在。写出Cu2+与S2O
形式存在。写出Cu2+与S2O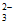 发生氧化还原反应得到无色溶液的离子方程式:__________________。
发生氧化还原反应得到无色溶液的离子方程式:__________________。
【获得结论】
综合以上实验,同学们认为Cu(II)盐与Na2S2O3在溶液中的反应与多种因素有关,得到实验结论:①随n(S2O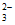 ):n(Cu2+)的增大,____________;②____________。
):n(Cu2+)的增大,____________;②____________。
【试题答案】
第一部分 选择题
(每小题只有1个选项符合题意,共14个小题,每小题3分,共42分)
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
答案 | B | A | C | A | C | D | C |
题号 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
答案 | D | B | B | A | D | C | C |
第二部分
非选择题(共58分)
评阅非选择题时请注意:
●
若无特别说明,每空2分。
●
文字表述题中其他答案合理也给分。
●
方程式中的产物漏写”↑”或”↓”不扣分;化学专用词汇若出现错别字为0分。
15.(10分)
(1)2HClO 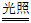 2HCl + O2↑
2HCl + O2↑
(2)①
强于(1分)
② acd
(3)①羟基(多答氯原子不扣分)(1分)
②PCMX(酚羟基)有还原性,NaClO有氧化性,二者能发生氧化还原反应
(4)ClO-+H2O2 = Cl-+O2↑+H2O
16. (14分)
(1)Fe2+、Fe3+
(2)2Fe2++MnO2+4H+= Mn2++2Fe3++2H2O
(3)若用NaOH作沉淀剂,Co2+沉淀完全时的pH=9.4,此时Mn2+也会沉淀,导致MnSO4产率降低
(4)蒸发结晶,趁热过滤
(5)① 2Mn2+
+ 5S2O2- 8 + 8H2O  2MnO4–
2MnO4–
+ 10SO2- 4 + 16H+
②
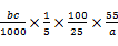 ×100%
×100%
(6)电流继续增大,Mn2+在阴极放电:Mn2++2e− =Mn,使得c(Mn2+)减小;H+放电直接生成H2而不是H,MnO2被H·还原的反应不能进行,使得c(Mn2+)减小;Mn2+在阳极放电生成MnO2,使得c(Mn2+)减小
17.(10分)
(1)Li电极 MoS2电极
(2)4Li(s)
+ 3CO2(g)=2Li2CO3(s)
+ C(s)H=-1250kJ/mol
(3)4Li+
+ 3CO2
+ 4e–=2Li2CO3
+ C
(4)a c
(5)电解质中未溶解CO2,内电路的隔膜只允许Li+通过不允许CO2通过,阴极生成的CO2无法迁移到阴极放电、转化为C和CO2- 3
18. (12分)
(1)浓硫酸、浓硝酸(1分)
(2)苯胺是反应物,增大原料的用量(苯胺具有碱性,与生成的HCl发生中和反应),使平衡正向移动,提高ClCH2COOC2H5的转化率
(3)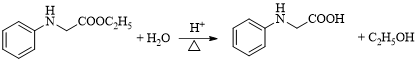
(4)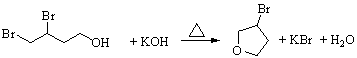
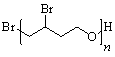
或
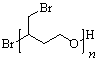
(5)①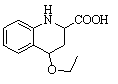
 (各1分)
(各1分)
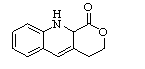
中间产物1 中间产物3
② 1:1(1分)
19.(12分)
【猜想假设】氧化(1分)
(1)[Cu(S2O3)2]2−(1分)
(2)实验b中,溶液先变为绿色,后逐渐变成浅绿色,说明先发生络合反应之后又发生氧化还原反应(或实验a到实验c,最终溶液颜色逐渐变浅,说明发生了氧化还原反应)
(3)向其中滴加氨水,放置在空气中,若溶液变为蓝色,则说明含Cu(I)
(4)CuCl(s) Cu+
Cu+
(aq)
+ Cl−
(aq),滴加Na2S2O3溶液后,S2O32−与Cu+形成络合离[Cu(S2O3)2]3−,c(Cu+)浓度降低,使平衡正向移动,沉淀溶解
(5)2Cu2++6S2O2- 3=2[Cu(S2O2- 3)2]3-
+ S4O2- 6
【获得结论】二者发生络合反应的趋势减弱,发生氧化还原反应的趋势增强;Cu(II)盐的阴离子为Cl-时能增大Cu2+和S2O32−发生氧化还原反应的趋势