(考试时间90分钟
满分100分)
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S32 Cu64
第一部分
每小题只有一个选项符合题意,每小题3分,共14道小题,共42分。
1. 新中国化学题材邮票记载了我国化学的发展历程,形象地呈现了人类与化学相互依存的关系。下列邮票内容所涉及的主要物质,属于无机化合物的是
A | B | C | D |
|
|
|
|
侯氏制碱法生产纯碱 | 化学工业生产橡胶 | 齐鲁三十万吨乙烯工程 | 人工全合成结晶牛胰岛素 |
2. 下列实验中的颜色变化与氧化还原反应无关的是
A. 将Na2O2粉末露置在空气中,固体由淡黄色变为白色
B. 向K2Cr2O7酸性溶液中加入乙醇,溶液由橙色变为绿色
C. 向AgCl悬浊液中滴加KI溶液,固体由白色变为黄色
D. 用FeCl3溶液浸泡覆铜电路板,溶液由黄色变为蓝绿色
3. 下列除杂试剂选取不合理的是
物质(括号内为杂质) | 所用试剂 | |
A | CO2(HCl) | 饱和NaHCO3溶液 |
B | C2H4(SO2) | 溴水 |
C | NO(NO2) | H2O |
D |
| NaOH溶液 |
4. X
、Y、Z、R、M为原子序数依次增大的短周期元素,其原子的最外层电子数与原子半径的关系如图所示。
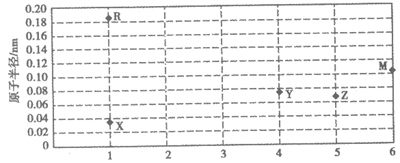
原子最外层电子数
下列说法不正确的是
A. Y形成的化合物种类最多
B. 同周期元素的简单阳离子中,R+的半径最大
C. 同主族中,M的最高价氧化物对应水化物的酸性最强
D. X的原子与Y、Z、R、M的原子均可形成共价化合物
5. 下列解释事实的离子方程式不正确的是
A. 用Na2S去除废水中的Hg2+:Hg2++S2-=HgS↓
B. 用醋酸溶解水垢中的碳酸钙:CaCO3+2CH3COOH=Ca2++2CH3COO–+CO2↑+H2O
C. 实验室用二氧化锰和浓盐酸共热制氯气:MnO2+4H++2Cl–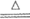 Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
D. 向明矾[KAl(SO4)2·12H2O]溶液滴加Ba(OH)2溶液至SO42-刚好沉淀完全:
Al3++SO42-+Ba2++3OH–=Al(OH)3↓+BaSO4↓
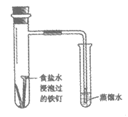
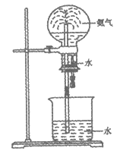
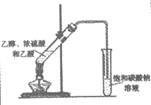
6. 下列实验方法不能达到实验目的的是
证明铁钉能够发生析氢腐蚀 | 证明氨气易溶于水 | 制备乙酸乙酯 | 制备Fe(OH)3胶体 |
|
|
|
|
A | B | C | D |
7. 有机化合物M的合成路线如下图所示:
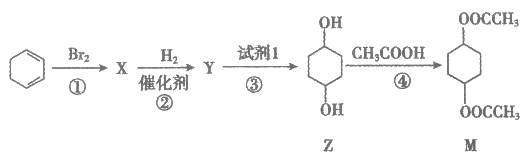
下列说法不正确的是
A. 反应①还可能生成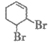
B. Y的分子式为C6H10Br2
C. 试剂1为NaOH醇溶液
D. 若用18O标记Z中的O原子,则M中一定含有18O
8. 我国研究人员研发了一种新型纳米催化剂,实现CO2和H2反应得到CH4,部分微粒转化过程如图(吸附在催化剂表面上的物种用*标注)。
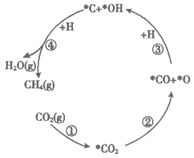
下列说法不正确的是
A. 过程②吸收热量
B. 过程③涉及极性键的断裂和形成
C. 结合过程③,过程④的方程式为
*C+*OH+5H→CH4+H2O
D. 整个过程中制得1 mol CH4转移电子的物质的量为8mol
9. 不同温度下,将1 mol CO2和3mol H2充入体积为1L的恒容密闭容器中发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
 H
H
平衡时CH3OH的物质的量分数随温度变化如图所示。
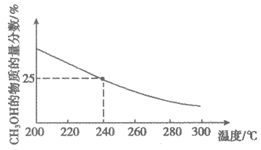
下列说法不正确的是
A. 该反应的△H<0
B. 240℃时,该反应的化学平衡常数K=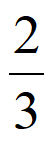
C. 240℃时,若充入2 mol CO2和6 mol H2,平衡时CH3OH的物质的量分数大于25%
D. 240℃时,若起始时充入0.5 mol CO2、2 mol H2、1 mol CH3 OH、1 mol H2O,反应向正反应方向进行
10. 双极膜能够在直流电场作用下将H2O解离为H+和OH–。以维生素C的钠盐(C6H7O6Na)为原料制备维生素C(C6H8O6,具有弱酸性和还原性)的装置示意图如下。
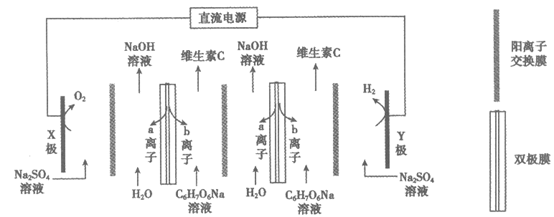
下列说法不正确的是
A. a离子是OH–,b离子是H+
B. 生成维生素C的离子方程式为C6H7O6–+H+=C6H8O6
C. X极的电极反应式为2H2O-4e–=O2↑+4H+
D. 将X极区的Na2SO4替换为C6H7O6Na,可以提高维生素C的产率
11. 实验室用如下方法制备饮用水消毒剂ClO2:
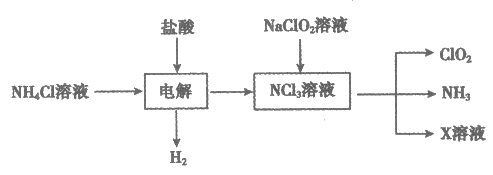
已知:NCl3为强氧化剂,其中N元素为-3价
下列说法不正确的是
A. NH4Cl的电子为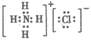
B. 电解池中总反应的化学方程式为NH4Cl+2HCl NCl3+3H2↑
NCl3+3H2↑
C. 若 NaClO2与NCl3恰好完全反应,则X为NaCl
D. 饮用水中残留的ClO2可用适量FeSO4溶液去除
12. 室温下,下列说法不正确的是
A. 中和等体积、等pH的CH3COOH溶液和盐酸,CH3COOH消耗的NaOH多
B. pH=9的CH3COONa溶液与pH=5的CH3COOH溶液,水的电离程度相同
C. 将0.2mol·L-1的CH3COOH溶液稀释一倍,CH3COOH的电离程度增大
D. 等体积、等浓度的CH3COOH溶液和NaOH溶液混合后,溶液中微粒浓度存在如下关系:c(OH–)=c(CH3COOH)+c(H+)
13. 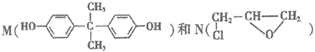 在一定条件下可制得环氧树脂粘合剂P,其结构如下:
在一定条件下可制得环氧树脂粘合剂P,其结构如下:
下列说法不正确的是
A. M苯环上的一溴代物有2种
B. N含有2种官能团
C. 相同条件下,苯酚也可以和N反应生成结构与P相似的高分子
D. 生成1 mol P的同时生成(n+2)mol HCl
14. 向碘水、淀粉的混合液中加入AgNO3溶液,蓝色褪去。为探究褪色原因,实验如下:
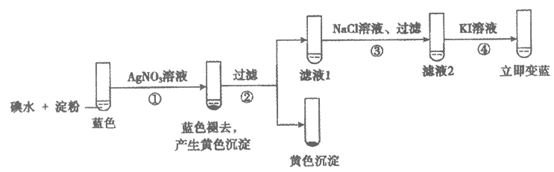
下列分析不正确的是
A. 过程①后溶液pH明显变小
B. 过程③中加入NaCl溶液的目的是除去Ag+
C. 不能判断4H++4I–+O2=2H2O+2I2是过程④中溶液变蓝的原因
D. 综合上述实验,过程①中蓝色褪去的原因是Ag+氧化了I2
第二部分
本部分共5题,共58分。
15. (10分)H2O2是一种重要的化工原料,蒽醌法是工业上合成H2O2的主要方法,氢氧直接合成法是近年研发的新方法。
I. 蒽醌法的反应过程如下。
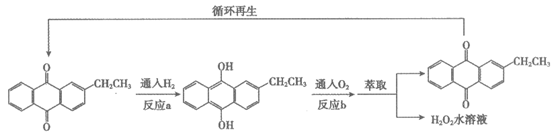
(1)已知2H2(g)+O2(g)===2H2O(l)
△H1=-572kJ·mol-1
2H2O2(1)=2H2O(l)+O2(g)
△H2=-196kJ·mol-1
蒽醌法生产H2O2总反应的热化学方程式是_________。
(2)发生反应b时,消耗 与O2的物质的量之比是________。
与O2的物质的量之比是________。
(3)测定H2O2含量:取所得H2O2水溶液a mL,用c mol·L-1 KMnO4酸性溶液滴定,消耗KMnO4酸性溶液v mL。
已知:MnO4–的还原产物是Mn2+。
①KMnO4酸性溶液与H2O2反应的离子方程式是________。
②所得H2O2水溶液中H2O2的物质的量浓度是________mol·L-1。
Ⅱ. 氢氧直接合成法的反应过程如图所示。
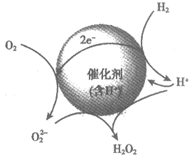
(4)用同位素示踪法研究催化剂中H+的作用:用D2(2H2)代替H2进行实验。催化剂中氢离子参与反应的证据是生成的过氧化氢中有________。
(5)H2转化率和H2O2选择性随反应时间的变化如下图。
已知:H2O2选择性是指H2O2在所有生成物中的占比。
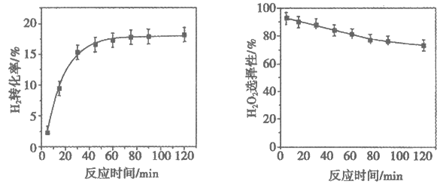
用化学方程式解释H2O2选择性逐渐下降的可能原因:_________。
16.(12分)天然气是一种绿色、优质能源,但其中含有的H2S会腐蚀管道设备,开采天然气后须及时除去H2S。
已知:i. 氢硫酸和碳酸的电离常数如下表
Ka1 | Ka2 | |
H2S | 1.3×10-7 | 7.1×10-15 |
H2CO3 | 4.4×10-7 | 4.7×10-11 |
ii.
(x-1)S+S2-(无色)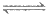 Sx2-(黄色)(x=2~6)
Sx2-(黄色)(x=2~6)
(1)醇胺法脱硫:醇胺对脱除H2S选择性很高,二乙醇胺脱硫原理如下。
(HOCH2CH2)2NH(1)+H2S(g) (HOCH2CH2)2NH2HS(l)
(HOCH2CH2)2NH2HS(l)
△H<0
①上述反应能够发生是因为二乙醇胺分子中含有________性基团。
②依据平衡移动原理推测脱硫后使二乙醇胺再生的方法有________(2种即可)。
(2)热碱法脱硫:用热碱液(Na2CO3溶液)吸收天然气中的H2S,可将其转化为可溶性的NaHS,反应的化学方程式是________。
(3)利用如下电解装置,可从吸收H2S后的热碱液中提取单质硫。
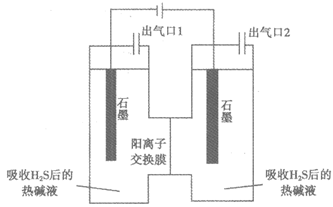
①电解一段时间后,阳极区溶液变黄,结合电极反应式解释原因:_________。
②取①中阳极区的黄色溶液,加入硫酸可得到单质硫,产率高达91.6%。推断黄色溶液中含硫微粒除Sx2-外,还有_________。
③电解一段时间后,阴极区得到的溶液可继续用于吸收H2S。该溶液中溶质一定含有_________(填化学式)。
17. (12分)Cu2(OH)2CO3是用途广泛的化工原料。可用电解废渣[含Cu(NO3)2、AgNO3]和纯碱为原料制备。
(1)制备CuSO4溶液

①过程I中,分解产生的气体除NO2外,一定还含有_________。
②过程Ⅱ中,分离所采用的试剂是_________。
(2)制备Cu2(OH)2CO3
i. 取Na2CO3溶液于锥形瓶中,水浴加热至适当温度。
ii. 将CuSO4溶液逐滴加入到Na2CO3溶液中,产生沉淀,静置。
ⅲ. 待沉淀完全沉降后,减压过滤、洗涤、干燥。
①步骤i中加热Na2CO3溶液的目的是_________。
②步骤ii中生成Cu2(OH)2CO3的化学方程式为_________。
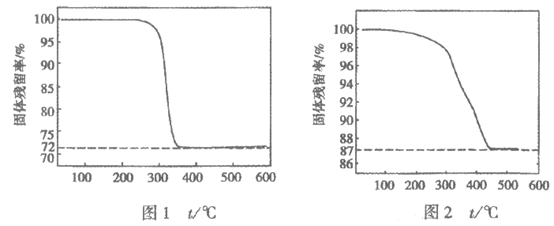
(3)设n(Na2CO3):n(CuSO4)=m,m不同时,所得产物纯度不同。通过测定固体样品的热重分析曲线(样品质量随温度变化曲线),获得固体残留率可检验样品纯度。
(已知:固体残留率= )。
)。
①写出Cu2(OH)2CO3分解的化学方程式_________。
②图1、图2分别是m=1.2和m=0.8时所得固体的热重分析曲线,依据下列曲线判断制备Cu2(OH)2CO3适宜的m=________(填“1.2”或“0.8”)。通过定量分析说明理由:_________。
18.(12分)苯巴比妥(M)是一种中枢神经系统药物,具有镇静、催眠、抗惊厥作用。其一种合成路线如下
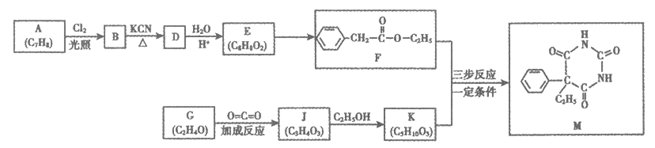
已知:i. RCN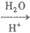 RCOOH
RCOOH
ii. R1COOR2+R3OH R1COOR3+R2OH
R1COOR3+R2OH
(1)A属于芳香烃,其名称为_________。
(2)B→D的反应类型是_________。
(3)E→F的化学方程式是_________。
(4)G和J的核磁共振氢谱都只有一组峰,J的结构简式是_________。
(5)F的同分异构体中,满足下列条件的有_________种。
①苯环上只有一个取代基;②能发生银镜反应;③能发生水解反应
(6)由F和K合成M的过程如下图(无机物略去):
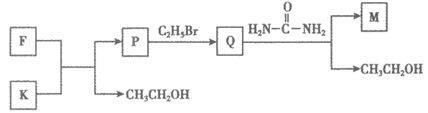
写出结构简式K:_________;P:_________。
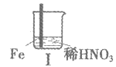
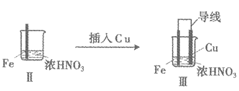
19. (12分)学习小组探究某浓度浓硝酸、稀硝酸分别与铁的反应。
实验 |
|
| |
现象 | I中:Fe表面产生大量无色气泡,液面上方变 为红棕色 | Ⅱ中:Fe表面产生红棕色气泡,过一会儿停止 | Ⅲ中:连接导线,一段时间后Fe表面产生红棕色气泡,而后停止;随即又产生红棕色气泡,而后停止,……如此往复多次。Cu表面始终产生红棕色气泡 |
(1)I中液面上方气体由无色变为红棕色的化学方程式为_________。
(2)取少量I中溶液,加入KSCN溶液,_________(填现象),说明产生了Fe3+。
(3)Ⅱ中现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应。说明硝酸具有_________性。
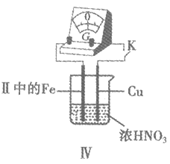
(4)Ⅲ中,连接导线后体系形成了原电池。为分析反应过程,在Fe、Cu之间连接电流计,实验如下。
实验 | 现象 |
| i. K闭合时,指针向左偏转(Cu做负极),Fe表面无明显现象 ii. 过一会儿指针向右偏,Fe表面产生红棕色气体;后又迅速向左偏,Fe表面停止产生气泡,……如此往复多次 ⅲ. 一段时间后,指针一直处于右端,Fe表面持续产生红棕色气体 iv. Cu表面始终产生红棕色气泡 |
①用方程式解释现象ⅳ:________。
②推测现象i中被还原的是________。
③解释现象ⅱ中指针左右偏转,往复多次的原因________。
④现象ⅲ中,Fe一直做负极,难以形成氧化层,可能的原因是________。
参考答案
第一部分
本部分共14题,每题3分,共42分。在每题列出的四个选项中,选出最符合题目要求的一项。
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
答案 | A | C | B | D | D | A | C | C | B | D |
题号 | 11 | 12 | 13 | 14 | ||||||
答案 | C | B | C | D |
第二部分
本部分共5题,共58分。
15.(10分)
(1)H2(g)+O2(g)=H2O2(1)
△H=-188kJ·mol-1
(2)1:1
(3)①2MnO4–+5H2O2+6H+=2Mn2++5O2↑+8H2O
②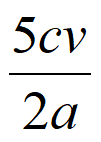
(4)HDO2或H2O2
(5)2H2+O2 2H2O、2H2O2
2H2O、2H2O2 2H2O+O2↑、(H2O2+H2
2H2O+O2↑、(H2O2+H2 2H2O)
2H2O)
16.(12分)
(1)①碱
②升高温度、降低压强
(2)Na2CO3+H2S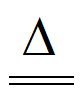 NaHS+ NaHCO3
NaHS+ NaHCO3
(3)①溶液中存在下列变化:HS–-2e–+HCO3–=S↓+H2O+CO2↑,HS– H++S2-,
H++S2-,
(x-1)S+S2- Sx2-,生成Sx2-导致溶液颜色变黄
Sx2-,生成Sx2-导致溶液颜色变黄
②SO32-(或S2O32-等)
③Na2CO3(Na2S)
17. (12分)
(1)①O2
②水
(2)①促进Na2CO3溶液水解,提高c(OH–),同时加快反应速率,有利于Cu2(OH)2CO3生成。
②2CuSO4+2Na2CO3+H2O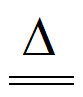 Cu2(OH)2CO3↓+CO2↑+2Na2SO4
Cu2(OH)2CO3↓+CO2↑+2Na2SO4
(或2CuSO4+3Na2CO3+2H2O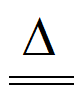 Cu2(OH)2CO3↓+2NaHCO3+2Na2SO4)
Cu2(OH)2CO3↓+2NaHCO3+2Na2SO4)
(3)①Cu2(OH)2CO3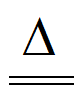 2CuO+CO2↑+H2O
2CuO+CO2↑+H2O
②1.2
依据Cu2(OH)2CO3受热分解的化学方程式,可知理论上固体残留率=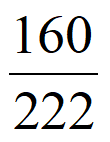 ×100%≈72.1%,与图1数据基本一致
×100%≈72.1%,与图1数据基本一致
18. (12分)
(1)甲苯
(2)取代反应
(3)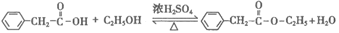
(4)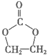
(5)5
(6)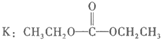
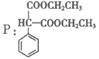
19. (12分)
(1)2NO+O2=2NO2
(2)溶液变成红色
(3)强氧化
(4)①Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,
NO3–+2H++e–=NO2↑+H2O
②铁表面的氧化层
③Fe做正极时,氧化层逐渐被还原而溶解,使Fe与浓HNO3接触,Fe失电子做负极,同时被氧化形成致密的氧化层。待氧化层完全形成后,Fe不能继续失电子,再次做正极。如此,指针左右偏转,往复多次。
④反应放热,溶液温度升高;随反应进行,硝酸浓度降低