本试卷共两部分,37道小题,满分70分。考试时间:70分钟。
可能用到的相对原子质量:H 1 C 12 O 16
第一部分
选择题(共25分)
一、选择题(每小题1分,共25分。每小题只有一个选项符合题意)
1. 空气中体积分数约为78%的气体是
A. O2 B. N2 C. CO2 D. 稀有气体
2. 地壳中含量最多的元素是
A. 氧 B. 硅 C. 铝 D. 铁
3. 下列物质的性质,属于化学性质的是
A. 颜色 B. 密度 C. 可燃性 D. 导电性
4. 下列物质中,能用作钾肥的是
A. K2SO4 B. CO(NH2)2 C. NH4NO3 D. Ca(H2PO4)2
5. 黑火药由硝酸钾、硫黄、木炭等混合而成。黑火药属于
A. 氧化物 B. 化合物 C. 纯净物 D. 混合物
6. 下列气体中,能供给动植物呼吸的是
A. N2 B. O2 C. H2 D. CO2
7. 下列物质属于合金的是
A. 铁 B. 钢 C. 铝 D. 铜
8. 下列物质分别放入水中,能形成溶液的是
A. 泥土 B. 面粉 C. 植物油 D. 蔗糖
9. 下列物质在空气中燃烧,生成大量白烟的是
A. 氢气 B. 红磷 C. 酒精 D. 甲烷
10. 下列物质通常不会损害人体健康的是
A. 甲醛 B. 黄曲霉毒素 C. 一氧化碳 D. 水
11. 垃圾分类从身边做起。废弃的矿泉水瓶属于
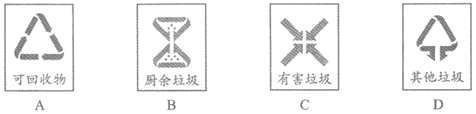
12. 下列净水操作中,净化程度最高的是
A. 沉降 B. 吸附 C. 过滤 D. 蒸馏
13. 下列实验操作正确的是
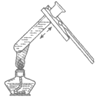
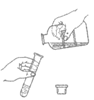
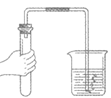
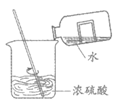
A. 给液体加热 B. 倾倒液体 C. 检查气密性 D. 稀释浓硫酸
14. 下列符号能表示两个氢原子的是
A. 2H B. 2H2 C. H2 D. H2O
15. 如图进行实验。当观察到热水大面积变成红色时,冷水中只有品红周围变成红色。该实验可以得到的结论是
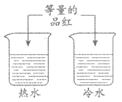
A. 分子的质量很小 B. 分子的大小与温度有关
C. 分子由原子构成 D. 分子运动速率与温度有关
16. 下列关于物质用途的描述不正确的是
A. 干冰用于人工降雨 B. 天然气用作燃料
C. 熟石灰用于改良碱性土壤 D. 铜用于制作铜火锅
17. 下列有关能源开发与利用中,通过化学反应提供能量的是




A. 发射航天飞机 B. 水车汲水灌溉 C. 潮汐能发电 D. 风力发电
18. 电解水实验如图所示。下列说法不正确的是
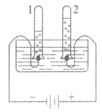
A. 试管2中得到的气体能使带火星的木条复燃
B. 理论上若得到8 mL氧气,同时可得到16mL氢气
C. 反应前后原子的种类、个数均改变
D. 该实验说明水由氢、氧两种元素组成
19. 下列做法不正确的是
A. 将鼻孔凑到容器口,闻药品的气味
B. 家用电器着火,立即切断电源
C. 天然气泄漏,立即关闭阀门并开窗通风
D. 不慎将燃着的酒精灯碰倒,立即用湿布盖灭
20. 下图是元素周期表中铬元素的信息,下列有关铬的说法正确的是
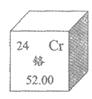
A. 质子数为52 B. 原子序数为24
C. 在地壳中的含量为52.00% D. 属于非金属元素
21. 下列物质不需要密封保存的是
A. 石灰水 B. 石灰石 C. 浓盐酸 D. 浓硫酸
22. 如图进行实验。搅拌后,石蜡熔化、塑料片掉落。该物质可能是
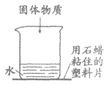
A. 蔗糖 B. 硝酸铵 C. 氯化钠 D. 氢氧化钠
23. 山梨酸(C6H8O2)是一种食品添加剂。下列关于山梨酸的说法正确的是
A. 山梨酸由碳和水组成
B. 山梨酸的相对分子质量为112g
C. 山梨酸由16个原子构成
D. 山梨酸中碳、氢、氧元素的质量比为9:1:4
24. 下列除去混合物中少量杂质的操作不合理的是
选项 | 物质 | 杂质 | 操作 |
A | CO | CO2 | 通入过量的氢氧化钠溶液 |
B | CaCl2溶液 | HC1 | 加入过量的碳酸钙,过滤 |
C | NaOH溶液 | Na2CO3 | 加入过量的稀盐酸 |
D | FeSO4溶液 | CuSO4 | 加入过量的铁粉,过滤 |
25. 甲、乙两种固体的溶解度曲线如下图所示。下列说法不正确的是
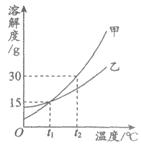
A. t2℃时,甲的溶解度大于乙的溶解度
B. t1℃时,甲、乙饱和溶液中溶质的质量分数均为15%
C. 将t2℃时乙的饱和溶液降温至t1℃,溶液仍饱和
D. 将t2℃时等质量的甲、乙饱和溶液分别降温至t1℃,析出甲的质量大
第二部分
非选择题(共45分)
【生活现象解释】
26. (2分)“微塑料“会带来环境、健康的问题。
(1)“微塑料“指直径小于5mm的塑料,它属于_______材料(填“合成“或“金属)”。
(2)研究显示“微塑料“已经侵入海洋生物体。提出1条减少塑料污染的措施:_________。
27. (5分)下图为生活中一些物质的pH。
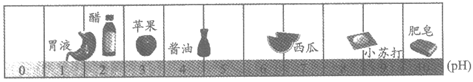
(1)图中醋的pH_____7(填“>“或“<“),溶液呈_____(填“酸“或“碱“)性。
(2)NaHCO3和Al(OH)3是治疗胃酸(主要成分盐酸)过多症的药剂。
① NaHCO3的俗称是_____。Al(OH)3与胃酸反应的化学方程式是_____。
②治疗胃酸过多的过程中,胃液的pH会_____(填“增大“或“减小“)。
【科普阅读理解】
28. (5分)阅读下列科普短文。
莲藕是一种营养价值很高的食品。新鲜的莲藕中含有丰富的营养物质。
新鲜莲藕中主要营养物质的含量(每100g)
淀粉/g | 蛋白质/g | 脂肪/g | 维生素/mg | 钙/mg | 磷/mg | 铁/mg |
10~20 | 1~2 | 0.2 | 25~55 | 39 | 58 | 1.4 |
莲藕经加工后可制成多种食品,如藕粉、藕片糖及藕脯等。藕粉加工工艺流程和下:
挑选→清洗→整作→轧浆→过滤→清漂(沉淀)→抽燥→晒干→捻碎→成品→贮存
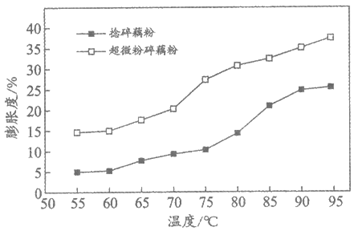
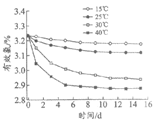
某些加工工艺中,将捻碎后的藕粉再进行超微粉碎。超微粉碎后,藕粉中的淀粉结构被破坏,促进其与水分子的结合,使藕粉具有更好的膨胀度,能快速溶解。下图为不同温度下捻碎和超微粉碎后藕粉膨胀度的比较。
此外,纯藕粉与空气接触后极易氧化,颜色由白色变为微红色,但不妨碍食用。
除食用外,莲藕还有很好的药用价值,具有补血益气、开胃健脾的功效。
依据文章内容回答下列问题。
(1)表中含量最高的营养素是________:“钙“是指________(填“原子“或“元素“)。
(2)依图判断,下列说法正确的是________(填序号,下同)。
A. 实验做了2组,每组选定9个温度
B. 实验范围内,两种藕粉的膨胀度均随温度升高而升高
C. 实验范围内,温度越高,两种藕粉的膨胀度差异越大
(3)藕粉在保存过程中会出现微红色,其原因是________。
(4)下列说法正确的是________。
A. 超微粉碎会破坏藕粉中的淀粉结构
B. 超微粉碎后的藕粉可制成速溶食品
C. 莲藕具有很好的药用价值
【生产实际分析】
29. (4分)利用空气合成氨的主要转化过程如图所示。
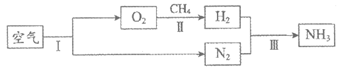
(1)I中发生的变化属于_______(填“物理“或“化学“)变化。
(2)Ⅱ中发生反应的化学方程式:CH4+O2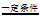 2H2+CO2,该反应属于基本反应类型中的_______反应。
2H2+CO2,该反应属于基本反应类型中的_______反应。
(3)Ⅲ中反应的微观示意图如下:
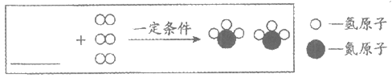
①在横线上补全相应微观粒子的图示。
②该反应中化合价改变的元素有______。
30. (3分)利用铝灰(主要成分为SiO2、Fe2O3、Al2O3)制取硫酸铝晶体的主要流程如下。
资料:SiO2难溶于水,且不与稀硫酸反应。
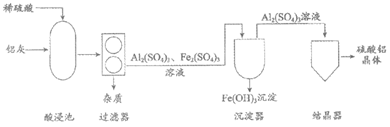
(1)沉淀器中Fe(OH)3属于_____(填序号)。
A. 氧化物 B. 酸 C. 碱 D. 盐
(2)过滤器中分离出的杂质主要是__________。
(3)酸浸池中发生的主要反应:Al2O3+3H2SO4=Al2(SO4)3+3H2O和_____。
【基本实验及其原理分析】
31. (3分)根据下图回答问题。
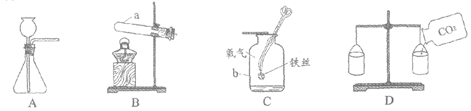
请从31-A和31-B两题中任选一个作答,若两题均作答,按A计分。
31-A | 31-B |
(1)仪器a的名称是_____。 (2)实验室用高锰酸钾制取氧气的化学方程式是_____。 (3)D中观察到右侧下沉,说明二氧化碳的性质是_____。 | (1)仪器b的名称是_____。 (2)实验室制取二氧化碳选用的发生装置是_____(填序号)。 (3)C中反应的化学方程式是_____。 |
32. (3分)去除粗盐中难溶性杂质的主要操作如图所示。
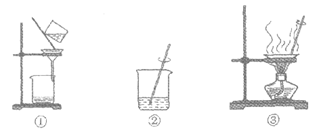
(1)正确的操作顺序是________(填序号,下同)。
(2)操作①中玻璃棒的作用是________。
(3)下列关于该实验的分析正确的是________。
A. 操作②利用了氯化钠易溶于水的性质
B. 操作③采用了蒸发溶剂的方法得到精盐
C. 若滤纸破损,精盐的产率偏低
33. (3分)利用如图所示装置进行实验。将过氧化氢溶液滴入瓶中,白磷燃烧。
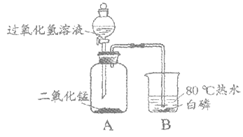
资料:白磷着火点为40℃。
(1)A中反应的化学方程式是________。
(2)能验证可燃物燃烧需要O2的实验现象是________。
(3)若要验证可燃物燃烧需要温度达到着火点,应补充的操作是________。
34. (3分)验证锌、铜、银3种金属的活动性。依据图中所示,向孔穴1~3中分别滴加X溶液。
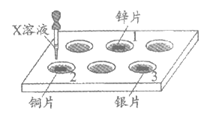
(1)若X是稀硫酸。产生明显现象的孔穴中发生反应的化学方程式是________。用稀硫酸不能达到实验目的,其理由是________。
(2)若只选择一种试剂达到实验目的,X是_______溶液。
35. (3分)利用下图装置进行实验(夹持装置略去)。实验前K1、K2和K3均已关闭。
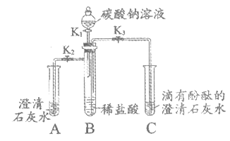
(1)打开K1和K2,滴入部分碳酸钠溶液,关闭K1。B中发生反应的化学方程式是________。A中观察到的现象是________。
(2)关闭K2、打开K3和K1,滴入碳酸钠溶液,关闭K1。观察到B中的液体流入C中,一段时间后,C中溶液澄清且无色,此时C中一定含有的溶质是________。
【科学探究】
36. (6分)次氯酸钠(NaClO)是常用的含氯消毒剂之一,是“84消毒液“的有效成分。
【查阅资料】
①有效氯含量可用来衡量含氯消毒剂的消毒灭菌能力。
②次氯酸钠不稳定,易分解,会导致有效氯含量降低。
I. 探究次氯酸钠溶液稳定性的影响因素
【进行实验】
序号 | 实验操作 | 实验结果 |
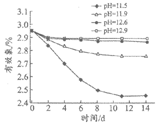
1-1 | 取相同体积、相同pH的次氯酸钠溶液,分别在温度为15℃、25℃、30℃、40℃条件下,放置15天,检测有效氯含量。 |
|
1-2 | 25℃时,取相同体积,pH分别为11.5、11.9、12.6、12.9的次氯酸钠溶液,放置14天,检测有效氯含量。 |
|
【解释与结论】
(1)用Cl2和NaOH溶液制备次氯酸钠,补全其反应的化学方程式:
Cl2+2NaOH=NaClO+NaCl+_________
(2)实验1-2的目的是________。
Ⅱ. 探究次氯酸钠溶液的灭菌效果
【进行实验】取某污水处理厂含粪大肠菌群的水样,按照①~⑤条件,用新制的次氯酸钠溶液进行实验,记录如下:
序号 | ① | ② | ③ | ④ | ⑤ | |
实验 条件 | pH | 7. 25 | 7. 25 | 7. 25 | 7. 25 | 7. 25 |
温度/℃ | 16. 8 | 16. 8 | 16. 8 | 16. 8 | 16. 8 | |
接触时间/min | 5 | 5 | 5 | 12 | 30 | |
有效氯含量/(mg/L) | 2 | 5 | 8 | 2 | 2 | |
粪大肠菌群灭菌率/% | 90 | 99.87 | 99.94 | 94.99 | 99.37 | |
【解释与结论】
(3)探究“接触时间是否影响灭菌效果“的实验是________(填序号)。
(4)由实验Ⅱ可知,次氯酸钠中有效氯含量与灭菌效果的关系是________。
【反思与评价】
结合上述实验,回答下列问题:
(5)使用Cl2和NaOH溶液制备次氯酸钠时,需控制较低的反应温度。推测其原因是________。
(6)在冬季水温较低时,欲提高次氯酸钠溶液的灭菌率,你的建议是________。
【实际应用定量分析】
37. (5分)甲醇(CH3OH)是一种重要的化工原料,利用废气中的二氧化碳可以制备甲醇。其原理:CO2+3H2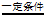 CH3OH+H2O
CH3OH+H2O
(1)H2O中氢元素的质量分数为11.1%,其计算式为________。
(2)配制100g质量分数为15%的甲醇溶液,需要甲醇的质量是________g。
(3)计算制备32kg甲醇,至少需要二氧化碳的质量是多少?(写出计算过程)
参考答案
第一部分
选择题(每小题只有一个选项符合题意,共25个小题,每小题1分,共25分)
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
答案 | B | A | C | A | D | B | B | D | B | D |
题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
答案 | A | D | C | A | D | C | A | C | A | B |
题号 | 21 | 22 | 23 | 24 | 25 | |||||
答案 | B | D | D | C | B |
第二部分
非选择题(共12个小题,共45分)说明:每空1分。其他合理答案均可给分。
26. (2分)
(1)合成
(2)减少使用塑料
27. (5分)
(1)<
酸
(2)①小苏打 Al(OH)3+3HCl=AlCl3+3H2O ②增大
28. (5分)
(1)糖类
元素
(2)AB
(3)纯藕粉与空气接触后极易氧化,颜色由白色变为微红色
(4)ABC
29. (4分)
(1)物理
(2)置换
(3)①
②N、H
30. (3分)
(1)C (2)SiO2 (3)Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
31. (3分)
31-A | 31-B |
(1)试管 (2)2KMnO4 (3)相同条件时,二氧化碳的密度比空气的大 | (1)集气瓶 (2)A (3)3Fe+2O2 |
32. (3分)
(1)②①③
(2)引流
(3)AB
33. (3分)
(1)2H2O2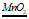 2H2O+O2↑
2H2O+O2↑
(2)B中白磷在通入氧气前不燃烧,通入氧气后燃烧
(3)向B中烧杯里加入冰块,降温至40℃以下(或在B中导管口处放一小块红磷)
34. (3分)
(1)Zn+H2SO4=ZnSO4+H2↑
孔穴2、3均无明显现象,不能验证铜、银的金属活动性
(2)CuSO4
35. (3分)
(1)Na2CO3+2HCl=2NaCl+H2O+CO2↑
导管口有气泡冒出,澄清石灰水变浑浊
(2)CaCl2、NaCl
36. (6分)
(1)H2O
(2)探究pH对次氯酸钠溶液稳定性的影响
(3)①④⑤
(4)在pH、温度和接触时间相同时,有效氯含量在2~8mg/L范围内,有效氯含量越高,灭菌效果越好
(5)次氯酸钠的分解速率随温度升高而加快,低温可防止次氯酸钠分解
(6)适当提高次氯酸钠溶液中有效氯的含量
(或适当延长次氯酸钠溶液与菌群的接触时间)
37. (5分)
(1)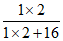 ×100%
×100%
(2)15
(3)解:设至少需要二氧化碳的质量为x。
CO2+3H2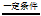 CH3OH + H2O
CH3OH + H2O
44 32 ……(1分)
x 32kg
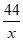 =
=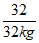 ………(1分)
………(1分)
x=44kg ………(1分)
答:至少需要二氧化碳的质量为44kg。

 K2MnO4+ MnO2+O2
K2MnO4+ MnO2+O2 Fe3O4
Fe3O4