本试卷满分共100分
考试时间90分钟
可能用到的相对原子质量:
H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 Cu 64 Ag 108
第一部分
选择题(共42分)
下列各题的四个选项中,只有一个选项符合题意。(每小题3分,共42分)
1. 化学可使生活更美好。下列说法不正确的是
A. 食盐可用作调味剂,也可作食品防腐剂
B. 包装用材料聚乙烯和聚氯乙烯都属于烃
C. 疫苗一般应冷藏存放,目的是避免蛋白质变性
D. 利用油脂的皂化反应可制得高级脂肪酸盐和甘油
2. 下列氧化还原反应中,水作氧化剂的是
A. C+H2O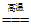 CO+H2 B. 2Na2O2 +2H2O=4NaOH+O2↑
CO+H2 B. 2Na2O2 +2H2O=4NaOH+O2↑
C. 2F2+2H2O=4HF+O2 D. 3NO2+H2O=2HNO3+NO
3. 不能作为判断S、Cl两种元素非金属性强弱的依据是
A. 单质氧化性的强弱 B. 单质沸点的高低
C. 单质与氢气化合的难易 D. 最高价氧化物对应水化物酸性的强弱
4. 下列说法不正确的是
A. 丁达尔效应可鉴别胶体与溶液
B. 红外光谱可区分乙醇与二甲醚
C. 碘水可检验淀粉是否发生水解
D. 乙醇易溶于水是因为其分子与水分子间形成氢键
5. 下列化学用语正确的是
A. 氢氧化铝电离:Al(OH)3=Al3++3OH–
B. 氯气溶于水:Cl2+H2O=2H++Cl–+ClO–
C. 氯气与石灰乳反应制漂白粉:2Cl2+Ca2++2OH–=2Cl–+Ca(ClO)2 +2H2O
D. 向Mg(OH)2悬浊液中滴酚酞后溶液变红:Mg(OH)2(s)
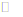 Mg2+ (aq) +2OH– (aq)
Mg2+ (aq) +2OH– (aq)
6. 淀粉在人体内被转化成葡萄糖为机体提供能量,是重要的食品工业原料。
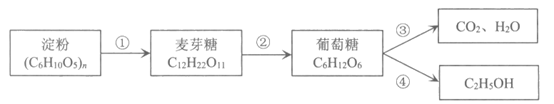
下列说法不正确的是
A. 淀粉属于天然有机高分子 B. ③的反应为人体提供能量
C. ④的反应是水解反应 D. 麦芽糖与蔗糖互为同分异构体
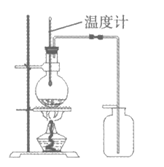
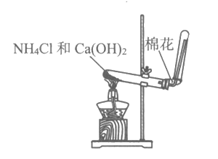
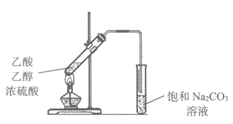
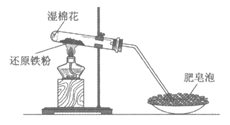
7. 下列实验装置不正确的是
A. 制取并收集乙烯气体 | B. 制取并收集氨气 |
|
|
C. 制取乙酸乙酯 | D. 铁粉与水蒸气反应 |
|
|
8. 设NA为阿伏加德罗常数的值,下列说法正确的是
A. 2 L 0.5 mol/L CH3COOH溶液中含有H+的数目为NA
B. 23g Na与足量H2O反应完全后生成H2的体积为11.2 L
C. 密闭容器中2mol SO2与1 mol O2充分反应,产物的分子数为2NA
D. 物质的量相同的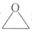 和CH3CHO所含共价键数目相同
和CH3CHO所含共价键数目相同
9. 在RH-10Fe的作用下,合成某有机化合物的催化机理如图所示。下列说法不正确的是资料:
1. RH-10Fe是常温下以溶剂萃取和溶胶凝胶法,利用Fe(NO3)3溶液和稻谷壳中提取的硅酸盐材料制得的Fe-Si催化剂。
2. 硅酸盐材料具有多孔状结构,热稳定性佳,可用作催化剂载体。
A. 催化剂具有选择性
B. 硅酸盐材料可用作催化剂载体参与化学反应
C. RH-10Fe催化可提高反应物的平衡转化率,原子利用率达100%
D. 总反应式为:
10. 依据图示关系,下列说法不正确的是
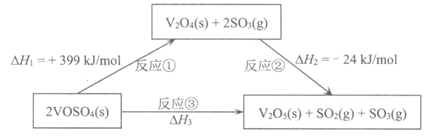
A. 反应①是吸热反应
B. △H3=△H1+△H2
C. 反应③是一个熵增的反应
D. 数据表明:V2O5(s)的能量比V2O4(s)低,更稳定
11. 甲、乙、丙、丁均为中学化学中常见的单质或化合物,它们之间的转化关系如下图所示(部分产物已略去),下列各组物质中不能实现如图所示关系转化的是
选项 | 甲 | 乙 | 丙 | 丁 | 物质间的转化 |
A | CuO | CO2 | CO | C |
|
B | Fe | Fe(NO3)2 | Fe(NO3)3 | HNO3 | |
C | AlCl3 | Al(OH)3 | NaAlO2 | NH3·H2O | |
D | CO2 | NaHCO3 | Na2CO3 | NaOH |
12. 某温度下,反应2H2
(g)+CO (g)
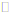 CH3OH (g)在密闭容器中达到平衡时,测得c(H2)=0.4mol/L,c(CO)=0.2mol/L,C(CH3OH)=0.3mol/L,相同温度下,按照下列4组初始浓度进行实验,反应能够正向进行的是
CH3OH (g)在密闭容器中达到平衡时,测得c(H2)=0.4mol/L,c(CO)=0.2mol/L,C(CH3OH)=0.3mol/L,相同温度下,按照下列4组初始浓度进行实验,反应能够正向进行的是
选项 | c(H2)/mol/L | c(CO)/ mol/L | C(CH3OH)/mol/L |
A | 1.00 | 0.10 | 1.00 |
B | 0.10 | 2.00 | 0.05 |
C | 0.02 | 5.00 | 0.30 |
D | 0.15 | 0.10 | 0.60 |
13. 下列图示与对应叙述相符的是
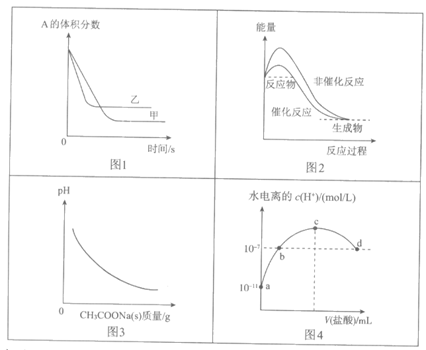
A. 图1表示压强对可逆反应2A(g)+B(g) 3C(g)+ D(s)的影响,乙的压强大
3C(g)+ D(s)的影响,乙的压强大
B. 图2表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
C. 图3表示在CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化
D. 图4表示常温下向20 mL 0.1 mol/L氨水中滴加稀盐酸,c点溶液中c(NH4+)<c(Cl–)
14. 某实验小组为研究黄铜(Cu-Zn合金)的抗腐蚀性能,进行了系列实验,结果如下:
实验 | 0~1h | 1h | 2h | |
1 | 6mol/L盐酸 | 无气泡产生 | ||
2 | 3 mol/L硫酸 | 无气泡产生 | 黄铜表面出现少量小气泡,反应缓慢 | 黄铜表面小气泡数量增加不明显,反应缓慢 |
3 | 6mol/L硝酸 | 2min时出现较多气泡,反应迅速进行;10min时出现明显的红棕色气体 | 溶液变为蓝色,反应持续进行,但不剧烈 | 溶液变为蓝色,反应持续进行,较为缓慢 |
4 | 2mol/L硝酸 | 黄铜表面出现少量小气泡,反应缓慢 | 溶液出现淡蓝色,反应缓慢 | 溶液出现淡蓝色,反应缓慢 |
5 | 浓硝酸 | 反应物接触后迅速反应,反应剧烈,产生大量红棕色气体,溶 液变为深蓝色 | ||
依据上述实验,所得结论不正确的是
A. 实验1、2、3中反应速率不同,与溶液中阴离子种类有关
B. 可用稀硫酸溶解黄铜以测定铜的质量分数
C. 硝酸与黄铜反应的速率随硝酸浓度增大而加快
D. 黄铜在稀硫酸中有较强的抗腐蚀性能,说明其结构与简单Cu-Zn混合物不同
第二部分
非选择题(共58分)
15. 银及其化合物在制造钱币、电子工业、医药等方面具有广泛用途。
I. 银的冶炼及性质
(1)热分解法是金属冶炼方法之一。以Ag2O为原料冶炼银的化学方程式为__________。
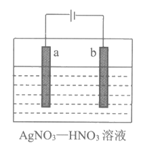
(2)电解精炼银的工作原理如图所示,__________(填“a”或“b”)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为________________。
II. 银的化合物的性质
(3)在AgCl沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程式_________________。
(4)在光照条件下,AgNO3可分解为Ag、O2和某种氮的氧化物。称取34 g AgNO3固体,充分光照使其完全分解,测得反应后生成O2的体积(折合成标准状况)为2.24L,反应过程中转移电子的物质的量为_______________。
(5)纳米硫化银(Ag2S)应用广泛。Ag2S溶于浓HNO3后,产生淡黄色固体及无色气体,该气体遇空气迅速变为红棕色。写出反应的化学方程式_________________。
16. M是有机合成的重要中间体,可用来合成广谱抗流感药物法匹拉韦(Favipiravir),其合成路线如下:
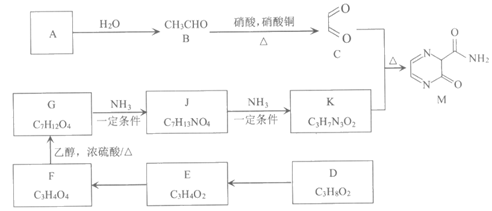
已知:i. J的核磁共振氢谱峰面积比为6:4:2:1。
ii. R1—CHO+ R2—NH2
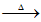 R1—CH=N—R2+H2O。
R1—CH=N—R2+H2O。
(1)A是含碳92.3%的烃,写出实验室制取A的化学方程式__________。
(2)检验E中官能团所用的试剂是_____________。
(3) B→C的反应类型是_________________。
(4)写出C+K→M的化学方程式_________________。
(5)下列说法正确的是_________________。
a. D比丙醇的沸点高
b. F与乙酸互为同系物
c. J可以发生水解反应生成氨基酸
d. K可以与盐酸反应生成相应的盐
(6)写出符合下列条件G的同分异构体的结构简式__________________________。
①可以发生银镜反应和水解反应
②核磁共振氢谱有三组峰
17. 镀镍废件是一种宝贵的可再生资源,可用于制备重要的化工原料NiSO4。将镀镍废件处理后得到废液(含大量的H+、SO42-、Ni2+以及少量的Zn2+、Cu2+、Fe2+、Fe3+等),采用如下工艺流程回收其中的镍制备NiSO4晶体。
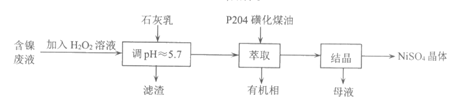
资料:
P204为磷酸二异辛酯(可用HA表示),不溶于水,是一种弱酸性萃取剂。其酸根离子(A–)可与某些金属离子发生反应。
(1)写出H2O2的电子式_____________。
(2)加入H2O2溶液发生反应的离子方程式为__________________。
(3)加石灰乳的作用是________________。
(4)在萃取过程中,若溶液酸度过高,会导致萃取效率变低,其原因是_________。
(5)在结晶过程中,需要加浓硫酸调pH至2~4,再进行__________,过滤出的固体洗涤、干燥,得NiSO4晶体。
温度/℃ | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
溶解度/g | 44.4 | 46.6 | 49.2 | 55.6 | 64.5 | 70.1 | 76.7 |
NiSO4在不同温度下的溶解度
(6) NiSO4在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式____________________。
18. 氯化亚铜(CuCl)是重要的化工原料,广泛用作有机合成催化剂。
资料
1. 水溶液中存在平衡:2Cl–
(aq)+CuCl(s)
 CuCl32-(aq)。
CuCl32-(aq)。
2. CuCl是难溶于水的白色固体,在热水中迅速水解生成Cu2O。
3. CuCl在潮湿的空气中易被氧化,生成的碱式盐为Cu2(OH)3 Cl。
I. 实验室中用纯净的CuCl2固体可制备CuCl。取75 g CuCl2固体于烧杯中,加入100 mL 0.2mol/L盐酸和水配成200 mL溶液,然后在溶液中通入SO2气体。
(1)结合化学用语解释加入盐酸的主要目的是_____________。
(2)溶液中通入SO2气体后,发生反应的离子方程式为_____________。
II. 工业中,用初级铜矿粉(主要含Cu2S及少量Fe2O3·FeO等)为原料制备CuCl。流程如下:
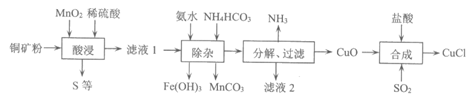
(3)“酸浸“中,加入稀H2SO4不宜过量太多的原因是__________。
(4)用化学用语解释,析出的CuCl晶体不能用水洗涤的原因是__________。
(5)合成过程中适宜的反应条件为____________。
(6)若要制99.5g CuCl,理论上至少需要含Cu2S 50%的铜矿粉的质量为_______g。
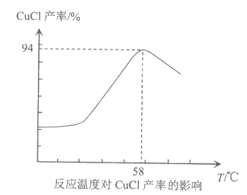
(7)相同时间内,反应物在最佳配比条件下,温度对CuCl产率影响如图所示。溶液温度控制在58℃时,CuCl产率最大,随温度升高CuCl产率降低,其原因是__________。(答出2条即可)
19. 研究发现,NO在心脑血管调节、免疫调节等方面有着十分重要的作用,但NO无法直接作为药物使用。科学家发现NO2–有着与NO相似的功效,可以用作药物。某研究小组对亚硝酸盐转化为NO的反应进行了研究。
(1)NO中N元素的化合价呈现正价,用原子结构解释原因为_____________。
(2)为研究NO2–的转化,甲同学完成了如下实验:
实验方案 | 实验现象 |
1 mol/L NaNO2溶液(pH=8) 2 mL1 mol/L FeSO4溶液 (调pH=3)
| i. 溶液先变黄色,迅速变为棕色 ii. 将棕色溶液加热,颜色变浅,冷却 |
资料:
FeSO4+NO  Fe(NO)SO4(棕色)
Fe(NO)SO4(棕色)
△H<0
在冷却后的溶液中滴加___________(填“试剂和现象“),说明有Fe3+生成。从而证明Fe2+可以还原NO2–。
(3)乙同学认为甲同学的实验方案不严谨,其理由是____________。并进一步利用下列实验装置进行实验,以验证甲同学的实验结论是正确的。
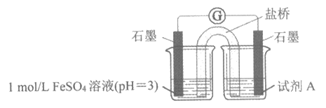
①右侧烧杯中试剂A是____________。
②实验证据是_____________。
(4)写出NaNO2溶液与FeSO4溶液反应的离子方程式_____________。
(5)解释“棕色溶液加热,颜色变浅“的原因是______________。
(6)研究表明,亚硝酸盐能够被人体内含Fe2+等的还原性酶还原为NO,NO的生物学作用揭示着无机分子在医学领域中的重要作用,它与血红素铁具有很高的亲合力,以取代O2的位置。因此,亚硝酸盐作为药物使用时,必须严格控制剂量。若服用过量,可能会产生的影响是___________________。
参考答案
说明:考生答案如与本答案不同,若答得合理,可酌情给分,但不得超过原题所规定的分数。
第一部分
选择题(共42分)
(本题共14小题,每小题3分,共42分)
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
B | A | B | C | D | C | A | D | C | D |
11 | 12 | 13 | 14 | ||||||
C | B | D | B |
第二部分
非选择题(共58分)
15. (10分)
(1) 2Ag2O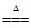 4Ag+O2↑(2分)
4Ag+O2↑(2分)
(2)a(1分)
NO3–+e–+2H+=NO2↑+H2O(2分)
(3) AgCl+Br–=AgBr+Cl–(2分)
(4) 0.4mol(1分)
(5)3Ag2S+8HNO3(浓)=6AgNO3+3S↓+ 2NO↑+ 4H2O(2分)
16. (12分)
(1) CaC2+2H2O→Ca(OH) 2+C2H2↑(2分)
(2)银氨溶液(或新制氢氧化铜悬浊液)(2分)
(3)氧化反应(2分)
(4)
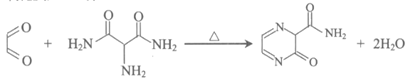 (2分)
(2分)
(5) acd(2分)
(6)
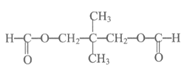 (2分)
(2分)
17. (12分)
(1)
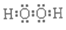 (2分)
(2分)
(2)2Fe2++2H++H2O2=2Fe3++2H2O(2分)
(3)调节pH除去Fe3+和Cu2+、使SO42-与Ca2+结合生成CaSO4沉淀被除去(2分)
(4)若酸度过高,c(H+)偏大,使平衡HA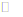 H++A–逆向移动,A–浓度减小,导致萃取效率变低(2分)
H++A–逆向移动,A–浓度减小,导致萃取效率变低(2分)
(5)蒸发浓缩、冷却结晶(2分)
(6) ClO–+2Ni2++4OH–=2NiOOH+Cl–+H2O(2分)
18. (12分)
(1)Cu2++2H2O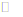 Cu(OH) 2+2H+,加酸抑制了Cu2+的水解(2分)
Cu(OH) 2+2H+,加酸抑制了Cu2+的水解(2分)
(2)SO2+2Cu2++2Cl–+2H2O=SO42-+2CuCl↓+4H+(2分)
(3)避免除杂步骤消耗更多的氨水和碳酸氢铵(1分)
(4)4CuCl+O2+ 4H2O=2Cu2
(OH)3Cl+2HCl(2分)
(5)温度不宜过高/控制HCl浓度不宜过高/隔绝空气(2分,答出任意两点即可)
(6) 160(1分)
(7)温度过高,CuCl水解生成Cu2O/CuCl被直接氧化/SO2逸出/HCl挥发(2分)
19. (12分)
(1)N元素和O元素处于同一周期,电子层数相同,最外层电子数N<O,原子半径N>O,得电子能力N<O,表现为非金属性N<O,所以在NO中N元素为正价(2分)
(2)滴加KSCN溶液,溶液变红(2分)
(3) Fe2+可能被空气中O2的氧化(1分)
①1 mol/L NaNO2溶液(pH=8)(1分)
②右侧烧杯中有微小气泡产生,遇空气变红棕色(1分)
(4)Fe2++NO2–+2H+=Fe3++NO↑+H2O(2分)
(5)FeSO4+NO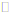 Fe(NO)SO4(棕色)△H<0,一是加热平衡逆向移动,二是温度升高NO溶解度降低,溶液中NO浓度减小,平衡逆向移动。Fe(NO)SO4分解溶液颜色变浅(2分)
Fe(NO)SO4(棕色)△H<0,一是加热平衡逆向移动,二是温度升高NO溶解度降低,溶液中NO浓度减小,平衡逆向移动。Fe(NO)SO4分解溶液颜色变浅(2分)
(6)造成人体缺氧(1分)