本试卷共39道小题,满分70分。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Cl 35.5
第一部分
选择题(共25分)
(每小题只有一个选项符合题意。每小题1分)
1. “铁强化酱油“中的“铁“是指
A. 单质 B. 原子 C. 分子 D. 元素
2. 下列物质中,属于纯净物的是
A. 蒸馏水 B. 空气 C. 大理石 D. 澄清石灰水
3. 生活中常见的下列物质,不属于溶液的是
A. 生理盐水 B. 蔗糖水 C. 泥水 D. 75%消毒酒精
4. 下列物质中,含有金属元素的是
A. H2SO4 B. CuO C. N2 D. P2O5
5. 下列不属于化石燃料的是
A. 天然气 B. 氢气 C. 煤 D. 石油
6. 下列物质在氧气中燃烧,火星四射,生成黑色固体的是
A. 木炭 B. 镁条 C. 红磷 D. 铁丝
7. 下列金属活动性最强的是
A. Mg B. Zn C. Cu D. Ag
8. 人体中缺少某种元素可能导致“佝偻病“,该元素是
A. 铁 B. 锌 C. 钙 D. 碘
9. 下列符号中,表示2个氢分子的是
A. H2 B. 2H C. 2H+ D. 2H2
10. 下列物质中,不能作氮肥的是
A. 尿素[CO(NH2) 2] B. 氨水[NH3·H2O]
C. 氯化钾[KCl] D. 硝酸铵[NH4NO3]
11. 2021年2月,嫦娥五号从月球带回的月壤样品向公众展出。月壤中存在着大量的3He,有望成为未来的清洁能源。3He原子内质子数为2,中子数为1,核外电子数为
A. 1 B. 2 C. 3 D. 4
12. 下图所示的化学实验基本操作中,正确的是
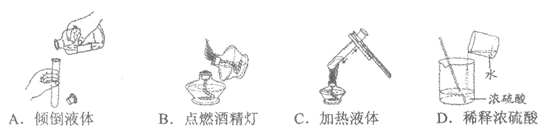
13. 用灯帽盖灭酒精灯,主要依据的灭火原理是
A. 隔绝空气 B. 降低酒精的着火点
C. 移走可燃物 D. 降低温度到酒精的着火点以下
14. 盛有下列物质的容器敞口放置,容器内物质的质量减少的是
A. 浓盐酸 B. 浓硫酸
C. 氢氧化钠固体 D. 氯化钠固体
15. 电解水实验如图。下列说法不正确的是
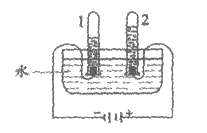
A. 可用带火星的木条检验生成的O2
B. 试管2中得到O2
C. 产生H2与O2的体积比约为2:1
D. 该实验说明水由H2和O2组成
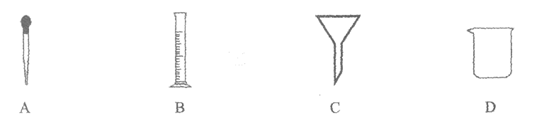
16. 配制一定溶质质量分数的氯化钠溶液,不需要用到的仪器是
17. 用如图装置制取氧气,下列说法不正确的是
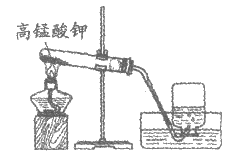
A. 实验前应先检查装置的气密性
B. 当有气泡冒出时,立刻开始收集氧气
C. 氧气能用排水法收集的原因是其不易溶于水
D. 试管中发生反应的化学方程式为2KMnO4
 K2MnO4+ MnO2+O2↑
K2MnO4+ MnO2+O2↑
18. 下列物质的化学式中,书写正确的是
A. 氯化铁FeCl3 B. 碳酸钾KCO3
C. 氧化镁MgO2 D. 氯化锌ZnCl
19. 下列物质的用途中,利用物理性质的是
A. 氧气用于气焊 B. 干冰用于人工降雨
C. 氮气用作保护气 D. 铁矿石用于炼铁
20. 下列做法不符合低碳行动的是
A. 开发清洁能源 B. 将废弃塑料就地焚烧
C. 乘坐公共交通工具 D. 植树造林
21. 醋硝香豆素(化学式为C19H15NO6),用于预防和治疗血栓疾病。下列关于醋硝香豆素的说法不正确的是
A. 属于有机化合物 B. 每个分子由41个原子构成
C. 由四种元素组成 D. 氢元素的质量分数最小
依据下列20℃时的实验,回答22-23题。
已知:20℃和40℃时NH4Cl固体的溶解度分别为37.2 g和45.8g。
| 序号 | ① | ② | ③ |
加入NH4Cl的质量/g | 20 | 35 | 40 | |
水的质量/g | 100 | 100 | 100 |
22. ①~③所得溶液属于饱和溶液的是
A. ① B. ② C. ③ D. ②③
23. 下列关于①~③所得溶液说法不正确的是
A. 溶液质量:①<② B. ①中溶质与溶剂的质量比为1:5
C. ②中溶质的质量分数为35% D. 将③升温到40℃,溶质的质量分数增大
24. 二氧化碳和氢气在一定条件下可发生反应制取甲烷,该反应的微观示意图如下。下列说法中不正确的是
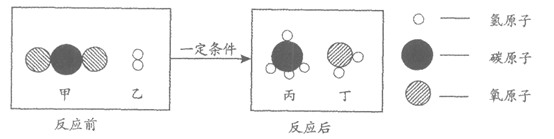
A. 丁为氧化物 B. 丙的化学式为CH4
C. 甲中碳、氧元素质量比为3:8 D. 生成丙与丁的分子个数比为1:1
25. 下列依据实验目的所设计的操作中,不正确的是
选项 | 实验目的 | 实验操作 |
A | 鉴别氧气和空气 | 伸入带火星的木条 |
B | 除去CO中的CO2 | 通入足量NaOH溶液 |
C | 鉴别水和双氧水 | 加入少量MnO2 |
D | 检验某固体中是否含有碳酸盐 | 加入足量稀盐酸 |
第二部分
非选择题(共45分)
【生活现象解释】
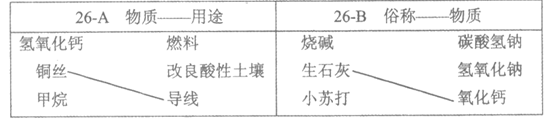
26. (1分)补齐连线。从26-A或26-B中任选一个作答,若均作答,按26-A计分。
27. (2分)2021年世园会于扬州举行,主题为“绿色城市,健康生活“。
(1)世园会有来自世界各大洲的特色花卉。从微观角度解释闻到花香的原因_________。
(2)冶春园内还设有淮扬菜展示区,最具代表性的有狮子头,其原料有猪肉、虾仁、莲藕、青菜心等,原料中富含蛋白质的是_____________。
28. (2分)如图是某种利用太阳能淡化海水的器件示意图。
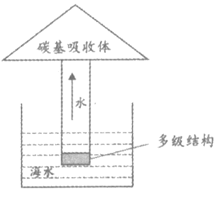
(1)水被吸入碳基吸收体,在其表面蒸发,这一过程属于_________ 变化(填“物理“或“化学“)。
(2)利用该装置将一定量海水淡化一段时间后,剩余海水中氯化钠的质量分数_________(填“变大“”变小“或“不变“)。
【科普阅读理解】
29. (5分)阅读下面科普短文。
2021年3月,三星堆遗址新出土重要文物500多件,有高2.62米的青铜大立人(图1)、高3.95米的青铜神树、由金箔包裹的权杖、重约286克的金面具及玉石器和象牙等,多属前所未见的稀世之珍。

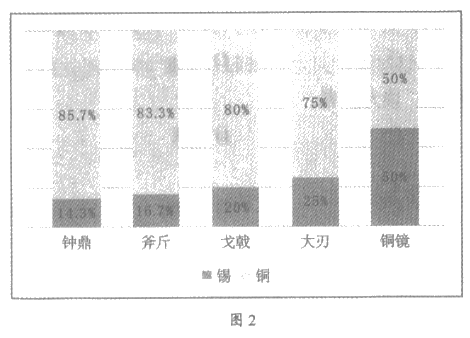
青铜是金属冶铸史上最早出现的合金,与纯铜相比,其强度高、熔点低、铸造性好、耐磨且耐腐蚀。《周礼·考工记》中对制作钟鼎、斧斤、戈戟等青铜器物中铜锡的比例作了详细的规定(图2)。在地下埋藏的青铜器表面会出现绿色的铜锈,其主要成分为碱式碳酸铜[Cu2(OH)2CO3]。
金属的冶炼和使用在不断发展,人们在冶炼青铜的基础上逐渐掌握了冶炼铁的技术。中国目前发现的最古老铁器是甘肃省出土的两块铁条,经碳14检测,其冶炼年代约在3510~3310年前,两块铁条锈蚀严重。
随着科学技术的发展,铝、钛等金属逐渐被冶炼并使用,但金属矿物的储量是有限的。据不完全统计,世界上每年因腐蚀而报废的金属设备和材料相当于年产量的20%~40%。金属资源的合理利用与保护十分重要。
依据文章内容回答下列问题。
(1)下列属于金属材料的是_________(填字母序号)
A. 青铜大立人 B. 金面具 C. 象牙 D. 玉石器
(2)青铜与纯铜相比,提升了哪些性能_____________(答一条即可)。
(3)依据铜锈的主要成分Cu2(OH)2CO3,可推断铜生锈的过程是铜与空气中的CO2、O2和_____________等发生化学反应的过程。
(4)依据图2可知,用于生产戈戟的青铜器中,铜和锡的比例为_____________。
(5)下列说法正确的是_____________(填字母序号)。
A. 青铜器中铜锡比例不同,所得合金的性能也不同
B. 人类大规模使用金属的先后顺序与金属活动性有关
C. 金属资源是取之不尽的
D. 将废旧金属回收利用可节约金属资源
【生产实际分析】
30. (3分)利用工业废碱渣(主要成分为Na2CO3)可吸收烟气中的SO2,同时生产Na2SO3。

(1) SO2中S元素的化合价为_____________。
(2)补全过程I中发生主要反应的化学方程式:
Na2CO3+ 2SO2+ H2O===2NaHSO3+_____________
(3)溶液X中一定含有的溶质是_____________。
31. (4分)工业制造高纯度氧化钙(CaO)的流程如下:
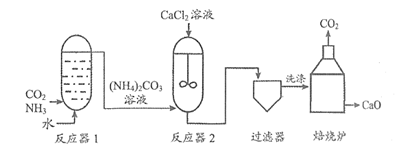
(1)反应器1中先加入一定量水。气体从底部缓慢通入的原因是_________。
(2)反应器2中发生复分解反应的化学方程式为_________。
(3)过滤器中分离出的固体是_________。
(4)上述流程中可循环利用的物质是_________。
【基本实验及其原理分析】
32. (2分)用图1所示装置研究氧气的性质,数据如图2所示。
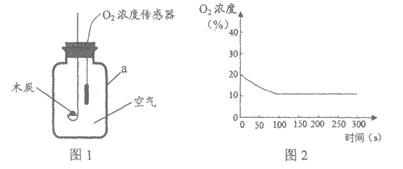
(1)仪器a的名称是_________。
(2)结合图2分析,能证明木炭燃烧时氧气参与反应的现象是_________。
33. (3分)“去除粗盐中难溶性杂质“的实验操作如下图所示。
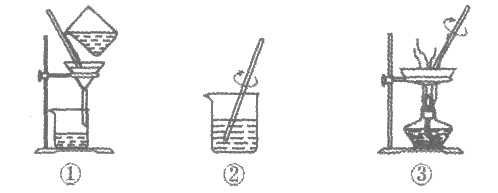
(1)正确的操作顺序是_________(填序号)。
(2)过滤后,滤液仍然浑浊的原因可能是_________(写一条即可)。
(3)下列生活实例中,运用过滤原理的是_________(填字母序号)。
A. 用热水沏茶 B. 用笊(zhào)篱捞饺子 C. 撒网捕鱼
34. (3分)用如图实验比较铁、铜的金属活动性强弱。
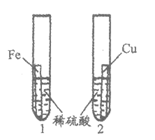
(1)试管1中发生反应的化学方程式为_________。
(2)该实验能够得到的结论是_________。
(3)将试管1中的稀硫酸替换为硫酸铜溶液也可达到实验目的,依据的现象是___________________。
35. (3分)用右图装置验证燃烧的条件。
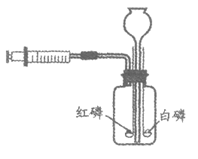
①由长颈漏斗加入80℃的热水至没过燃烧匙上的红磷和白磷。
②一段时间后,推动注射器活塞,使白磷和红磷露出水面。
已知:红磷的着火点为240℃,白磷的着火点为40℃。
(1)白磷燃烧的化学方程式为_____________。
(2)②中红磷露出水面后不燃烧的原因是_____________。
(3)能验证可燃物燃烧需要O2的现象是_________。
36. (3分)在白色点滴板盛有试剂的孔穴中,分别滴加稀盐酸。
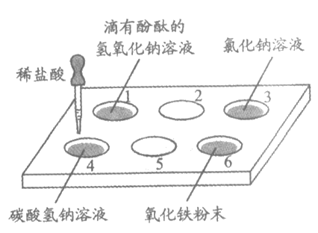
(1)冒出气泡的孔穴有_____________(填孔穴序号)。
(2)能证明孔穴1中盐酸和氢氧化钠发生反应的现象是_________。
(3)孔穴6中发生反应的化学方程式是_________。
37. (4分)利用下图装置进行实验。
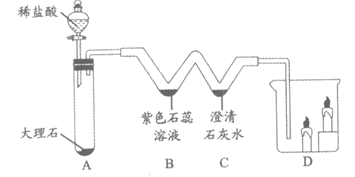
(1)A中发生反应的化学方程式为_________。
(2)B处观察到的现象是_________。
(3)C处溶液变浑浊,发生反应的化学方程式为_________。
(4)D中蜡烛由下至上依次熄灭,可以验证CO2的性质是_________。
【科学探究】
38. (7分)俗话说“碱去油污、酸除锈“,纯碱(Na2CO3)能做日常生活中的去油污剂。
I. 探究温度和浓度对Na2CO3溶液去油污效果的影响
【进行实验】室温下,取8个大小相同涂有0.5g植物油的玻璃片,分别浸泡在100g试剂中15分钟,取出干燥后观察实验现象。实验结果如下:
第1组 | 第2组 | 第3组 | ||||||
实验编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
温度 | 20℃ | 20℃ | 20℃ | 20℃ | 30℃ | 30℃ | 40℃ | 40℃ |
试剂 | 水 | 1% Na2CO3溶液 | 5% NaCO3溶液 | 10% Na2CO3溶液 | 水 | 10% Na2CO3溶液 | 水 | 10% Na2CO3溶液 |
去油污效果 | 5% | 16% | 20% | 27% | 60% | 90% | 75% | 97% |
已知:去油污效果=去除油脂质量/初始油脂质量
【解释与结论】
(1)配制100g 10% Na2CO3溶液,需要称量Na2CO3固体_________g。
(2)设计实验①的目的是_________。
(3)欲探究“浓度对Na2CO3溶液去油污效果的影响“需对比的实验是_________(填实验编号)。
(4)对比实验④⑥⑧可得到的结论是_________。
II. 探究温度和浓度对Na2CO3溶液碱性的影响
【查阅资料】相同温度下,溶液的pH越大,碱性越强。
【进行实验】
实验⑨:20℃时,用pH传感器测定不同浓度Na2CO3溶液的pH(结果如图1)。
实验⑩:用pH传感器和温度传感器测定不同温度下10% Na2CO3溶液的pH(结果如图2)。
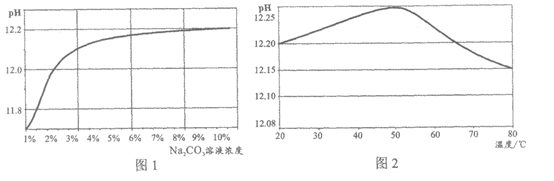
【解释与结论】
(5)结合第1组实验和图1数据分析,欲得出“溶液的碱性越强,Na2CO3溶液去油污效果越好“的依据是_________。
(6)由图2可知,10% Na2CO3溶液的pH与温度的关系是_________。
【反思与评价】
【查阅资料】相同浓度下,Na2CO3溶液的温度越高,碱性越强
(7)综合以上实验分析,下列说法正确的是_________(填字母序号)。
A. 热Na2CO3溶液去油污效果更好可能与“温度升高,水的去油污能力增强“有关
B. 热Na2CO3溶液去油污效果更好可能与“温度升高,溶液碱性增强“有关
C. 10% Na2CO3溶液在不同温度时,pH可能相同
D. 溶液碱性增强,pH一定增大
【生产实际定量分析】
39. (3分)氧烛(主要成分为NaClO3)是一种用于缺氧环境中自救的化学氧源,广泛用于航空、航海等领域。其产生氧气的主要反应原理为2NaClO3
 2NaCl+3O2↑,计算213g NaClO3完全分解时产生氧气的质量。
2NaCl+3O2↑,计算213g NaClO3完全分解时产生氧气的质量。
参考答案
第一部分
选择题
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
答案 | D | A | C | B | B | D | A | C | D | C | B | C | A |
题号 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
答案 | A | D | C | B | A | B | B | D | C | C | D | D |
第二部分
非选择题
26、

27、(1)分子不断运动 (2)猪肉、虾仁
28、(1)物理 (2)变大
29、(1) AB
(2)强度高、熔点低、铸造性好、耐磨、耐腐蚀(答一条即可)
(3) H2O (4)4:1 (5)ABD
30、(1)+4 (2) CO2 (3) Na2SO3
31、(1)使反应物充分接触,充分反应
(2) CaCl2+ (NH4) 2CO3===2NH4Cl+ CaCO3↓
(3) CaCO3 (4) CO2
32、(1)集气瓶 (2)氧气浓度下降
33、(1)②①③ (2)滤纸破损或漏斗内液面高于滤纸边缘等 (3) BC
34、 (1) Fe+H2SO4=== FeSO4+H2↑ (2)铁的金属活动性比铜强
(3)铁表面有红色固体析出,溶液由蓝色逐渐变浅绿
35、(1) 4P+5O2
 2P2O5 (2)温度未到达红磷的着火点
2P2O5 (2)温度未到达红磷的着火点
(3)①中白磷不燃烧,②中白磷燃烧
36、(1)4 (2)溶液由红色变为无色
(3) 6HCl+Fe2O3===2FeCl3+ 3H2O
37、(1) 2HCl+CaCO3===CaCl2+CO2↑+ H2O (2)紫色溶液变红
(3) CO2+ Ca(OH) 2=== CaCO3↓+H2O
(4)不可燃,不助燃
38、(1) 10g (2) 20℃时,排除水对本实验的影响 (3)②③④
(4)相同浓度时,温度越高,Na2CO3溶液去油污效果越好
(5)相同温度时,浓度越大,Na2CO3溶液的pH越大,碱性越强,去油污效果越好
(6)在20℃至80℃范围内,随温度升高,10%Na2CO3溶液的pH先升高后减小
(7) ABC
39、【解】设:产生氧气的质量为x。
2NaClO3
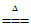 2NaCl+3O2↑
2NaCl+3O2↑
213 96
213g x
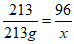
x=96g
答:产生氧气的质量为96g。