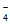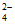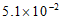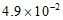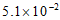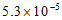本试卷共100分。考试时长90分钟。
可能用到的相对原子质量:H 1 O 16 Na 23 Ca 40 Cu 64
第一部分
本部分共14题,每题3分,共42分。在每题列出的4个选项中,选出最符合题目要求的一项。
1. 下列三星堆出土的文物属于合金制品的是
|
|
|
|
A. 青铜人面具 | B. 椭圆形玉器 | C. 陶三足炊器 | D. 带孔海贝壳 |
2. 下列化学用语表达正确的是
A. 乙烯的实验式:C2H4
B. 电镀铜时,铁制镀件上的电极反应式:Fe-2e-=Fe2+
C. NH4Cl在水中的电离方程式:NH4Cl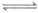 NH
NH +Cl-
+Cl-
D. 用电子式表示NaCl的形成过程: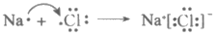
3. 配制100 mL 1.00mol·L-1NaOH溶液的操作如下所示。下列说法不正确的是
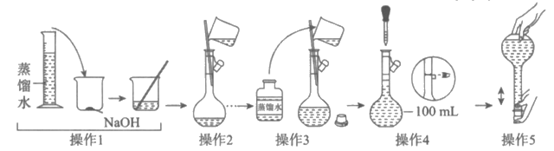
A. 操作1前称取NaOH的质量为4.0g
B. 操作2前NaOH溶液需恢复至室温
C. 操作3和操作4分别为洗涤和定容
D. 操作5后液面下降,需补充少量水至刻度线
4. 化学与生活密切相关,下列说法正确的是
A. 脂肪属于天然高分子,可用于生产肥皂
B. 聚丙烯酸钠具有吸水保湿性,可用于干旱地区植树造林
C. 纤维素在人体内水解最终产物为葡萄糖. 可作为人类的营养食物
D. 聚氯乙烯是一种热稳定性塑料,可用于制作食品包装袋等薄膜制品
5. 下列气体的验证方法没有涉及氧化还原反应的是
A. 氧气——带火星的小木条复燃
B. 氯气——湿润的有色纸条褪色
C. 乙烯——酸性高锰酸钾溶液褪色
D. 氨气——湿润的红色石蕊试纸变蓝
6. 根据元素周期律,下列说法正确的是
A. 原子半径:K>Mg>Na
B. 碱性:NaOH>Mg(OH)2>Ca(OH)2
C. 酸性:HCl>H2S,表明Cl的非金属性强于S
D. 热稳定性:CH4>SiH4,表明C的非金属性强于Si
7. 下列方程式与所给事实不相符的是
A. 汽车尾气的催化转化:2CO+2NO 2CO2+N2
2CO2+N2
B. 用明矾净水:Al3++3H2O Al(OH)3(胶体)+3H+
Al(OH)3(胶体)+3H+
C. 用硫制硫酸:2S+3O2 2SO3;SO3+H2O=H2SO4
2SO3;SO3+H2O=H2SO4
D. 乙酸与乙醇的酯化反应:CH3COOH+C2H518OH CH3CO18OC2H5+H2O
CH3CO18OC2H5+H2O
8. 将SO2分别通入下列四种溶液,根据实验现象所得结论正确的是
选项 | 溶液 | 现象 | 结论 |
A | 溴水 | 溴水褪色 | SO2有漂白性 |
B | H2S溶液 | 出现淡黄色浑浊 | SO2具有氧化性 |
C | BaCl2溶液 | 无明显变化 | BaSO3能溶于水 |
D | H2O2溶液 | 无明显变化 | SO2和H2O2溶液不反应 |
9. 实验室模拟工业回收碘水中的碘,其操作流程如下:
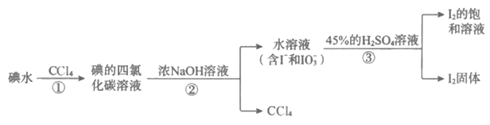
下列判断正确的是
A. I2在CCl4中的溶解度小于在H2O中的
B. ②、③中涉及的分离操作分别为分液和过滤
C. ②中1mol I2与足量NaOH完全反应转移了6 mol e—
D. ②中反应消耗的NaOH和③中反应消耗的H2SO4的物质的量之比为1:1
10. BAS是一种可定向运动的“分子机器“,其合成路线如下:
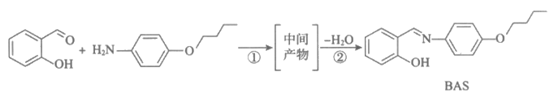
下列说法正确的是
A. 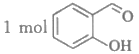 最多可与3mol H2发生加成反应
最多可与3mol H2发生加成反应
B. 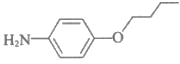 既有酸性又有碱性
既有酸性又有碱性
C. 中间产物的结构简式为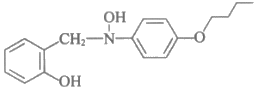
D. ①为加成反应,②为消去反应
11. 反应M(g)+N(g)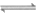 P(g)+Q(g)在不同温度(T)时的平衡常数(K)如下:
P(g)+Q(g)在不同温度(T)时的平衡常数(K)如下:
T/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
密闭容器中,某温度(T)、某时刻(t)时,反应混合物中M、N、P、Q的浓度分别为1mol·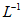 、1mol·
、1mol·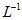 、1.5mol·
、1.5mol·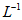 、1.5mol·
、1.5mol·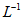 。
。
下列说法正确的是
A. 该反应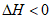
B. 若T=700℃,则t时刻反应向正反应方向进行
C. 若t时刻反应达到化学平衡,则1000℃<T<1200℃
D. 当T=830℃达到化学平衡时,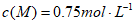
12. 25℃时,0.10mol·L-1草酸(H2C2O4)溶液中各微粒的物质的量浓度如下:
微粒 | H+ | H2C2O4 | HC2O | C2O |
c/(mol·L-1) |
|
|
|
|
下列关系不能说明草酸的第二步电离比第一步电离更难的是
A. c(H2C2O4)大于c(C2O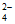 )
)
B. c(HC2O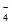 )大于c(C2O
)大于c(C2O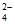 )
)
C. c(H+)远远大于c(C2O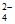 )
)
D. c(H+)约等于c(HC2O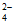 )
)
13. 酸性条件下,环氧乙烷水合法制备乙二醇涉及的机理如下:
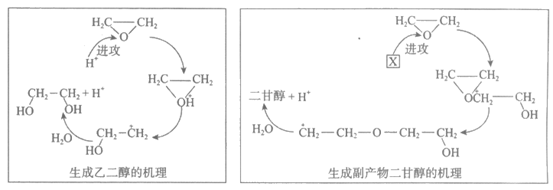
下列说法不正确的是
A. 制备乙二醇的总反应为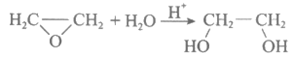
B. H+进攻环氧乙烷中的氧源子是因为碳氧键的共用电子对偏向氧
C. X的结构简式为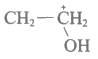
D. 二甘醇的分子式是C4H10O3
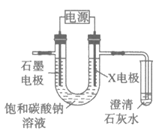
14. 用下图所示装置电解饱和碳酸钠溶液,实验如下:
设置 | X电极材料 | 现象 |
| 石墨 | 两极均有气泡产生; 5min后澄清石灰水变浑浊 |
铂(Pt) | 两极均有气泡产生; 30 min内澄清石灰水一直未见浑浊 |
下列判断不正确的是
A. X电极为阳极
B. 左侧电极附近溶液c(OH-)增大
C. X为石墨时,石灰水变浑浊的主要原因是阳极产生的H+和CO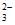 反应生成了CO2
反应生成了CO2
D. 电解过程中,溶液里一直存在c(Na+)+c(H+)=2c(CO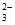 )+c(HCO
)+c(HCO )+c(OH-)
)+c(OH-)
第二部分
本部分共5题,共58分。
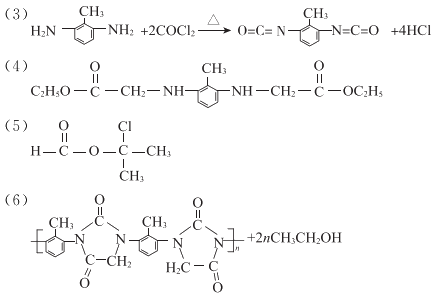
15. (11分)聚合物G具有良好的耐高温性能,其合成路线如下:
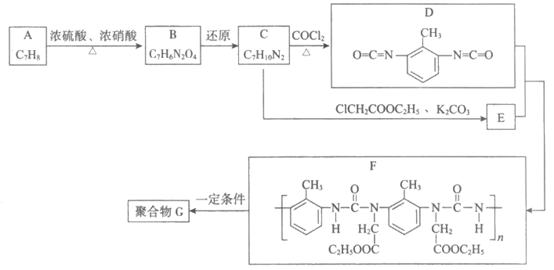
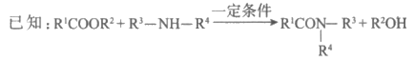
(1)A的名称是______________。
(2)A→B的反应类型是______________。
(3)C→D的化学方程式是______________。
(4)D+E→F的过程中没有小分子生成。E的结构简式为______________。
(5)M是ClCH2COOC2H5的同分异构体,符合下列条件的M的结构简式是______________。
a. 与ClCH2COOC2H5具有相同的官能团
b. 能发生银镜反应
c. 核磁共振氢谱有2组峰
(6)G中每个链节含有两个五元环,补全F→G的化学方程式:
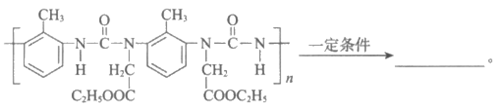
16. (12分)过氧化钙(CaO2)在水中能缓慢放出氧气,是一种用途广泛的供氧剂,可用于鱼塘养殖。
(1)CaO2中所含化学键的类型是______________、______________。
(2)CaO2与水反应的化学方程式是______________。
(3)由电石渣(主要成分为氢氧化钙)制备过氧化钙可实现工业废渣的资源化,其制备流程如下:
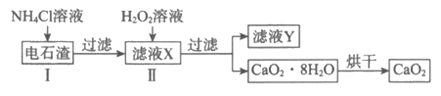
①滤液Y可循环使用,其主要溶质的质量与反应前的加入量几乎没有变化,该溶质是______________。解释其质量不变的原因:______________(用化学方程式表示)。
②Ⅰ和Ⅱ的反应装置均需置于冰水浴中,解释Ⅱ中冰水浴的作用:______________(答出一点即可)。
(4)CaO2样品纯度测定
i. 按下图连接装置(夹持和加热装置均略去),从水准管口加入适量水,并检查气密性;
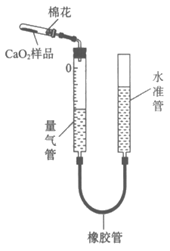
ii. 准确称量m g CaO2样品加入试管,并使其在试管底部均匀铺成薄层;
iii. 上下移动水准管,使水准管中液面与量气管中液面平齐;读取量气管中液面对应的刻度,记为V1 mL(V1≥0);
iv. 加热发生反应:2CaO2
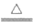 2CaO+O2↑。充分反应至不再有气体产生,停止加热,______________;再次读取量气管中液面对应的刻度,记为V2 mL;
2CaO+O2↑。充分反应至不再有气体产生,停止加热,______________;再次读取量气管中液面对应的刻度,记为V2 mL;
v. 计算样品中CaO2的纯度。
①补全iv中操作:______________。
②该实验条件下,气体摩尔体积为24.5L·mol-1,样品中CaO2的纯度为______________(用质量分数表示)。
17. (11分)以CO2为原料合成甲醇可以减少CO2的排放,实现碳的循环利用。一种Cu/ZnO催化剂对该反应有良好的催化效果。
Ⅰ. 催化剂的合成
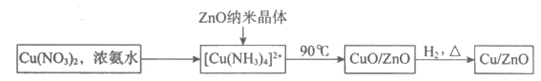
(1)氨水与Cu(NO3)2的反应______________(填“属于“或“不属于“)氧化还原反应。
(2)补全上述过程中生成CuO的离子方程式:

Ⅱ. 催化剂的性能测试
一定条件下使CO2、H2混合气体通过反应器,检测反应器出口气体的成分及其含量,计算CO2的转化率和CH3OH的选择性以评价催化剂的性能。
已知:i. 反应器内发生的反应有:
a. CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)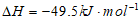
b. CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)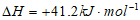
ii. CH3OH选择性=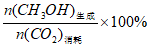
(3)220℃时,测得反应器出口气体中全部含碳物质的物质的量之比n(CH3OH):n(CO2):n(CO)=1:7.20:0.11。则该温度下CO2转化率=______________×100%(列出计算式)。
(4)其他条件相同时,反应温度对CO2的转化率和CH3OH的选择性的影响如下图所示:
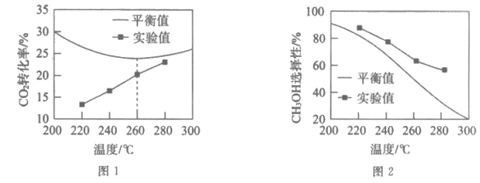
①由图1可知实验中反应均未达到化学平衡状态的依据是_______________________。
②温度高于260℃时,CO2平衡转化率变化的原因是____________________________。
③温度相同时,CH3OH选择性的实验值略高于平衡值(见图2),从化学反应速率的角度解释原因:____________________________。
18. (12分)碳酸锶(SrCO3)为白色、难溶于水的固体,在电子工业中有广泛应用。一种由天青石精矿(含SrSO4)制备高纯SrCO3的方法如下:
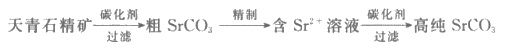
已知:
i. BaSO4、SrCO3、BaCO3和SrSO4均难溶于水,在相同温度下的溶解度(S)关系如下:
S(BaSO4)≈S(SrCO3)<S(BaCO3)<S(SrSO4)
ii. 几种氢氧化物在不同温度下的溶解度:
氢氧 化物 | 20 | 40 | 60 | 80 | 90 | 100 |
Sr(OH)2 | 1.77 | 3.95 | 8.42 | 20.2 | 44.5 | 91.2 |
Ba(OH)2 | 3.89 | 8.22 | 20.94 | 101.4 | - | - |
Ca(OH)2 | 0.173 | 0.141 | 0.121 | 0.094 | 0.086 | 0.076 |
(1)粗SrCO3的制取
①碳化剂一般选择Na2CO3溶液或(NH4)2CO3溶液。写出SrSO4转化为SrCO3的离子方程式:______________。
②实验发现,当温度和碳化剂的物质的量浓度均相同时,SrSO4在Na2CO3溶液中的转化速率大于在(NH4)2CO3溶液中的。从盐类水解的角度解释其原因是____________________________。
(2)含Sr2+溶液的精制
i. 将粗SrCO3溶解于适量盐酸中,过滤得到滤液(金属阳离子有:Sr2+、Ba2+、Mg2+和Ca2+);
ii. 加NaOH溶液调节上述滤液pH至12~13,过滤得到滤液X和滤渣A;
iii. 将滤液X置于90~95℃的水浴中加热,生成白色沉淀B,趁热过滤弃去沉淀,得到滤液Y,并将ii中的滤渣A重新投入滤液Y中浸泡(保持温度为90~95℃);
iv. 重复ii和iii3~4次,最后得到热的滤液Z;
v. 趁热向滤液Z中加入适量稀硫酸,过滤得到精制含Sr2+溶液。
①滤渣A中含有Sr(OH)2和______________。
②白色沉淀B的主要成分是______________。
③iv的目的是______________。
①v中反应的离子方程式是______________。
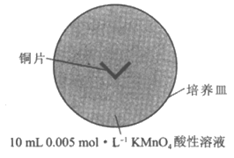
19. (12分)某化学兴趣小组为探究高锰酸钾与铜的反应,设计实验如下:
实验一 | 现象 |
| 一段时间后,培养皿中由铜片向外侧依次呈现: A区澄清且几乎无色; B区底部覆盖棕黑色固体; C区澄清且紫色变浅 |
资料:a. Cu+在酸性溶液中不能稳定存在:2Cu+=Cu+Cu2+
b. MnS为粉红色沉淀、溶于强酸;CuS为黑色沉淀、不溶于强酸
(1)Cu被氧化成______________,依据是____________________________。
(2)为探究MnO 的还原产物,取A区中溶液______________(填操作和现象),证明有Mn2+生成。
的还原产物,取A区中溶液______________(填操作和现象),证明有Mn2+生成。
(3)A区中KMnO4与Cu反应的离子方程式是______________。
(4)经检验,B区的棕黑色固体是MnO2。从溶液中离子扩散的角度,结合离子方程式解释B区和C区中的现象:____________________________。
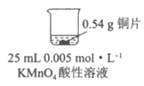
(5)小组同学又进行了以下定量实验:
实验二 | 现象 |
| 一段时间后,铜片质量减少了0.02g,溶液中无固体析出、溶液紫色变浅 |
通过计算,分析溶液紫色变浅而未完全褪色的原因:____________________________。
【试题答案】
注:学生答案与本答案不符时,合理答案给分。
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
答案 | A | D | D | B | D | D | C |
题号 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
答案 | B | B | D | C | A | C | C |
15. (11分)
(1)甲苯
(2)取代反应
16. (12分)
(1)离子键、(非极性)共价键
(2)2CaO2+2H2O=2Ca(OH)2+O2↑
(3)①NH4Cl
Ca(OH)2+2NH4Cl=CaCl2+2NH3·H2O
CaCl2+H2O2+2NH3·H2O+6H2O=CaO2·8H2O↓+2NH4Cl
②减少NH3·H2O和H2O2分解损失,利于CaO2·8H2O析出
(4)①待整个装置恢复至室温,上下移动水准管使其中液面与量气管中液面平齐
②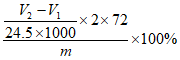 或
或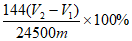
17. (11分)
(1)不属于

(3)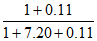
(4)①CO2的实验转化率未达到平衡转化率
②温度升高,反应a逆向移动,反应b正向移动;温度高于260℃时,反应b正向移动的程度大于反应a逆向移动的程度
③在该条件下反应a的速率大于反应b的,单位时间内生成甲醇的量比生成CO的量更多
18. (12分)
(1)①SrSO4(s)+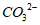 (aq)
(aq)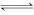 SrCO3(s)+
SrCO3(s)+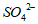 (aq)
(aq)
②Na2CO3溶液中存在CO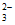 的水解,而(NH4)2CO3溶液中NH
的水解,而(NH4)2CO3溶液中NH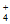 和CO
和CO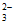 的水解相互促进,导致温度和浓度均相同时,前者CO
的水解相互促进,导致温度和浓度均相同时,前者CO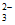 的浓度大于后者
的浓度大于后者
(2)①Mg(OH)2和Ca(OH)2
②Ca(OH)2
③滤渣A成分中Sr(OH)2在90℃时易溶于水,产生的OH-可以结合滤液中的Ca2+生成Ca(OH)2沉淀,提高Ca2+的去除率,同时减少Sr2+的损失
④Ba2++SO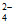 =BaSO4↓,H++OH-=H2O
=BaSO4↓,H++OH-=H2O
19.(12分)
(1)Cu2+
Cu被氧化可能生成Cu+或Cu2+,根据资料a,Cu+在酸性溶液中不能稳定存在,所以其氧化产物为Cu2+
(2)通入足量H2S后,取上层清液,加入足量的Na2S溶液,观察到粉红色沉淀
(3)5Cu+2MnO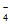 +16H+=5Cu2++2Mn2++8H2O
+16H+=5Cu2++2Mn2++8H2O
(4)A区生成的Mn2+向外扩散,C区的MnO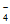 向内扩散,二者在B区相遇发生反应:2MnO
向内扩散,二者在B区相遇发生反应:2MnO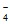 +3Mn2++2H2O=5MnO2↓+4H+;C区c(MnO
+3Mn2++2H2O=5MnO2↓+4H+;C区c(MnO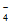 )减小,溶液颜色变浅
)减小,溶液颜色变浅
(5)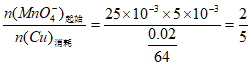
理论上,0.02g Cu能与实验二中MnO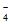 恰好完全反应,但溶液紫色并未完全消失,说明MnO
恰好完全反应,但溶液紫色并未完全消失,说明MnO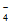 有剩余,所以有其他氧化剂参与反应,如空气中的O2
有剩余,所以有其他氧化剂参与反应,如空气中的O2