本试卷共两部分,40道小题,满分70分。考试时间70分钟。
可能用到的相对原子质量:H 1 O 16 Ca 40
第一部分
选择题(共25分)
每小题只有1个选项符合题意。每小题1分,共25分。
1. 空气中体积分数最大的气体是
A. 氧气 B. 二氧化碳 C. 氮气 D. 稀有气体
2. 下列物质中,属于纯净物的是
A. 雨水 B. 空气 C. 石油 D. 氧气
3. 地壳中含量最多的元素是
A. Fe B. Al C. O D. Si
4. 为了预防佝偻病,青少年需要摄入的元素是
A. 锌 B. 钙 C. 铁 D. 钠
5. 下列不属于溶液的是
A. 蒸馏水 B. 食盐水 C. 石灰水 D. 蔗糖水
6. 被称为抗癌食品的芦笋中含有丰富的硒,这里的“硒“指的是
A. 单质 B. 原子 C. 离子 D. 元素
7. 下列能表示2个氧分子的是
A. O2 B. 2O2 C. 2O D. 2O3
8. 下列物质中,属于有机化合物的是
A. CH3CH2OH B. CO C. CO2 D. CaCO3
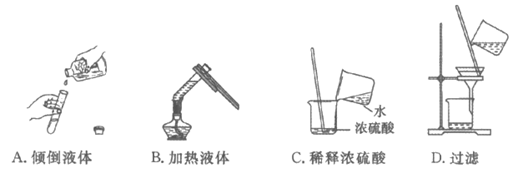
9. 下列实验操作正确的是
10. 氧化铝(Al2O3)可作耐火材料,其中Al的化合价是
A. +7 B. +5 C. +3 D. +1
11. 下列不属于可回收垃圾的是
A. 果皮 B. 旧书本 C. 易拉罐 D. 塑料饮料瓶
12. 铝能被加工成铝箔,说明铝具有良好的
A. 导热性 B. 导电性 C. 延展性 D. 抗腐蚀性
13. 下列物质的名称与化学式对应正确的是
A. 硫酸钙CaSO4 B. 氯化锌ZnCl
C. 碳酸钾KCO3 D. 氢氧化铜CuOH
14. 小苏打在加热时反应:2NaHCO3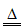 Na2CO3+H2O+CO2↑,该反应属于
Na2CO3+H2O+CO2↑,该反应属于
A. 化合反应 B. 分解反应 C. 置换反应 D. 复分解反应
15. 鉴别硬水和软水的试剂是
A. 肥皂水 B. 食盐水 C. 苏打水 D. 蒸馏水
16. 下列化学方程式正确的是
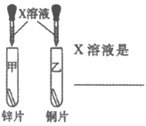
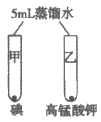
A. CO2+NaOH=Na2CO3+H2O B. Mg+H2SO4=MgSO4+H2O
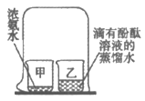
C. 4Fe+3O2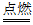 2Fe2O3 D. 3CO+Fe2O3
2Fe2O3 D. 3CO+Fe2O3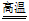 2Fe+3CO2
2Fe+3CO2
17. 下列关于2H2+O2 2H2O的说法不正确的是
2H2O的说法不正确的是
A. 该反应的生成物是水 B. 反应前后氢原子、氧原子的个数均不变
C. 反应在点燃的条件下进行 D. 参加反应的氢气与氧气的质量比为2:1
18. 下列不属于二氧化碳(或干冰)用途的是
A. 用作气体肥料 B. 用作燃料
C. 生产碳酸饮料 D. 用于人工降雨
19. 氮在元素周期表中的信息如图所示。下列有关氮元素的说法中,不正确的是
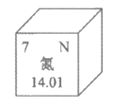
A. 原子序数是7 B. 元素符号为N
C. 属于金属元素 D. 相对原子质量是14.01
20. 人体内部分液体的正常pH范围见下表。其中显酸性的是
液体 | pH范围 |
血浆 | 7.35~7.45 |
胃液 | 0.9~1.5 |
胆汁 | 7.1~7.3 |
胰液 | 7.5~8.0 |
A. 血浆 B. 胃液 C. 胆汁 D. 胰液
21. 下列关于水的说法不正确的是
A. 化肥的不合理施用会引发水体污染
B. 地球上可供利用的淡水资源丰富
C. 节约水资源就要提高水的利用效益
D. 自然界的水经自来水厂处理后可得到城市生活用水
22. 鉴别空气、氧气和二氧化碳三瓶气体最简便的方法是
A. 观察气体的颜色 B. 测气体的溶解性
C. 闻气体气味 D. 将燃着的木条分别伸入三瓶气体中
23. 下列有关物质用途的叙述中,不正确的是
A. 水用作溶剂 B. 氯化钠用作调味剂
C. 氢氧化钠用于治疗胃酸过多 D. 氧气用于供给呼吸
24. 硝酸钾的溶解度曲线如图所示。下列说法不正确的是
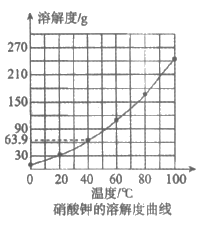
A. 40℃时,硝酸钾的溶解度为63.9g
B. 在0℃~100℃之间,硝酸钾溶解度随温度的升高而增大
C. 通过升温可将硝酸钾饱和溶液变为不饱和溶液
D. 20℃时,向100 g水中加入90 g硝酸钾,充分溶解,所得溶液为不饱和溶液
25. 工业合成甲醇反应前后分子种类变化的微观示意图如下。下列说法不正确的是
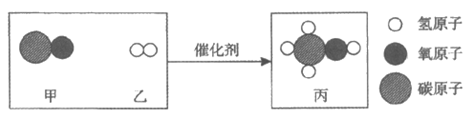
A. 甲醇的化学式为CH4O B. 反应物甲、乙均为化合物
C. 该反应为化合反应 D. 参加反应的甲、乙分子个数比为1:2
第二部分
非选择题(共45分)
【生活现象解释】
26. 化石燃料有煤、______________和天然气。天然气(主要成分CH4)充分燃烧的化学方程式为______________。
27. 猕猴桃和香蕉等水果常用乙烯(C2H4)催熟。
(1)乙烯分子中碳、氢原子个数比为______________。
(2)猕猴桃和香蕉等水果是人体获取______________(填营养素)的重要来源。
28. 水银温度计利用了汞的“热胀冷缩“现象。
(1)汞的“热胀冷缩“是温度变化时,______________(填序号)发生了变化。
A. 微粒大小 B. 微粒数量 C. 微粒间距
(2)水银温度计被打碎,可在汞表面覆盖硫单质,反应生成硫化汞(HgS),该反应的化学方程式为______________。
29. 中国考古专家在三星堆遗址的发现与研究,证明了中华文明起源的多元性。

(1)三星堆考古发掘中,出土的青铜面具锈迹斑斑。黄金面具仍金光灿灿,从物质性质的角度解释其原因是____________________________。
(2)研究人员用碳14年代检测方法进行分析,初步判断三星堆4号坑属于商代晚期。已知碳14原子中的质子数为6,中子数为8,则该原子的核外电子数为______________。
30. 蒸汽眼罩可以缓解眼部疲劳,其发热体中的主要成分是铁粉、氯化钠和碳粉。利用铁粉与空气中的氧气、水反应产生的能量,使水变为水蒸气。
(1)铁与氧气、水的反应属于______________(填“吸热“或“放热“)反应。
(2)取发热体内少量固体于试管中,加入稀盐酸,产生气泡,该反应的化学方程式为______________。
【科普阅读理解】
31. 阅读下面科普短文。
黄曲霉毒素是引起人类食物中毒最主要的物质之一。目前已发现的黄曲霉毒素共17种,其中AFB1(化学式为C17H12O6)是一种常见的黄曲霉毒素,大量存在于霉变的大米、花生中。
花生在30℃~38℃、潮湿的环境中容易发生霉变,因此花生油中常含有黄曲霉毒素。大米也会因储存不当而含有黄曲霉毒素。黄曲霉毒素需加热到280℃以上才能被破坏。将大米煮成米饭只能去除约2%的黄曲霉毒素。
为了降低黄曲霉毒素对人体健康的不利影响,保障消费者的食品安全,国际上规定食品中黄曲霉毒素的最大含量为0.02mg/kg。
紫外辐射法是一种常见的去除黄曲霉毒素的方法。利用不同波长的紫外光对花生油照射相同时间,测得照射前后花生油中黄曲霉毒素AFB1的含量如表所示。
不同波长紫外光对样品中AFB1去除情况
含量 | 254nm | 365nm | 420nm |
照射前AFB1含量/(mg/kg) |
|
|
|
照射后AFB1含量/(mg/kg) |
| 2.88 | 70.10 |
氨气熏蒸法也可以降低食品中黄曲霉毒素的含量。氨气与食品中的水结合后和黄曲霉毒素发生反应,去除了黄曲霉毒素。科研人员在40℃条件下,用氨气熏蒸含水量为20%的花生48 h,测得不同浓度氨气对花生中黄曲霉毒素AFB1的去除率,如下图所示。
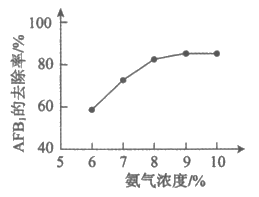
依据文章内容回答下列问题。
(1)AFB1是由______________种元素组成的。
(2)为防止花生霉变,应在______________环境下保存。
(3)利用紫外光照射去除花生油中的黄曲霉毒素AFB1,最好选用的紫外光波长是______________(填序号)。
A. 254 nm B. 365 nm C. 420 nm
(4)由图可知,氨气浓度对花生中黄曲霉毒素AFB1去除率的影响是:在熏蒸温度40℃,熏蒸时间48 h,花生含水量为20%的条件下,______________。
(5)下列说法正确的是______________(填序号)。
A. 黄曲霉毒素能损害人体健康
B. 将霉变大米煮熟后食用,可避免黄曲霉毒素中毒
C. 黄曲霉毒素含量为0.01mg/kg的花生油符合国际标准
【生产实际分析】
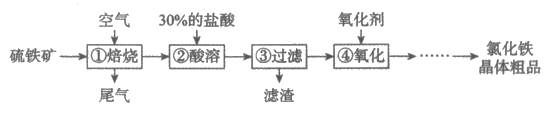
32. 以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
已知:①中发生的反应为:4FeS2+11O2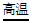 2Fe2O3+8SO2
2Fe2O3+8SO2
(1)将硫铁矿粉碎再焙烧的目的是____________________________。
(2)②中主要反应的化学方程式为______________。
(3)④中反应:X+2FeCl2=2FeCl3,X是______________(填化学式)。
(4)尾气用氢氧化钠溶液吸收,其意义是____________________________。
33. 由原盐(主要成分为NaCl,含有少量MgSO4、CaCl2等杂质)生产药用纯净氯化钠的工艺流程如下:
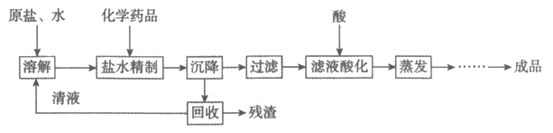
(1)滤液酸化中使用的酸最好选用______________(填“盐酸“或“硫酸“)。
(2)生产流程中,属于物理变化的步骤是______________(写出一种即可)。
【基本实验及其原理分析】
34. 实验室用下列装置进行实验。
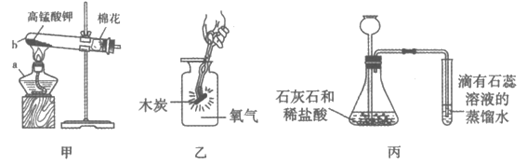
请从34—A或34—B两题中任选1个作答,若两题均作答,按34—A计分。
34—A | 34—A |
(1)仪器a的名称是______________。 (2)高锰酸钾受热分解的化学方程式为______________。 (3)乙中的现象是木炭燃烧,___________。 | (1)仪器b的名称是______________。 (2)石灰石与稀盐酸反应的化学方程式为______________。 (3)丙的试管中溶液颜色变化是_________。 |
35. 用下图装置进行实验。
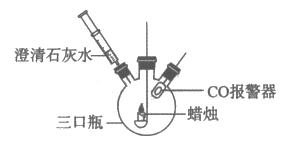
操作步骤 | 现象 | 解释及结论 |
(1)将点燃的蜡烛伸入瓶中,塞紧胶塞 | 一段时闻后,CO报警器发出报警声 | 蜡烛燃烧有CO生成 |
(2)蜡烛熄灭后,冷却至室温 | 瓶壁上有___________ | 蜡烛燃烧有水生成 |
(3)将澄清石灰水推入瓶中 | 澄清石灰水变浑浊 | 化学方程式为_____________ |
(4)实验分析:通过该实验可知,蜡烛中一定含有的元素是______________。 | ||
36. 用下图装置进行实验。试管A、B中是空气,白磷、红磷均足量。白磷着火点为40℃,红磷着火点为240℃。
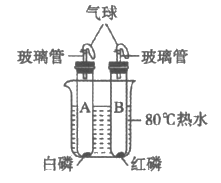
(1)能说明可燃物燃烧需要温度达到着火点的现象是____________________________。
(2)待A试管玲却,将其倒立在盛有水的水槽中,取下胶塞,能看到______________。
37. 完成实验,补全实验报告。
实验编号 | ① | ② | ③ |
装置及操作 |
|
|
|
现象 | 甲中出现气泡 乙中无明显现象 | 碘几乎不溶解 高锰酸钾完全溶解 | _____________ |
结论 | 锌的金属活动性比铜强 | ____________ | 分子在不断运动 |
38. 研究碳酸钠的性质,进行如下实验。
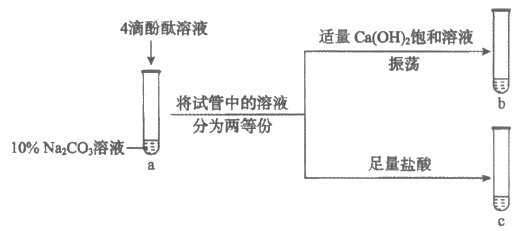
(1)20 g质量分数为10%的碳酸钠溶液中溶质的质量为__________g。
(2)试管a中,滴入酚酞后溶液变为红色,说明碳酸钠溶液呈__________(填“酸“”中“或“碱“)性。
(3)试管b中的现象是______________。
(4)试管c中反应的化学方程式为______________。
【科学探究】
39. 实验小组进行“蓝瓶子实验“。
装置 | 操作 | 现象 |
| 打开磁力搅拌器,搅拌 | 溶液呈蓝色 |
停止搅拌,静置 | 溶液褪为无色 | |
打开磁力搅拌器,搅拌 | 溶液变为蓝色 | |
停止搅拌,静置 | 溶液褪为无色 | |
…… | …… |
【提出问题】影响溶液褪色快慢的因素有哪些?
【查阅资料】
在碱性条件下存在如下转化关系:

【进行实验】
改变条件,按上述装置及操作进行对比实验。第一次褪色时间记录如下:
实验编号 | NaOH质量/g | 温度/℃ | 搅拌时间/s | 搅拌转速/(r/min) | 褪色时间/s |
① | 1.0 | 25 | 60 | 2500 | 90 |
② | 2.0 | 25 | 60 | 2500 | 68 |
③ | 3.0 | 25 | 60 | 2500 | 40 |
④ | 2.0 | 35 | 60 | 2500 | 45 |
⑤ | 2.0 | 45 | 60 | 2500 | 23 |
⑥ | 2.0 | 25 | 20 | 2500 | 39 |
⑦ | 2.0 | 25 | 100 | 2500 | 118 |
【解释与结论】
(1)搅拌的作用是使溶液与______________充分接触。
(2)设计对比实验①②③的目的是______________。
(3)得出“其他条件相同时,温度升高,能使溶液褪色更快“的结论,需要对比______________(填编号)。
(4)实验的结论是:影响溶液褪色快慢的因素有____________________________。
【反思与评价】
(5)实验发现随着变色次数的增加,褪色时间越来越长,可能的原因是____________________________,
(6)实验结束后,应对废液中的氢氧化钠进行处理,可加入的试剂是______________。
【实际应用定量分析】
40. 氢化钙(CaH2)可用作干燥剂,与水反应的化学方程式为:CaH2+2H2O=Ca(OH)2+2H2↑。现有2.1 g氢化钙,理论上可吸收水的质量是多少?(写出计算过程及结果)
【试题答案】
第一部分
选择题(共25分)
(每小题只有1个选项符合题意。每小题1分,共25分。)
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
答案 | C | D | C | B | A | D | B | A | D | C |
题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
答案 | A | C | A | B | A | D | D | B | C | B |
题号 | 21 | 22 | 23 | 24 | 25 | |||||
答案 | B | D | C | D | B |
第二部分
非选择题(共45分)
说明:以下每空1分。其他合理答案均可给分。
26. 石油 CH4+2O2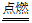 CO2+2H2O
CO2+2H2O
27. (1)1:2 (2)维生素
28. (1)C (2)Hg+S=HgS
29. (1)金的化学性质比铜稳定
(2)6
30. (1)放热
(2)Fe+2HCl=FeCl2+H2↑
31. (1)3 (2)低温、干燥
(3)B
(4)在6%~9%之间,氨气浓度越大,AFB1的去除率越高;在9%~10%之间几乎无影响。
(5)AC
32. (1)增大反应物接触面积,使反应更充分
(2)Fe2O3+6HCl=2FeCl3+3H2O
(3)Cl2
(4)防止污染空气
33. (1)盐酸
(2)溶解(或沉降、过滤、蒸发)
34.
34—A | 34—B |
(1)酒精灯 (2)2KMnO4 (3)发出白光 | (1)试管 (2)CaCO3+2HCl=CaCl2+H2O+CO2↑ (3)溶液由紫色变为红色 |
35. (2)无色液滴
(3)Ca(OH)2+CO2=CaCO3↓+H2O
(4)碳、氢(或C、H)
36. (1)A中白磷燃烧,B中红磷不燃烧
(2)水进入试管,约占试管容积的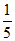
37. ①稀盐酸(或稀硫酸)
②高锰酸钾在水中的溶解性比碘强
③酚酞溶液变红
38. (1)2 (2)碱
(3)有白色沉淀生成
(4)Na2CO3+2HCl=2NaCl+H2O+CO2↑
39. (1)氧气
(2)探究其他条件相同时,NaOH溶液的浓度对溶液褪色快慢的影响
(3)②④⑤
(4)NaOH溶液的浓度、温度、搅拌时间
(5)溶液中的葡萄糖因反应不断消耗而逐渐减少
(6)盐酸(或硫酸)
40. 【解】设:理论上可吸收水的质量为x。
CaH2+2H2O=Ca(OH)2+2H2↑
42 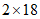 1分
1分
2.1gx
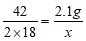 1分
1分
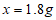 1分
1分
答:理论上可吸收水的质量为1.8g。

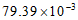
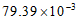
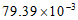
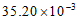
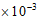
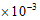

 K2MnO4
K2MnO4