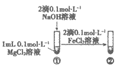
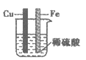
(考试时间90分钟
满分100分)
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23
第一部分
每小题只有一个选项符合题意,每小题3分,共14道小题,共42分。
1. 下列生活中的做法可以用氧化还原反应规律解释的是
A | B | C | D |
|
|
|
|
用铁粉作脱氧保鲜剂 | 用白醋去除水垢 | 用纯碱溶液清洗油污 | 用明矾净水 |
2. 下列关于氯及其化合物的说法不正确的是
A. 用石墨作电极电解饱和NaCl溶液,在阳极产生Cl2
B. 铁丝在氯气中燃烧,产生的棕黄色的烟主要成分为FeCl2
C. “84”消毒液与洁厕灵(主要成分为HCl)混用会产生Cl2
D. 光照可促进氯水中HClO分解,使溶液pH减小
3. 用下列装置进行分离提纯,主要利用的性质与物质溶解性无关的是
A | B | C | D |
|
|
|
|
从海水中获得蒸馏水 | 获取苯甲酸晶体 | 去除粗盐中的泥沙 | 用CCl4提取碘水中的I2 |
4. 铯为IA族元素,核素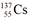 是铯的一种放射性同位素,可用于癌症治疗。下列关于
是铯的一种放射性同位素,可用于癌症治疗。下列关于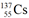 的说法,不正确的是
的说法,不正确的是
A. 质量数为137
B. 中子数为82
C. 原子半径:Cs>Na D. 碱性:CsOH<KOH
5. Deacon催化氧化法将HCl转化为Cl2的反应为:
4HCl
(g) + O2(g) === 2Cl2(g) + 2H2O (g) ΔH=-116 kJ·mol-1
研究发现CuCl2(s)催化反应的过程如下:
反应i:CuCl2(s) === CuCl(s) +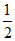 Cl2(g) ΔH1=+ 83 kJ·mol-1
Cl2(g) ΔH1=+ 83 kJ·mol-1
反应ii:CuCl(s) +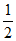 O2(g) === CuO(s) +
O2(g) === CuO(s) +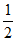 Cl2(g) ΔH2=-20 kJ·mol-1
Cl2(g) ΔH2=-20 kJ·mol-1
反应iii:……
下列表述不正确的是
A. 反应i中反应物的总能量小于生成物的总能量
B. 反应ii中,1 mol CuCl(s)反应时转移2 mol e–
C. 推断反应iii应为CuO(s) + 2HCl
(g) === CuCl2(s) + H2O (g) ΔH3=-242 kJ·mol-1
D. 由反应过程可知催化剂参与反应,通过改变反应路径提高反应速率
6. 下列化学用语对事实的表述不正确的是
A. 电解法精炼铜的阴极反应:Cu2+ + 2e-=== Cu
B. H和Cl形成共价键的过程: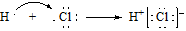
C. 铅蓄电池放电时的负极反应:Pb-2e-+ SO42-=== PbSO4
D. 向FeSO4溶液中滴加NaOH溶液,产生白色沉淀,并最终变为红褐色:
Fe2+ + 2OH-=== Fe(OH)2↓、4Fe(OH)2 + O2 + 2H2O === 4Fe(OH)3
7. 用下列仪器或装置(夹持装置略)进行实验,由实验现象不能得到相应结论的是
选项 | A | B | C | D |
实验 及 现象 |
热水中烧瓶内气体颜色变深 |
试管中出现白色沉淀 |
①中产生白色沉淀 ②中产生红褐色沉淀 |
Cu上无气泡 Fe上有气泡 |
结论 | 2NO2(g) 是放热反应 | 酸性: H2CO3>H2SiO3 | 溶解度: Mg(OH)2>Fe(OH)3 | 还原性: Fe>Cu |
8. 锅炉烟气中的NO可用连二亚硫酸盐(S2O42-)脱除,通过电解可使S2O42-再生,装置如下图所示。下列说法不正确的是
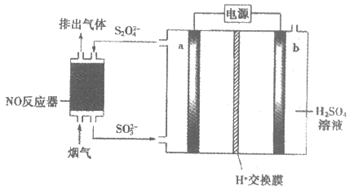
A. 连二亚硫酸盐作还原剂
B. 电极a应连接直流电源负极
C. 电极b的电极反应式:
2H2O – 4e– === O2↑+ 4H+
D. 电解过程中电极a附近溶液pH变小
9. 降低硫含量是裂化汽油精制处理的关键。S-Zorb技术使用Ni/ZnO作脱硫吸附剂脱除噻吩 中硫原子的过程如下。
中硫原子的过程如下。
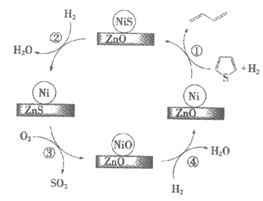
下列说法不正确的是
A. 过程①涉及极性键和非极性键的断裂
B. 过程③通入O2的主要目的是将ZnS转化为ZnO和SO2
C. 过程③中参加反应的O2和ZnS的物质的量之比是3∶2
D. 过程④通入H2的主要目的是使脱硫吸附剂再生
10. t
℃时,在恒容密闭容器中发生反应:X(g)+3Y(g) 2Z(g) ΔH,不同温度下容器中各组分浓度如下:
2Z(g) ΔH,不同温度下容器中各组分浓度如下:
物质 | X | Y | Z | |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 | |
平衡浓度 /mol·L-1 | 350℃ | 0.05 | 0.05 | 0.1 |
400℃ | 0.08 | 0.14 | 0.04 | |
已知:350℃时,反应经5 min达到平衡状态。
下列说法不正确的是
A. 该反应的ΔH
< 0
B. 350℃时,5 min内该反应平均速率v(Y) = 0.03 mol·L-1·min-1
C. 350℃达到平衡后再通入少量Y(g),达到新平衡时,X转化率增大
D. 350℃时,该反应的平衡常数K=40
11. 常温下,用NaOH溶液调节H3PO4溶液的pH,溶液中含磷微粒的物质的量分数与pH的关系如下图所示。
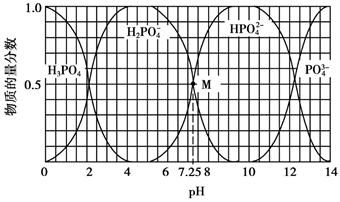
下列说法正确的是
A. H3PO4的电离方程式为:H3PO4 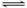 3H++PO43-
3H++PO43-
B. M点时,溶液中c(Na+)>c(H2PO4–)=c(HPO42-)>c(OH–)>c(H+)
C. pH=5时,溶液中c(Na+)=c(H2PO4–)+2c(HPO42-)+3c(PO43-)
D. pH=10时,溶液中水的电离程度比纯水小
12. 以废旧锌锰电池中的黑锰粉[含MnO2、MnO(OH)、NH4Cl、ZnCl2
、Fe2O3及炭黑等]为原料制备MnCl2,实现锰的再利用。其工艺流程如下:
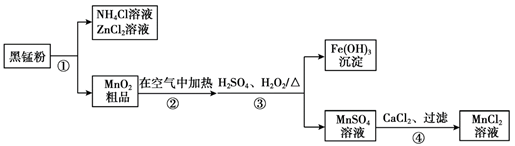
下列说法不正确的是
A. 步骤①分离出NH4Cl、ZnCl2的试剂和操作为:水、过滤
B. 步骤②中发生的反应:C+O2 CO2、
CO2、
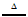
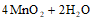
C. 步骤③若先加H2O2、后加H2SO4,可提高H2O2的利用率
D. 步骤④所得MnCl2溶液中含有少量CaSO4杂质
13. 高分子M可通过如下反应改性为具有更高强度的高分子N。
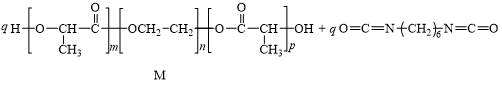
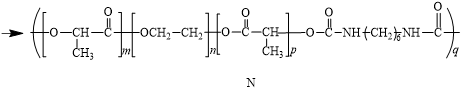
下列说法不正确的是
A. M可由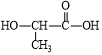 、HOCH2CH2OH反应得到
、HOCH2CH2OH反应得到
B. 由M合成N的反应类型为加成反应
C. N的结构中含有2种官能团
D. M、N都可以发生水解反应
14. 研究甲醛与新制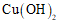 反应的固体产物(固体A),实验如下。
反应的固体产物(固体A),实验如下。
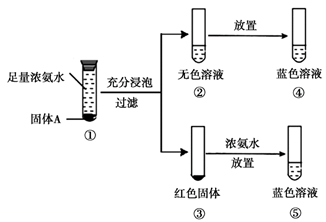
已知: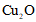 、
、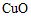 均能溶于浓氨水,分别产生Cu(NH3)2+(无色)、Cu(NH3)42+(蓝色)。
均能溶于浓氨水,分别产生Cu(NH3)2+(无色)、Cu(NH3)42+(蓝色)。
下列说法不正确的是
A. 甲醛与新制Cu(OH)2反应时,Cu(OH)2被还原
B. ②→④无色溶液变蓝,说明固体A中存在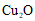
C. ③→⑤出现蓝色溶液的原因是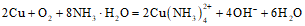
D. 将试管①替换为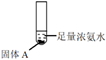 ,放置一段时间后发现溶液变蓝,也能确认固.体A的成分
,放置一段时间后发现溶液变蓝,也能确认固.体A的成分
第二部分
本部分共5题,共58分。
15. (10分)CH3OH是重要的基本有机原料,利用反应A可将CH4转化为CH3OH。
反应A:2CH4(g) + O2(g) === 2CH3OH(g) ΔH<0
(1)已知:破坏1 mol 化学键所需要的能量如下表所示。
化学键 | C—H | O==O | O—H | C—O |
能量/kJ | a | b | c | d |
① CH4的电子式是____。
② ΔH =____kJ·mol-1。
③ CH4难溶于水,而CH3OH能与水任意比互溶,原因是____。
(2)一定条件下将CH4与O2直接混合实现反应A,往往产生CO2等副产物。我国科研工作者利用FeCl3实现CH4的选择性氯化,使CH4转化为CH3Cl,并进一步水解得到CH3OH,流程示意如下。
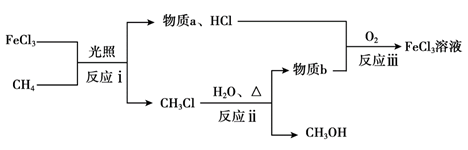
①
反应i的化学方程式是____。
②
物质b是____。
③
由FeCl3溶液结晶得到FeCl3·6H2O晶体,在HCl气流中加热FeCl3·6H2O晶体,能得到无水FeCl3,实现物质的循环利用,结合平衡移动原理解释HCl气流的作用:____。
16.(12分)金属镓(Ga)是合成半导体材料砷化镓(GaAs)的重要基础材料,一种由砷化镓废料制备镓的工艺流程如下图。

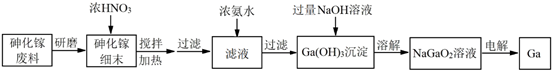
已知:i. Ga(OH)3与Al(OH)3性质相似
ii. NO2可以溶于浓HNO3中
(1)酸浸溶解:
①
上述流程中能加快反应速率的措施有____。
②
将GaAs与浓HNO3反应的化学方程式补充完整:
 GaAs +
GaAs + HNO3 (浓)===
HNO3 (浓)===  Ga(NO3)3 +
Ga(NO3)3 + H3AsO4 +
H3AsO4 + ____+
____+  H2O
H2O
③
其他条件相同时,研究镓的浸出率随时间变化情况,实验结果如下图。
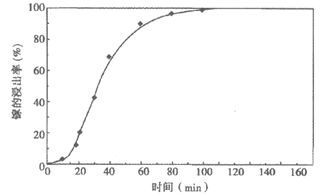
推测NO2能够催化GaAs与浓硝酸的反应,设计实验证实了推测。
实验方案:用N2不断将生成的NO2吹出,测镓的浸出率随时间变化情况。
预测该方案对应的镓的浸出率随时间变化情况(在上图中画出相应变化情况曲线)。
(2)除杂转化:
①
上述工艺流程中浓氨水的作用是____。
② Ga(OH)3沉淀与NaOH溶液反应的离子方程式为____。
(3)电解制镓:
以Pt为电极材料,电解NaGaO2溶液制金属镓,阴极反应式为____。
17. (12分)心得隆(Q)可用于防治血栓,其一种合成路线如下所示。
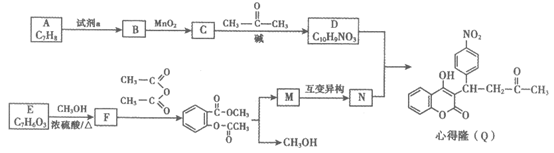
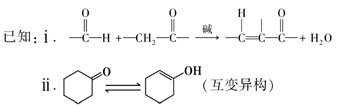
(1)芳香烃A的名称为____。
(2)试剂a是____,C中所含的官能团为____。
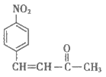
(3)D的结构简式为____。
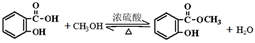
(4)E→F的化学方程式是____。
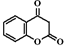
(5)M的结构简式为____。
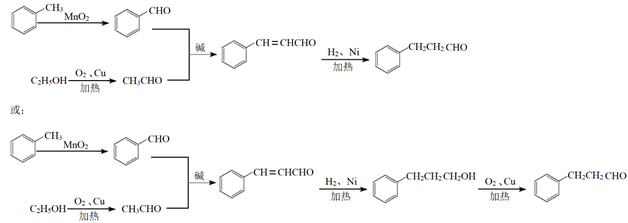
(6)苯丙醛(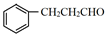 )可用于配制香精。以物质A和乙醇以及必要的无机试剂为原料合成苯丙醛,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
)可用于配制香精。以物质A和乙醇以及必要的无机试剂为原料合成苯丙醛,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
18.
(12分)以TiO2为催化剂,在光照条件下可将CO32-还原为HCOO-等有机物。
(1)制备TiO2:

TiCl4转化为TiO2·xH2O的化学方程式是_________。
(2)光催化还原CO32-的反应过程如下图所示。
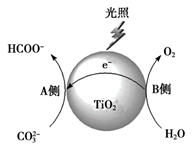
A侧产生HCOO–的反应式为____。
在光照和TiO2存在下,以体积相同的0.25 mol·L-1 Na2CO3溶液为反应物,相同时间后检测HCOO-浓度,结果如下表。
实验 | 溶液中添加的其它成分 | 通入的气体 | c(HCOO-)/ ×10-5 mol·L-1 |
i | — | — | 73.5 |
ii | — | CO2 | 92.6 |
iii | — | O2 | 2.1 |
iv | Na2SO3 | — | 158.1 |
(3)推测HCO3-也能在该条件下被还原为HCOO-,结合表中数据说明推测的依据:_______。
(4)实验iii中HCOO-浓度明显低于实验i,可能的原因是________。
(5)研究实验iv中HCOO-浓度明显高于实验i的原因,设计并完成实验v。
实验v:光照条件下,未添加TiO2时重复实验iv,没有检测到SO42-。
①
实验v中检测SO42-的操作和现象为_______。
②
对比实验iv、v,分析实验iv中Na2SO3的作用:________(答出2点)。
19.(12分)工业上用铁粉还原AgCl制取银,某小组探究其过程和影响因素。
【实验A】在试管中加入NaCl溶液,然后滴入AgNO3溶液,产生白色沉淀。滤出白色沉淀,继续实验如下:
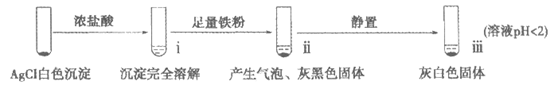
【资料】
① AgCl + Cl–
 AgCl2–
AgCl2–
② Fe3+ + 4Cl–
 FeCl4–
FeCl4–
(1)检验ⅱ中产物
①
取ⅱ中上层清液,滴加K3[Fe(CN)6]溶液,____(填现象),说明溶液中含有Fe2+。
②
取ⅱ中少量灰黑色固体,洗涤后将固体等分两份。取其中一份,加入____(填试剂)溶解,再加入NaCl溶液生成白色沉淀,证明灰黑色固体中含有Ag。向另一份加入KI溶液,无明显现象。
(2)检验ⅲ中产物。
①
取ⅲ中灰白色固体,洗涤。进行如下实验,确认灰白色固体中含AgCl:
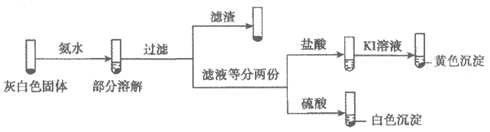
滤液加盐酸未产生沉淀,但加入硫酸后产生了白色沉淀,结合离子方程式解释原因:____。
②
取iii中上层溶液,加几滴KSCN溶液。取样时间与溶液颜色如下表。
取样时间 | 10分钟 | 12小时 | 24小时 |
溶液颜色 | 浅红色 | 红色 | 深红色 |
用离子方程式表示溶液变红的原因____,Fe3+ +3SCN–
 Fe(SCN)3。
Fe(SCN)3。
(3)小组同学认为不能排除O2直接氧化Ag继而生成AgCl,对此设计实验:____。
结果发现,该实验产生AgCl所需的时间更长。说明AgCl的产生主要与Fe3+有关。
(4)实验A中的i~iii中,i 中AgCl溶解,iii中又生成AgCl的原因是:____。
(5)实验反思:铁粉还原AgCl制取银时应控制铁粉、盐酸的浓度和浸泡时间等因素。
参考答案
第一部分
每小题只有一个选项符合题意,每小题3分,共14道小题,共42分。
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
答案 | A | B | A | D | C | B | B | D | C | D |
题号 | 11 | 12 | 13 | 14 | ||||||
答案 | B | C | C | D |
第二部分
本部分共5题,共58分。
15. (10分)
(1)
①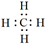
② –(2c+2d -2a-b)或2a+b-2c-2d
③甲醇中的羟基可与水分子之间形成氢键
(2)
① CH4 + 2FeCl3
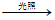 CH3Cl + 2FeCl2 + HCl
CH3Cl + 2FeCl2 + HCl
② HCl
③ FeCl3·6H2O  Fe(OH)3 + 3HCl+ 3H2O,通入HCl,抑制FeCl3水解;
Fe(OH)3 + 3HCl+ 3H2O,通入HCl,抑制FeCl3水解;
同时,HCl气流可带走H2O
16. (12分)
(1)①
研磨、搅拌、加热
② 1; 11; 1; 1; 8NO2↑; 4
③
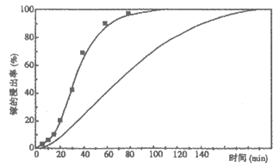
(2)①
将Ga3+转化为Ga(OH)3沉淀,实现分离
② Ga(OH)3 + OH– === GaO2– + 2H2O
(3) GaO2– + 3e– + 2H2O
=== Ga + 4OH–
17. (12分)
(1)甲苯
(2)浓硫酸、浓硝酸
;
醛基、硝基
(3)
(4)
(5)
(6)
18. (12分)
(1)TiCl4 +(x+2)H2O === TiO2·xH2O↓+ 4HCl
(2)CO32- + 2e– + 2H2O  === HCOO– + 3OH–
=== HCOO– + 3OH–
(3)实验ii中,通入CO2将CO32- 转化为了HCO3–,c(CO32-)减小,但c(HCOO–)
增大
(4)HCOO–  有还原性,可能被生成的O2氧化;O2在A侧直接得电子,降低了CO32-得电子的机会
有还原性,可能被生成的O2氧化;O2在A侧直接得电子,降低了CO32-得电子的机会
(5)
①
取少量反应后溶液,加入足量盐酸,再加入BaCl2溶液,未出现白色沉淀
② Na2SO3消耗O2,减少了HCOO– 的氧化损失;在光照和TiO2存在下,Na2SO3可在B侧失e– ,更有利于CO32-转化为HCOO–
19. (12分)
(1)
①
产生蓝色沉淀
②
硝酸
(2)
①
加盐酸时,溶液中c(Cl–)较大,发生Ag(NH3)2+ + 2Cl– + 2H+===AgCl2–+2NH4+,故未产生沉淀;加硫酸时,溶液中c(Cl–)较小,发生Ag(NH3)2+ + Cl– + 2H+===AgCl↓+2NH4+,故产生沉淀。
② 4Fe2+ + O2 + 4H+=== 4Fe3++2H2O
(3)取少量银粉于试管中,加入盐酸,静置一段时间,观察现象
(4)ii中Fe2+静置过程中生成的c(Fe3+)逐渐增大,Fe3++ 4Cl– 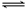 FeCl4–正向移动,c(Cl–)逐渐减小,使AgCl + Cl–
FeCl4–正向移动,c(Cl–)逐渐减小,使AgCl + Cl–
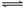 AgCl2–逆向移动,AgCl沉淀析出
AgCl2–逆向移动,AgCl沉淀析出