本试卷共两部分,38道小题,满分70分。考试时间70分钟。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Ba 137
第一部分
选择题(共25分)
每小题1分。在每小题列出的四个选项中,选出符合题目要求的一项。
1. 下列变化属于化学变化的是
A. 食物腐败 B. 西瓜榨汁 C. 瓷碗破碎 D. 湿衣晾干
2. 下列不属于新能源的是
A. 地热能 B. 太阳能 C. 石油 D. 风能
3. 下列食物中富含蛋白质的是
A. 土豆 B. 菠菜 C. 面包 D. 鸡蛋
4. 地壳中含量最多的金属元素是
A. 氧 B. 硅 C. 铝 D. 铁
5. 下列物质在氧气中燃烧,火星四射、生成黑色固体的是
A. 木炭 B. 蜡烛 C. 铁丝 D. 红磷
6. 氢氧化钙可用于改良酸性土壤,其俗称是
A. 火碱 B. 熟石灰 C. 烧碱 D. 纯碱
7. 为了防止骨质疏松,人体必须摄入的元素是
A. 钙 B. 铁 C. 锌 D. 碘
8. 下列物质放入水中,能形成溶液的是
A. 花生油 B. 食盐 C. 面粉 D. 牛奶
9. 下列材料中,属于有机合成材料的是
A. 棉花 B. 木材 C. 羊毛 D. 塑料
10. 下列实验操作中正确的是
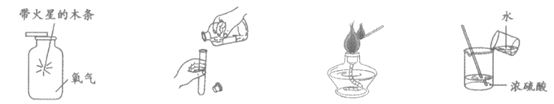
A. 氧气验满 B. 取少量液体 C. 点燃酒精灯 D. 稀释浓硫酸
11. 下列物质pH范围如下,其中酸性最强的是
A. 柠檬汁(2.0~3.0) B. 西瓜汁(5.0~6.0)
C. 胡萝卜汁(6.0~7.0) D. 鸡蛋清(7.6~8.0)
12. 下列符号能表示两个氢分子的是
A. H2 B. H2O C. 2H2 D. 2H
13. C919客机部分机身采用了铝锂合金,铝元素与锂元素的本质区别是
A. 相对原子质量不同 B. 中子数不同
C. 最外层电子数不同 D. 质子数不同
14. 某些食品需要充气防腐。下列气体最宜充入的是
A. 氮气 B. 氧气 C. 氢气 D. 空气
15. 鉴别空气、氧气和二氧化碳三瓶气体的方法是
A. 观察气体颜色 B. 插入燃着的木条
C. 闻气体的气味 D. 倒入澄清石灰水
16. 野炊时,小明发现木柴火焰很小,将木柴架空后火焰变大,架空的目的是
A. 便于观察火焰的大小 B. 升高木柴的温度
C. 降低木柴的着火点 D. 增大木柴与空气的接触面积
17. 北斗导航卫星系统采用铷原子钟提供精确时间,如图为铷在元素周期表中的相关信息,下列说法正确的是
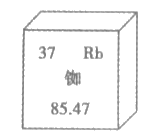
A. 铷属于非金属元素 B. 铷原子中的电子数为37
C. 铷原子中的中子数为37 D. 铷的相对原子质量是85.47g
18. 6000L氧气在加压的情况下可装入容积为40L的钢瓶中,是因为氧气分子
A. 质量减小 B. 体积减小 C. 个数减少 D. 间隔减小
19. 下表中的物质、化学式及用途三者对应关系不正确的是
选项 | 物质 | 化学式 | 用途 |
A | 活性炭 | C | 可作吸附剂 |
B | 干冰 | H2O | 可作制冷剂 |
C | 甲烷 | CH4 | 可作燃料 |
D | 小苏打 | NaHCO3 | 可治疗胃酸过多症 |
20. 石灰氮是一种固态肥料,遇水反应的化学方程式为CaCN2+3H2O=CaCO3+2X,则X的化学式为
A. NO B. NH3 C. CO2 D. N2
21. 粽子的香味源于粽叶的主要成分——对乙烯基苯酚(化学式为C8H8O)。下列说法不正确的是
A. 对乙烯基苯酚属于化合物
B. 对乙烯基苯酚由3种元素组成
C. 对乙烯基苯酚中碳元素的质量分数最大
D. 对乙烯基苯酚由8个碳原子、8个氢原子、1个氧原子构成
22. 下列方法能达到除杂目的的是
选项 | 物质(括号内为杂质) | 方法 |
A | 二氧化碳(一氧化碳) | 点燃混合气体 |
B | 铜粉(碳粉) | 在空气中灼烧固体混合物 |
C | 氧气(水蒸气) | 将混合气体通过浓硫酸 |
D | 氯化钠(氢氧化钠) | 加水溶解,过滤 |
23. 常温下,对100mL氯化钠饱和溶液进行如下实验。下列分析不正确的是
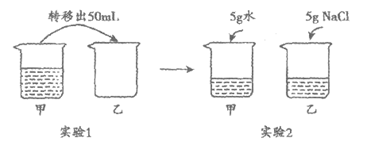
A. 实验1后,甲、乙中溶液的溶质质量分数相等
B. 实验2后,乙中比甲中氯化钠的溶解度大
C. 实验2后,甲中溶液为氯化钠的不饱和溶液
D. 实验2后,甲、乙中溶液所含溶质质量相等
24. 汽车尾气处理过程中发生反应的微观示意图如下,下列说法正确的是
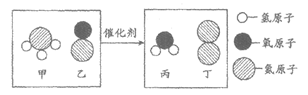
A. 1个甲分子中有3个原子 B. 该化学反应前后分子的个数不变
C. 属于氧化物的物质有3种 D. 参加反应的甲和乙的质量比为17:45
25. 用下列对比实验探究碱的性质,下列说法不正确的是

A. 实验1的现象说明氢氧化钠需密封保存
B. 实验2中软塑料瓶变瘪的程度为A>B>C
C. 只能通过对比A、C瓶的现象证明CO2与氢氧化钠反应
D. 饱和氢氧化钠溶液比饱和石灰水吸收二氧化碳的效果好
第二部分
非选择题(共45分)
【生活现象解释】
26. (4分)网购、高铁、共享单车和扫码支付被称为中国“新四大发明“。
(1)网购离不开光纤宽带。光纤的主要成分是SiO2,SiO2属于_________(填序号)。
A. 混合物 B. 纯净物 C. 单质 D. 氧化物
(2)制造高铁车体需要大量的钢铁,写出用CO和Fe2O3反应炼铁的化学方程式__________________。
(3)为防止共享单车的铁制车架与空气中的_____________接触而生锈,通常进行喷漆处理。生锈后,用盐酸除铁锈的化学方程式为_____________。
27. (3分)化学小组做“电池锡纸取火“的趣味实验:取口香糖内的“锡纸“,将“锡纸“剪成两头宽中间窄的形状,进行如图所示实验,观察到“锡纸“从中间最窄部分先燃烧起来。
(1)铝和锡都是银白色金属,可用于制作包装用的金属箔,是因为它们具有良好的_________性。
(2)小明猜想“锡纸“上的金属是铝,而不是锡,做了如下实验:用细砂纸打磨“锡纸“后,放入_________中,通过观察实验现象,证明小明的猜想正确。
(3)铝具有抗腐蚀性的原因是_________(用化学方程式表示)。
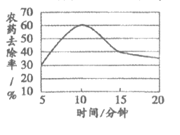
28. (1分)蔬菜水果是餐桌上的必备食物。食用果蔬前,用清水浸泡可适当降低农药残留,浸泡时间对农药去除率的影响如图所示,分析如图得到的结论是_____________。
【科普阅读理解】
29. (5分)阅读下面科普短文。
复原乳就是奶粉兑水还原而成的牛奶,可作为奶制品的原料奶,但需标明“复原乳“,以保障消费者的知情权和选择权。
与鲜牛乳相比,复原乳的加工至少经过两次高温处理,杀灭牛乳中的微生物。高温处理对牛乳中的蛋白质、钙和脂溶性维生素A、D等的含量影响不大,但会对热比较敏感的水溶性维生素B2、B12等造成部分损失。奶制品加热时会产生糠氨酸,糠氨酸含量越高,奶制品的营养价值越低。
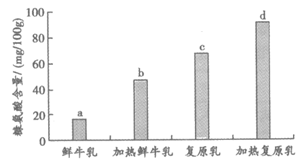
下图为科研人员以蛋白质含量相同的鲜牛乳与复原乳为研究对象,分别测定不加热和加热(95℃,2min)处理后的牛乳中糠氨酸含量,结果如图所示。
复原乳并非“假牛奶“,其加工过程中造成的营养损失,可以通过多吃豆类、坚果和粗粮等食物补充上来。当然,牛奶的最佳选择是新鲜的巴氏奶,因为巴氏奶只需在70℃时加热十几秒钟,杀灭牛乳里所有致病菌,较大程度地保留了牛乳中的全部营养成分。
依据文章内容回答下列问题。
(1)复原乳属于_________(填“混合物“或“纯净物“)。
(2)在包装上标识“复原乳“的目的是_____________。
(3)结合图示分析,能说明热处理对牛乳中糠氨酸含量有影响的一组实验是_____________。
(4)维生素A、D与维生素B2、B12的区别是_________(写一点即可)。
(5)下列说法正确的是_____________(填序号)。
A. 复原乳就是鲜牛乳,营养成分完全一样
B. 高温处理的目的是杀灭牛乳中的微生物
C. 复原乳也能达到为人体提供蛋白质和钙的目的
D. 巴氏奶是购买牛奶的最佳选择,因为营养成分更全面
【生产实际分析】
30. (3分)波尔多液是农业上常用的杀菌剂,生产波尔多液的流程如下:
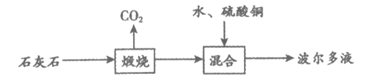
(1)“煅烧“的化学方程式为CaCO3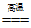 CaO+CO2↑,该反应属于基本反应类型中的__________________反应。
CaO+CO2↑,该反应属于基本反应类型中的__________________反应。
(2)“混合“时不能用铁制容器,原因是___________________(用化学方程式解释)。
(3)“混合“时需不断搅拌,目的是______________________。
31. (4分)钛(Ti)被称为“航空金属“。由钛铁矿(主要成分是钛酸亚铁,化学式为FeTiO3)制备钛的流程如下:
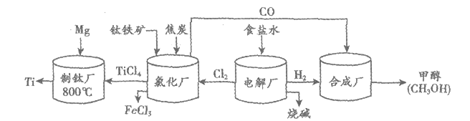
(1)钛酸亚铁中钛元素的化合价为_____________。
(2)电解厂参加反应的物质为_____________。
(3)制钛厂中,在氩气环境下发生置换反应的化学方程式为____________。
(4)合成厂中,参加反应的CO和H2的分子个数比为_____________。
【基本实验及其原理分析】
32. (3分)利用下列操作完成相关实验。
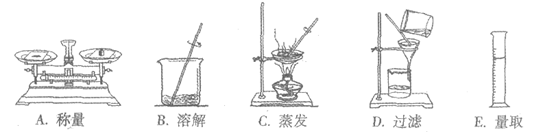
(1)操作D中玻璃棒的作用是__________________。
(2)去除粗盐中难溶性杂质的主要操作顺序是_____________(填序号)。
(3)配制100g 18%的氯化钠溶液时,量筒读数应为 _________(ρ水≈1g/cm3)。
33. (4分)下列是初中化学中的重要实验。
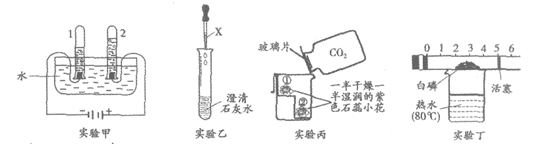
(1)实验甲,研究水的组成,该实验的结论是_________。
(2)实验乙,观察到有白色沉淀生成,该反应的化学方程式为_____________。
(3)实验丙,观察到小花湿润的部分②处比①处先变红,干燥部分不变红,其原因是_____________。
(4)实验丁,能证明空气中氧气含量的现象是_____________。
34. (2分)将少量硫酸铜溶液分别滴入1~3的井穴孔中,研究4种金属的活动性强弱。
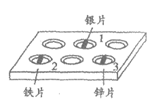
(1)有一井穴孔中的物质不与硫酸铜溶液反应,其原因是_____________________。
(2)通过该实验,无法比较出金属活动性顺序的两种金属是_____________。
35. (4分)用下图装置进行O2、CO2制取的实验。
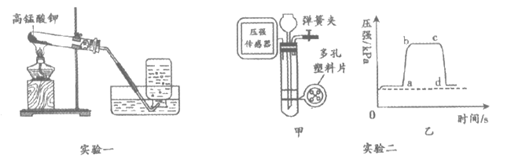
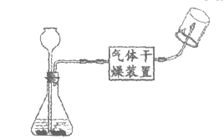
(1)实验一,制取氧气的化学方程式为_____________,能用排水法收集氧气的原因是_____________。
(2)实验二,甲图是可以控制反应发生和停止的实验室制二氧化碳的装置,实验过程中某段时间试管内气压的变化如乙图所示,a点对应的操作是关闭弹簧夹。
①甲中发生反应的化学方程式为_____________。
②下列说法正确的是_________(填序号)。
A. ab段表示试管中液面逐渐上升
B. bc段表示石灰石与稀盐酸脱离接触
C. c点对应的操作是打开弹簧夹
36. (3分)用下图装置探究可燃物燃烧条件(装置气密性良好)。
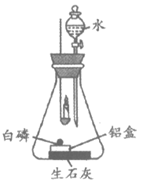
已知:白磷的着火点为40℃。
步骤I:点燃蜡烛,立即伸入瓶中,并塞紧瓶塞。
步骤Ⅱ:一段时间后,待蜡烛熄灭并冷却至室温,打开分液漏斗活塞,向锥形瓶中注入少量水,立即关闭活塞,观察到铝盒中的白磷燃烧。
(1)对比步骤I中蜡烛点燃前后的现象,可得出可燃物燃烧的条件是_____________。
(2)步骤Ⅱ中白磷燃烧的化学方程式为_________。
(3)分析上述实验,下列说法正确是__________(填序号)。
A. 蜡烛燃烧耗尽了瓶内的氧气,所以蜡烛熄灭
B. 蜡烛燃烧后瓶内还有少量氧气,但氧气浓度过低导致蜡烛熄灭
C. 生石灰的作用是与水反应提供热量,并利用生成物吸收二氧化碳
【科学探究】
37. (6分)20℃时,将镁条放入饱和(溶质质量分数约为17.7%)的Na2CO3溶液中,观察到持续产生较多气泡,且有白色沉淀生成。实验小组对其进行探究。
【查阅资料】①镁能与水缓慢反应生成氢气。
②Na2CO3、K2CO3溶液均显碱性,其溶液中除金属离子、CO32-外,还有OH–。
实验1:探究反应产生的气体
【猜想与假设】
I. 气体是H2 Ⅱ. 气体是CO2 Ⅲ. 气体是H2和CO2
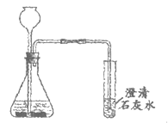
【进行实验】取适量镁条、100mL饱和Na2CO3溶液,按下图所示方案进行实验。
编号 | 1-1 | 1-2 | |||
装置 |
|
| |||
实验现象 | 澄清石灰水 | 气体被点燃,烧杯内壁有小液滴生成 | |||
实验2:探究持续产生较多气体的原因
【猜想与假设】Na2CO3溶液中的某一种离子促进了镁与水的反应,从而产生较多气体。
【进行实验】20℃时,利用图示装置分别完成下列实验,记录如下:
装置 | 编号 | 实验操作 | 实验现象 |
| 2-1 | 向试管中加入2mL 17.7%的Na2CO3溶液 | 持续产生较多气泡 |
2-2 | 向试管中加入2mL 1%的Na2CO3溶液 | 有少量气泡 | |
2-3 | 向试管中加入2mL 17.7%的K2CO3溶液 | 持续产生较多气泡 | |
2-4 | 向试管中加入2mL 17.7%的X溶液 | 无明显现象 | |
2-5 | 向试管中加入2mL 1%的X溶液 | 无明显现象 |
【解释与结论】
(1)依据实验1-1、1-2的现象,可得出猜想I正确。
①补全实验1-1的现象_____________。
②实验1-2中有小液滴生成的原因是_________(用化学方程式解释)。
(2)实验2-4、2-5中加入的X是_________。
(3)得出“Na2CO3溶液浓度越大,反应更剧烈“的结论,依据的实验是 _________(填编号)。
(4)实验2的结论是_____________。
【反思与评价】
(5)欲进一步检验反应产生的白色沉淀中是否含有碳酸盐,所需试剂是_____________。
【实际应用定量分析】
38. (3分)过氧化氢溶液是一种常见消毒剂,可用BaO2+H2SO4=BaSO4↓+H2O2反应制取。当有23.3g BaSO4生成时,计算同时生成H2O2的质量。
参考答案
说明:1. 考生答案如与本答案不同,若答得合理正确给分。
2. 化学方程式中的“===”和“→“含义相同。
第一部分
选择题(每小题1分,共25分)
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
答案 | A | C | D | C | C | B | A | B | D | C | A | C | D |
题号 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
答案 | A | B | D | B | D | B | B | D | C | B | D | C |
第二部分
非选择题(共45分)
【生活现象解释】
26. (4分)
(1) BD (2)3CO+Fe2O3
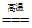 2Fe+3CO2
2Fe+3CO2
(3)水和氧气 Fe2O3+6HCl===2FeCl3+3H2O
27. (3分)
(1)延展
(2)硫酸锌(或硫酸亚铁)溶液
(3)4Al+3O2===2Al2O3,
28. (1分)
在5~20分钟的范围内,随着浸泡时间的增长农药的去除率先增大后减小
【科普阅读理解】
29. (5分)
(1)混合物
(2)保障消费者的知情权和选择权
(3)ab或cd
(4)耐热性(或溶解性)
(5)BCD
【生产实际分析】
30. (3分)
(1)分解
(2)Fe+CuSO4= Cu+FeSO4
(3)使反应物充分接触,加快反应速率
31. (4分)
(1)+4 (2)NaCl和H2O
(3)2Mg+TiCl4
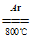 2MgCl2+Ti (4)1:2
2MgCl2+Ti (4)1:2
【基本实验及其原理分析】
32. (3分)
(1)引流
(2)BDC (3)82
33. (4分)
(1)水由氢元素和氧元素组成
(2)Ca(OH)2+Na2CO3====CaCO3↓+2NaOH
(3)二氧化碳的密度大于空气且能与水反应生成酸
(4)活塞最终停在4处
34. (2分)
(1)在金属活动顺序里,Ag位于Cu后,不与CuSO4反应
(2)铁、锌
35. (4分)
(1)2KMnO4
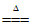 K2MnO4+ MnO2+O2↑ 氧气不易溶于水
K2MnO4+ MnO2+O2↑ 氧气不易溶于水
(2)①CaCO3+2HCl===CaCl2+ H2O+CO2↑ ②BC
36. (3分)
(1)温度达到着火点
(2)4P+5O2
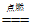 2P2O5
2P2O5
(3)BC
【科学探究】
37. (6分)
(1)①不变浑浊
②2H2+O2
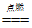 2H2O
2H2O
(2)NaOH
(3)2-1、2-2
(4)Na2CO3溶液中的CO32-促进了镁与水的反应,从而产生较多气体
(5)稀盐酸和澄清石灰水
【实际应用定量分析】
38. (3分)
解:设生成H2O2质量为x。
BaO2+H2SO4====BaSO4↓+H2O2
233 34
23.3g x………………………………………1分
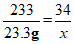 ……………………………………………………1分
……………………………………………………1分
x=3.4g ……………………………………………………1分
答:生成H2O2质量为3.4g