(考试时间90分钟
满分100分)
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Cl 35.5 Mn 55
第一部分
每小题只有一个选项符合题意,每小题3分,共14道小题,共42分。
1. 下列家庭常用消毒剂的有效成分属于无机物的是
A | B | C | D | |
家庭 常用 消毒剂 |
|
|
|
|
有效 成分 | 对氯间二甲苯酚 | 乙醇 | 次氯酸钠 | 过氧乙酸 |
2.
下列化学用语不正确的是
A. 羟基的电子式: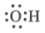
B. 乙烯的球棍模型:
C. Cl的原子结构示意图:
D. 乙醇的分子式:C2H6O
3. 下列说法不正确的是
A. 氨基酸能与酸、碱反应生成盐
B. 葡萄糖和蔗糖的官能团种类完全相同
C. 乙醇和乙醛可用银氨溶液进行鉴别
D. 氢键既影响有机物的沸点,又影响有机物的空间结构
4. 用NA代表阿伏加德罗常数的数值。下列说法正确的是
A. 7.8g Na2O2中含有的离子数为0.3NA
B. 1mol NO2与水完全反应转移的电子数为NA
C. 标准状况下,22.4L NH3含有的质子数为5NA
D. 1L 0.1mol·L-1NH4Cl溶液中含有的NH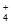 数为0.1NA
数为0.1NA
5. 镓(31Ga)是化学史上第一个先从理论上被预言,后在自然界被发现的元素。Ga与K同周期。下列说法不正确的是
A. Ga在周期表中的位置:第4周期第ⅢA族
B. 原子半径:Ga>K
C. 中子数为36的Ga的核素: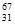 Ga
Ga
D. 最高价氧化物对应水化物的碱性:Ga(OH)3>Al(OH)3
6. 科研人员研究了通电条件下N2,在催化剂Au(金)表面生成NH3的反应,反应机理如下图所示。下列说法不正确的是
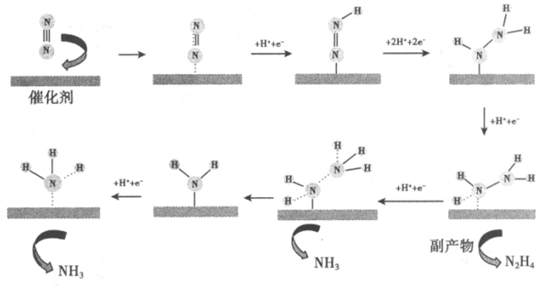
A. 上述转化过程中涉及非极性键的断裂和极性键的生成
B. 生成NH3的总电极反应式为N2+6H++6e-=2NH3
C. 当1mol N2在电解池的阴极发生反应时,可得到2mol NH3
D. 使用Au作催化剂可以降低反应的活化能,从而提高化学反应速率
7. 在抗击新冠肺炎的过程中,科研人员研究了法匹拉韦、利巴韦林、氯硝柳胺等药物的疗效,三种药物主要成分的结构简式如下。下列说法不正确的是
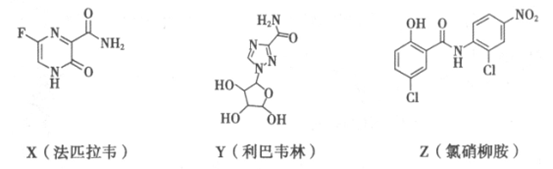
A. X的分子式为C5H4O2N3F
B. Z含有6种官能团
C. Y和Z都有羟基,但性质不完全相同
D. X和Z都能发生加成反应和水解反应
8. 下列解释事实的方程式不正确的是
A. 用明矾作净水剂:Al3++3H2O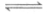 Al(OH)3(胶体)+3H+
Al(OH)3(胶体)+3H+
B. NO2球浸泡在冷水中,颜色变浅:2NO2(g)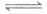 N2O4(g)
N2O4(g)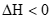
C. 用醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O
D. CO2通入苯酚钠溶液中出现浑浊: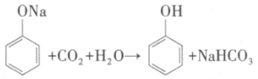
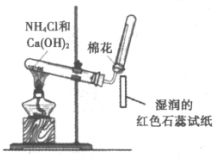
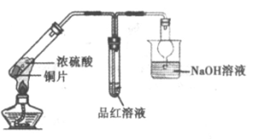
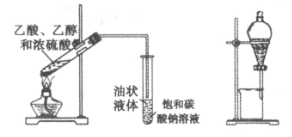
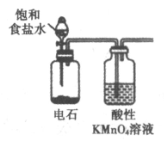
9. 下列物质的实验室制取、检验及分离方法不合理的是(夹持装置已略去,气密性已检验)
|
|
A. 制取并检验氨气 | B. 制取并检验SO2气体 |
|
|
C. 制取并提纯乙酸乙酯 | D. 制取并检验乙炔 |
10. 疫情期间某同学尝试在家自制含氯消毒剂。用两根铅笔芯(C1和C2)、电源适配器和水瓶组装如图所示的装置。接通电源观察到:C1周围产生细小气泡,C2周围无明显现象;持续通电一段时间后,C2周围产生细小气泡。此时停止通电,拔出电极,旋紧瓶塞,振荡摇匀,制备成功。
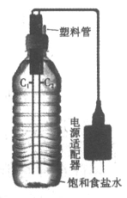
下列关于该实验的说法不正确的是
A. C1电极产生气泡原因:2H2O+2e-=H2↑+2OH-
B. 自制消毒剂的总反应为NaCl+H2O NaClO+H2↑
NaClO+H2↑
C. 可以用两根铁钉代替铅笔芯完成此实验
D. 实验过程中要注意控制电压、开窗通风、导出氢气,确保安全
11. 反应2NO(g)+2CO(g) N2(g)+2CO2(g)
N2(g)+2CO2(g)
 可用于消除汽车尾气中的有害气体。在密闭容器中充入4mol NO和5mol CO,平衡时NO的体积分数随温度、压强的变化关系如图。下列说法不正确的是
可用于消除汽车尾气中的有害气体。在密闭容器中充入4mol NO和5mol CO,平衡时NO的体积分数随温度、压强的变化关系如图。下列说法不正确的是
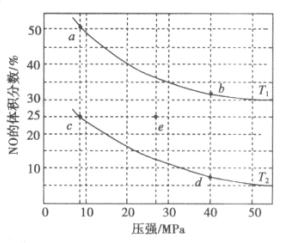
A. 温度:T1>T2
B. a点达平衡所需时间比c点短
C. c点NO的平衡转化率:50%
D. 若在e点对反应容器升温的同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中的c点
12. 维纶(聚乙烯醇缩甲醛纤维)可用于生产服装、绳索等。其合成路线如下:
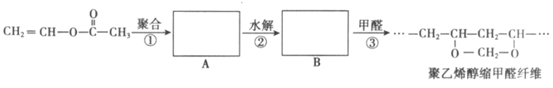
下列说法不正确的是
A. 反应①是加聚反应
B. 高分子A的链节中只含有一种官能团
C. 通过质谱法测定高分子B的平均相对分子质量,可得其聚合度
D. 反应③的化学方程式为:
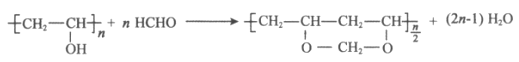
13. 25℃时,用一定浓度NaOH溶液滴定某醋酸溶液,混合溶液的导电能力变化曲线如图所示,其中b点为恰好反应点。下列说法不正确的是
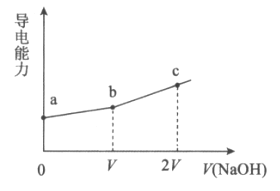
A. 溶液的导电能力与离子种类和浓度有关
B. b点溶液的pH=7
C. a→c过程中,n(CH3COO-)不断增大
D. c点的混合溶液中,c(Na+)>c(OH-)>c(CH3COO-)
14. 用下图所示装置及试剂进行铁的电化学腐蚀实验探究,测定具支锥形瓶中压强随时间变化关系以及溶解氧随时间变化关系的曲线如下。
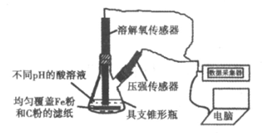
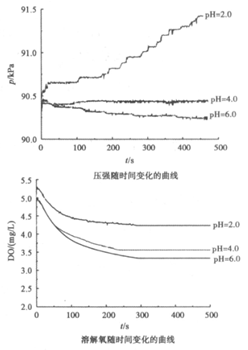
下列说法不正确的是
A. 压强增大主要是因为产生了H2
B. 整个过程中,负极电极反应式为Fe-2e-=Fe2+
C. pH=4.0时,不发生析氢腐蚀,只发生吸氧腐蚀
D. pH=2.0时,正极电极反应式为2H++2e-=H2↑和O2+4e-+4H+=2H2O
第二部分
本部分共5道题,共58分。
15. (8分)目前生物质能研究的方向之一是替代化石能源制备有机化工产品。
(1)化石原料合成丙烯腈(CH2=CH—CN):
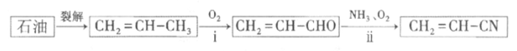
已知:
反应i:CH2=CH-CH3(g)+NH3(g)+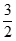 O2(g)→CH2=CH-CN(g)+3H2O(g)
O2(g)→CH2=CH-CN(g)+3H2O(g)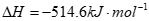
反应:CH2=CH-CH3(g)+O2(g)→CH2=CH-CHO(g)+H2O(g)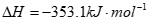
写出反应ii的热化学方程式:________________。
(2)生物质原料合成丙烯腈:
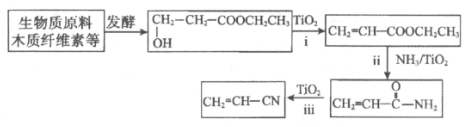
①写出ii的化学方程式:______________。
②丙烯腈与1,3-丁二烯共聚生产的丁腈橡胶是现代工业重要的橡胶。写出合成丁腈橡胶的化学方程式:_______________。
(3)生物质脂肪酸脱羧制备长链烷烃:H2气氛,TiO2/Pt为催化剂,光催化长链脂肪酸转化为长链烷烃机理示意图如下。
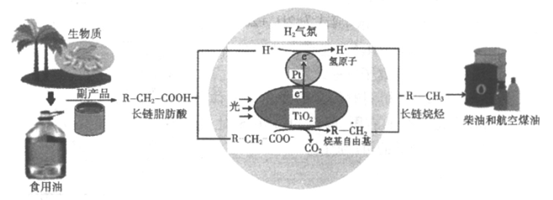
①油脂酸性水解可得高级脂肪酸和___________(写结构简式)。
②TiO2界面发生的电极反应式为_________________。
16. (10分)Na2S2O3应用广泛,水处理中常用作还原剂、冶金中常用作络合剂。
(1)Na2S2O3的实验室制法:装置图如下(加热和夹持装置略)。
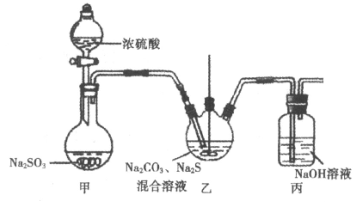
已知:2Na2S+3SO2=2Na2SO3+3S↓;Na2SO3+S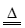 Na2S2O3
Na2S2O3
①甲中反应的化学方程式为_____________。
②实验过程中,乙中的溶液先变浑浊,后变澄清时生成大量的Na2S2O3。一段时间后,乙中再次出现少量浑浊,此时须立刻停止通入SO2。结合离子方程式解释此时必须立刻停止通入SO2的原因:_____________。
③丙中,NaOH溶液吸收的气体可能有_____________。
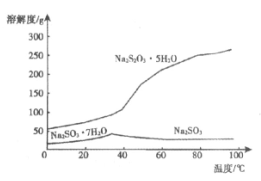
(2)实际工业生产中制得的Na2S2O3溶液中常混有少量Na2SO3,结合溶解度曲线(如图),获得Na2S2O3·5H2O的方法是_____________。
(3)Na2S2O3的用途:氨性硫代硫酸盐加热浸金是一种环境友好的黄金(Au)浸取工艺。
已知:Ⅰ. Cu(NH3)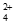
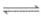 Cu2++4NH3;
Cu2++4NH3;
Ⅱ. Cu2+在碱性较强时受热会生成CuO沉淀。
①将金矿石浸泡在Na2S2O3、Cu(NH3)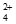 的混合溶液中,并通入O2。浸金反应的原理为:
的混合溶液中,并通入O2。浸金反应的原理为:
i. Cu(NH3)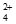 +Au+2S2O
+Au+2S2O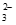
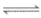 Cu(NH3)
Cu(NH3)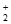 +Au(S2O3)
+Au(S2O3)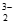 +2NH3
+2NH3
ii. 4Cu(NH3)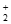 +8NH3+O2+2H2O=4Cu(NH3)
+8NH3+O2+2H2O=4Cu(NH3)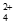 +4OH-
+4OH-
浸金过程Cu(NH3)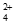 起到催化剂的作用,浸金总反应的离子方程式为:_____________。
起到催化剂的作用,浸金总反应的离子方程式为:_____________。
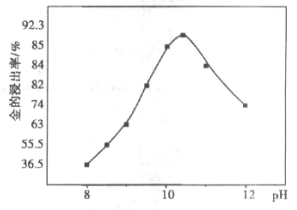
②一定温度下,相同时间金的浸出率随体系pH变化曲线如图,解释pH>10.5时,金的浸出率降低的可能原因:_____________。(写出2点即可)
17. (14分)抗肿瘤药物7-氟喹啉衍生物的前体Q的合成路线如下:
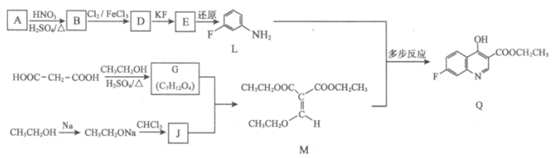
已知:R1ONa+R2Cl→R1OR2+NaCl(R1、R2代表烃基)
(1)A属于芳香烃,A的名称是_____________。
(2)B→D的化学方程式是_____________。
(3)D→E的反应类型是_____________。
(4)G的结构简式是_____________。
(5)下列关于M的说法正确的是_____________(填序号)
a. M含有两种不同的官能团 b. M存在顺反异构体
c. M和G能用Br2的CCl4溶液鉴别 d. M能与NaOH溶液反应
(6)已知:G+J→M+2CH3CH2OH。J的结构简式是_____________。
(7)L与M反应生成Q的过程如下:
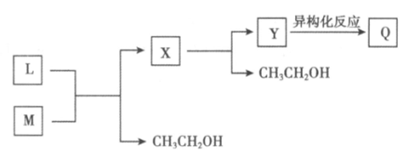
已知:上述异构化反应中,只存在氢原子和不饱和键的位置变化。
Y的分子中含有两个六元环。Y的结构简式是_____________。
18. (12分)无水氯化锰(MnCl2)在电子技术和精细化工领域有重要应用。一种由粗锰粉(主要杂质为Fe、Ni、Pb等金属单质)制备无水氯化锰的工艺如下(部分操作和条件略)。
Ⅰ. 向粗锰粉中加入盐酸,控制溶液的pH约为5,测定离子的初始浓度。静置一段时间后锰粉仍略有剩余,过滤;
Ⅱ. 向Ⅰ的滤液中加入一定量盐酸,再加入H2O2溶液,充分反应后加入MnCO3固体调节溶液的pH约为5,过滤;
Ⅲ. 向Ⅱ的滤液中通入H2S气体,待充分反应后加热一段时间,冷却后过滤;
Ⅳ. 浓缩、结晶、过滤、洗涤、脱水得到无水MnCl2。
各步骤中对杂质离子的去除情况
Fe2+ | Ni2+ | Pb2+ | |
初始浓度/mg·L-1 | 21.02 | 4.95 | 5.86 |
步骤Ⅰ后/mg·L-1 | 12.85 | 3.80 | 3.39 |
步骤Ⅱ后/mg·L-1 | 0.25 | 3.76 | 3.38 |
步骤Ⅲ后/mg·L-1 | 0.10(达标) | 3.19(未达标) | 0.12(达标) |
已知:金属活动性Mn>Fe>Ni>Pb
(1)锰和盐酸反应的化学方程式是_____________。
(2)步骤Ⅰ中:
①Fe2+浓度降低,滤渣中存在Fe(OH)3。结合离子方程式解释原因:_____________。
②Pb2+浓度降低,分析步骤Ⅰ中发生的反应为:Pb+2H+=Pb2++H2↑、_____________。
(3)步骤Ⅱ中:
①H2O2酸性溶液的作用:_____________。
②结合离子方程式说明:MnCO3的作用:_____________。
(4)步骤Ⅲ通入H2S后,Ni2+不达标而Pb2+达标。推测溶解度:PbS_________NiS(填”>”或”<“)。
(5)测定无水MnCl2的含量:将ag样品溶于一定量硫酸和磷酸的混合溶液中,加入稍过量NH4NO3,使Mn2+氧化为Mn3+。待充分反应后持续加热一段时间,冷却后用b mol·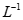 硫酸亚铁铵[(NH4)2Fe(SO4)2]滴定Mn3+,消耗c mL硫酸亚铁铵。
硫酸亚铁铵[(NH4)2Fe(SO4)2]滴定Mn3+,消耗c mL硫酸亚铁铵。
(已知:滴定过程中发生的反应为Fe2++Mn3+=Fe3++Mn2+)
①样品中MnCl2的质量分数是_____________(已知:MnCl2的摩尔质量是126g·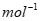 )。
)。
②”持续加热”的目的是使过量的NH4NO3分解。若不加热,测定结果会_____________(填”偏高”、”偏低”或”无影响”)。
19. (14分)学习小组探究AgNO3、Ag2O(棕黑色固体,难溶于水)对氯水漂白性的影响。
实验记录如下:
| 实验 | 方案和现象 |
i | 加入1mL蒸馏水,再滴加1滴品红溶液,品红溶液较快褪色 | |
ii | 加入少量Ag2O固体,产生白色沉淀a。再加入1mL蒸馏水和1滴品红溶液,品红溶液褪色比i快 | |
iii | 加入1mL较浓AgNO3溶液,产生白色沉淀b。再滴加1滴品红溶液,品红溶液褪色比i慢 |
(1)用离子方程式表示i中品红溶液褪色的原因:_____________。
(2)经检验,ii中的白色沉淀a是AgCl。产生AgCl的化学方程式是_____________。
(3)i是iii的对比实验,目的是排除iii中_____________造成的影响。
(4)研究白色沉淀b的成分。进行实验iv(按实验iii的方案再次得到白色沉淀b,过滤、洗涤,置于试管中):
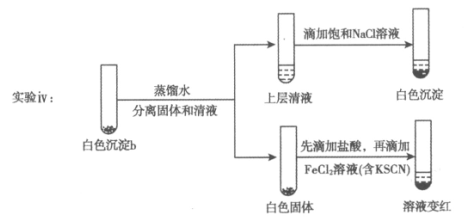
①设计对比实验证实白色沉淀b不只含有AgCl,实验方案和现象是_____________。
②FeCl2溶液的作用是_____________。
由此判断,白色沉淀b可能含有AgClO。
(5)进一步研究白色沉淀b和实验iii品红溶液褪色慢的原因,进行实验V:
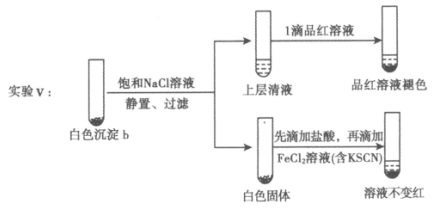
①结合离子方程式解释加入饱和Nacl溶液的目的:_____________。
②推测品红溶液褪色的速率:实验iii比实验V__________(填”快”或”慢”)。
【试题答案】
第一部分
每小题只有一个选项符合题意。14个小题,每小题3分,共42分
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
答案 | C | A | B | A | B | C | B | C | D | C |
题号 | 11 | 12 | 13 | 14 | ||||||
答案 | D | D | B | C |
第二部分
15. (8分)
(1)CH2=CH-CHO(g)+NH3(g)+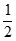 O2(g)=CH2=CH-CN(g)+2H2O(g)
O2(g)=CH2=CH-CN(g)+2H2O(g)
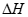 =-161.5kJ·mol-1
=-161.5kJ·mol-1
(2)①CH2=CH-COOCH2CH3+NH3
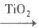 CH2=
CH2=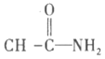 +CH3CH2OH
+CH3CH2OH
②nCH2=CH-CH=CH2+nCH2=CH-CN
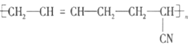

②RCH2COO--e-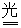 RCH2+CO2↑
RCH2+CO2↑
16.(10分)
(1)①Na2SO3+H2SO4=Na2SO4+SO2↑+H2O
②过量的SO2使溶液酸性增强,S2O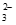 +2H+=S↓+SO2↑+H2O
+2H+=S↓+SO2↑+H2O
③SO2(H2S)、CO2
(2)将溶液蒸发浓缩、趁热过滤、降温结晶、过滤。
(3)①4Au+8S2O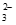 +O2+2H2O=4Au(S2O3)
+O2+2H2O=4Au(S2O3)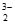 +4OH-
+4OH-
②碱性较强时生成的CuO沉淀覆盖在金矿石表面,降低(浸出)反应速率;
pH>10.5时,部分Cu(NH3)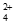 转化成CuO,使c[Cu(NH3)
转化成CuO,使c[Cu(NH3)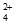 ]降低,降低(浸出)反应速率;
]降低,降低(浸出)反应速率;
碱性较强时氧气更易将S2O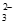 氧化,使c(S2O
氧化,使c(S2O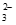 )降低,降低(浸出)反应速率。
)降低,降低(浸出)反应速率。
(其他答案合理给分)
17. (14分)
(1)苯
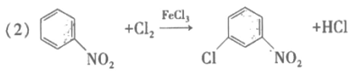
(3)取代反应
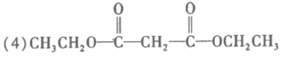
(5)c d
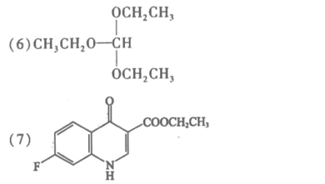
18.(12分)
(1)Mn+2HCl=MnCl2+H2↑
(2)①空气中的O2将部分Fe2+氧化为Fe(OH)3沉淀
4Fe2++O2+10H2O=4Fe(OH)3↓+8H+
②Pb2++Mn=Pb+Mn2+
(3)①将剩余Fe2+氧化为Fe3+
②调节pH使Fe3+转化为Fe(OH)3沉淀除去
MnCO3+2H+=Mn2++H2O+CO2↑
Fe3++3H2O  Fe(OH)3+3H+
Fe(OH)3+3H+
(4)<
(5)①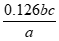
②偏高
19.(14分)
(1)Cl2+H2O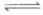 H++Cl-+HClO
H++Cl-+HClO
(2)Ag2O+2Cl2+H2O=2AgCl+2HClO
(3)稀释对溶液颜色
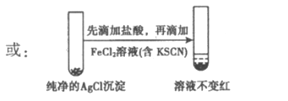
(4)①用纯净的AgCl沉淀代替白色沉淀b,先滴加盐酸,再滴加FeCl2溶液(含KSCN)后,溶液不变红。
(其他答案合理给分)
②检验白色沉淀b中是否含有氧化性粒子
(5)①AgClO(s)+Cl-(aq)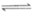 AgCl(s)+ClO-(aq),使白色沉淀b中的ClO-进入上层清液便于检测
AgCl(s)+ClO-(aq),使白色沉淀b中的ClO-进入上层清液便于检测
②慢