本试卷有两道大题,考试时长90分钟,满分100分。
可能用到的相对原子质量:H—1 C—12 N—14 O—16 Na—23 S—32 Cl—35.5 Fe—56 Cu—64
一、选择题(共25道小题,每小题2分,共50分。每小题只有1个选项符合题意)
1. 下列设备或物品工作时,将化学能转化为电能的是
A | B | C | D |
|
|
|
|
硅太阳能电池 | 干电池 | 燃气灶 | 太阳能集热器 |
2. 可再生能源和清洁能源将成为未来新能源的主力军,下列关于能源的叙述正确的是
A. 化石燃料是可再生能源 B. 风能、太阳能是清洁能源
C. 化石燃料都是清洁能源 D. 氢能是不可再生的清洁能源
3. 下列方法可以加快铁和稀硫酸的反应速率的是
A. 加入少量ZnSO4固体 B. 加入少量水
C. 加入少量CuSO4固体 D. 用98%的浓硫酸代替稀硫酸
4. 下列物质中,常温下可以用铁制容器盛装的是
A. 浓盐酸 B. 浓硫酸 C. 稀硝酸 D. 硫酸铜溶液
5. 一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质量的变化如图所示。对该反应的下列推断中合理的是
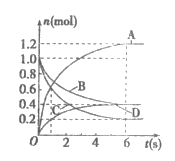
A. 该反应的化学方程式为3B+4D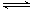 6A+2C
6A+2C
B. 反应进行到1s时,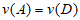
C. 反应进行到6s时,B的平均反应速率为0.05mol/(L·s)
D. 反应进行到6s时,各物质的反应速率相等
6. 化学与环境密切相关,下列有关说法正确的是
A. CO2属于大气污染物
B. 酸雨是pH小于7的雨水
C. CO2、NO2或SO2都会导致酸雨的形成
D. 含硫煤加入生石灰使用可以减少二氧化硫的排放
7. 氮、铁元素在细菌的作用下可发生如图所示的转化。下列说法正确的是
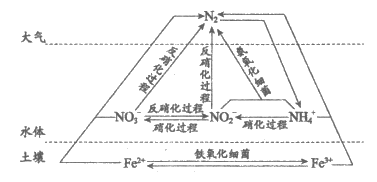
A. 反硝化过程均属于氮的固定
B. 硝化过程中,含氮物质均发生还原反应
C. 在氨氧化细菌作用下,水体中的氮元素可转移至大气中
D. Fe3+将NH4+转化为N2的离子方程式为Fe3++2NH4+=Fe2++N2↑+8H+
8. 下列离子方程式书写正确的是
A. 氢氧化钠溶液试剂瓶不用玻璃塞的原因:SiO2+2Na++2OH-=Na2SiO3+H2O
B. 氯化铁溶液中通入SO2溶液变为浅绿色:2Fe3++SO2+2H2O=2Fe2++SO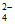 +4H+
+4H+
C. SO2和过量的NaOH溶液反应:SO2+OH-=HSO3-
D. 过量的Fe和稀硝酸反应:Fe+4H++NO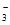 =Fe3++NO↑+2H2O
=Fe3++NO↑+2H2O
9. 合成氨及其相关工业中,部分物质间的转化关系如下:
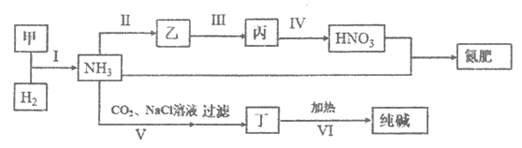
下列说法不正确的是
A. 甲、乙、丙三种物质都含有氮元素
B. 反应Ⅱ、Ⅲ和Ⅳ的氧化剂相同
C. 丁为NaHCO3
D. Ⅵ的其它产物可在上述流程中循环利用
10. 检验SO2气体中是否存在CO2,应采用的方法是
A. 先通过NaHCO3溶液,再通过石灰水 B. 通过澄清石灰水
C. 先通过足量酸性高锰酸钾溶液,再通过石灰水 D. 通过品红溶液
11. 一定温度下,反应H2(g)+I2(g)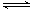 2HI(g)在密闭容器中进行,下列措施不改变化学反应速率的是
2HI(g)在密闭容器中进行,下列措施不改变化学反应速率的是
A. 压缩容器,增大压强 B. 恒容,充入H2
C. 恒压,充入氩气 D. 恒容,充入He
12. 下列关于化学反应限度的叙述中,正确的是
A. 任何化学反应的限度都相同
B. 改变温度可以调控化学反应限度
C. 延长反应时间可以改变化学反应限度
D. 当一个化学反应在一定条件下达到最大限度时,反应速率也最大
13. 最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下
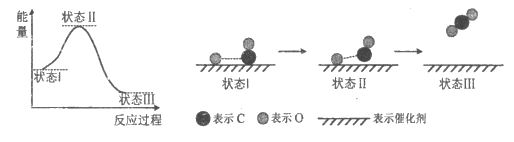
下列说法正确的是
A. CO和O生成CO2是吸热反应
B. 在该过程中,CO断键形成C和O
C. CO和O生成了具有极性共价键的CO2
D. 状态I→状态Ⅲ表示CO与O2反应的过程
14. 某种以30%KOH溶液为电解质的氢氧燃料电池的公共汽车已在北京街头出现。下列有关该燃料电池的说法中,正确的是
A. 供电时的总反应为:2H2+O2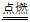 2H2O
2H2O
B. 负极的电极反应式为:2H2-24e-=4H+
C. H2和O2燃烧放出的热量转变为电能
D. 能量转化率高,产物是水,属于环境友好电池
15. 某温度下,在一固定容积的容器中进行反应:SO3(g)+NO(g)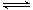 NO2(g)+SO2(g),下列情况一定能说明该反应已经达到化学平衡状态的是
NO2(g)+SO2(g),下列情况一定能说明该反应已经达到化学平衡状态的是
A. 气体的密度不随时间而改变
B. 体系总质量不随时间而改变
C. NO(g)和NO2(g)的生成速率相同
D. SO3(g)和NO(g)的浓度比为1:1
16. 在Fe、Cu的混合物中,加入一定量的稀硝酸并微热,充分反应后剩余金属ag,再向其中加入一定量的稀盐酸并加热,充分振荡后剩余金属bg。下列推断中正确的是
A. a可能等于b B. a一定小于b
C. 无法判断 D. a一定大于b
17. 除去粗盐中的杂质MgCl2、CaCl2和Na2SO4,过程如下:
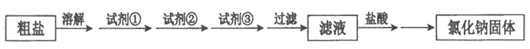
下列有关说法中,不正确的是
A. 试剂①、②、③分别是NaOH、Na2CO3、BaCl2
B. 除去Ca2+的主要反应:Ca2++CO32-=CaCO3↓
C. 检验SO42-是否除净的方法:取上层清液,加BaCl2溶液,观察是否产生沉淀
D. 加稀盐酸调节pH后,采用蒸发结晶的方法得到NaCl固体
18. 下列除杂试剂选用正确且除杂过程不涉及氧化还原反应的是
物质(括号内为杂质) | 除杂试剂 | |
A | FeCl2(FeCl3) | 铁粉 |
B | SiO2(Al2O3) | 盐酸 |
C | CO2(SO2) | 饱和碳酸钠溶液 |
D | NO(NO2) | 水、无水氯化钙 |
19.
下列关于硅及其化合物的说法正确的是
A. 硅在自然界中主要以单质形式存在
B. 太阳能电池板、光导纤维、玻璃的主要成分均为硅酸盐
C. 二氧化硅溶于氢氟酸,不属于酸性氧化物的通性
D. 利用碳高温下置换硅的反应,可以比较碳、硅的非金属性强弱
20. 研究人员最近发现了一种“水“电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl
下列关于“水“电池在海水中放电对的说法中正确的是
A. 正极反应式为Ag+Cl--e-=AgCl
B. 每生成1 molNa2Mn5O10转移2mol电子
C. Na+不断向“水“电池的负极移动
D. AgCl是还原产物
21. 下列事实描述不正确的是
A. 高温煅烧石灰石的反应中,反应物总能量高于生成物总能量
B. 中和反应中,反应物总能量高于生成物总能量
C. 镁条和盐酸反应时,溶液温度上升
D. 氢氧化钡晶体和氯化铵晶体的反应是吸热反应
22. 在标准状况下将3.20 g铜粉投入一定量浓HNO3中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由NO2和NO组成的混合气体1.344L,则混合气体中NO的体积为
A. 112 mL B. 1008 mL C. 224 mL D. 448 mL
23. 木炭与浓硫酸共热产生的气体X和铜与浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图所示装置),下列有关说法不正确的是
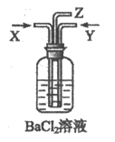
A. 洗气瓶中产生的沉淀是硫酸钡
B. Z导管出来的气体中有二氧化碳
C. 洗气瓶中产生的沉淀是碳酸钡
D. 在Z导管口可能有红棕色气体出现
24. 根据图示能量关系,下列说法不正确的是
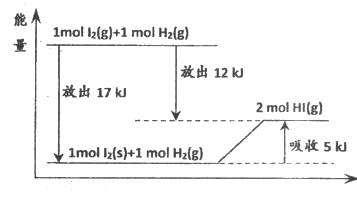
A. 1 mol I2(s)与1 mol H2(g)生成2 mol HI(g)时,需要吸收5 kJ的能量
B. 2 mol HI(g)分解生成l mol I2(g)与1 mol H2(g)时,需要吸收12 kJ的能量
C. 1 mol I2(s)变为l mol I2(g)时需要吸收17 kJ的能量
D. I2(g)与H2(g)生成HI(g)的反应是吸热反应
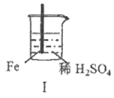
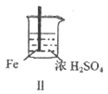
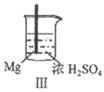
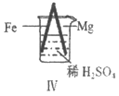
25. Fe、Mg与H2SO4反应的实验记录如下:
实验 |
|
|
|
|
现象 | Fe表面产生大量无色气泡 | Fe表面产生少量气泡后迅速停止 | Mg表面迅速产生大量气泡 | Fe表面有大量气泡,Mg表面有少量气泡 |
关于上述实验的说法不合理的是
A. Ⅰ中产生气体的原因是:Fe+2H+=Fe2++H2↑
B. Ⅱ中产生的气体与Ⅰ中相同
C. Ⅲ中现象说明Mg在浓H2SO4中没被钝化
D. Ⅳ中现象说明Mg的金属性比Fe强
二、解答题(共5道小题,共50分)
1. 某小组同学用如图所示装置探究金属锌与稀硫酸的反应,实验发现A中溶液温度升高,B中电流计指针发生偏转。
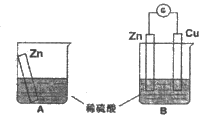
(1)A中反应的离子方程式为______________________。
(2)B中Cu板上的现象是____________,电极反应式为_____________。
(3)从能量转化的角度看,A、B中反应物的总能量____________(填“大于“、“小于“或“等于“)生成物总能量。A中化学能转变为______________,B中将化学能主要转变为______________。
(4)该小组同学反思原电池的原理,下述观点中正确的是___________(填字母序号)。
A. 原电池反应中一定有电子转移
B. 原电池装置需要2个电极
C. 电极一定不能参加反应
D. 氧化反应和还原反应分别在两极发生
2. 氨气在工农业生产中有重要应用。
(1)工业合成氨的化学方程式为_______________。
(2)某化学小组同学利用以下装置制备氨气,并探究氨气的性质(夹持仪器略)。
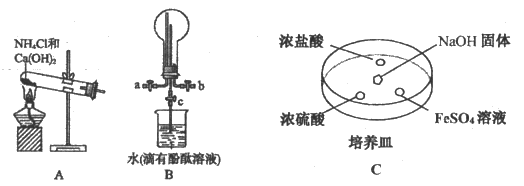
①实验室用装置A制备氨气的化学方程式为________________。
②用装置B收集氨时,进气口是___________(选填“a”或“b”)。打开装置B中的活塞c,烧瓶内产生了红色喷泉,则说明氨具有的性质是_______________,______________。
③向C中NaOH固体上滴几滴浓氨水,迅速盖上玻璃片,浓盐酸液滴附近会出现白烟,发生反应的化学方程式为_____________,检验白烟中阳离子的方法是_______________。FeSO4液滴中先出现灰绿色沉淀,过一段时间后变成红褐色,发生的反应有Fe2++2NH3·H2O=Fe(OH)2↓+2NH4+和_____________。
3. 汽车尾气中含有CO、NOx等有害气体。
(1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:______________________。
(2)汽车尾气中NO生成过程的能量变化示意图如下:
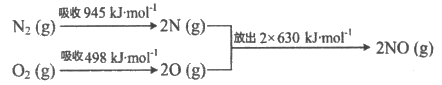
该条件下,N2和O2完全反应生成NO的热化学方程式为_____________________。
(3)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图所示:
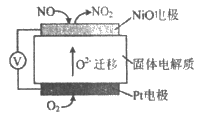
①NiO电极上发生的是__________反应(填“氧化“或“还原“)。
②外电路中,电子的流动方向是从___________电极流出(填NiO或Pt);Pt电极上的电极反应式为_______________。
(4)一种新型催化剂能使NO和CO发生反应:2NO+2CO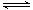 2CO2+N2。已知增大催化剂的比表面积可提高该反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下表中。
2CO2+N2。已知增大催化剂的比表面积可提高该反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下表中。
实验编号 | t(℃) | NO初始浓度 (mol/L) | CO初始浓度 (mol/L) | 催化剂的比表面积 (m2/g) |
Ⅰ | 280 | 1.20×10 | 5.80×10 | 82 |
Ⅱ | 280 | 1.20×10 | B | 124 |
Ⅲ | 350 | A | 5.80×10 | 82 |
①请将表中数据补充完整:A____________;B______________。
②能验证温度对化学反应速率影响规律的实验是____________(填实验序号)。
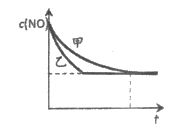
③实验Ⅰ和实验Ⅱ中,c(NO)随时间t的变化曲线如图所示,其中表示实验Ⅱ的曲线是___________(填“甲“或“乙“)。
4. 用如下方法回收废旧CPU中的单质Au(金)、Ag和Cu。
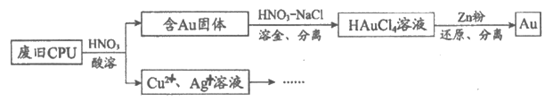
已知:①浓硝酸不能单独将Au溶解。
②HAuCl4=H++AuCl4。
(1)酸溶后经__________操作,将混合物分离。
(2)浓、稀HNO3均可作酸溶试剂。溶解等量的Cu消耗HNO3的物质的量不同,写出消耗HNO3物质的量少的反应的化学方程式:_____________________。
(3)HNO3-NaCl与王水[V(浓硝酸):V(浓盐酸)=1:3]溶金原理相同。
①将溶金反应的化学方程式补充完整:
Au+□NaCl+□HNO3=HAuCl4+□___________+□_________+□NaNO3
②关于溶金的下列说法正确的是___________。
A. 用到了HNO3的氧化性
B. 王水中浓盐酸的主要作用是增强溶液的酸性
C. 用浓盐酸与NaNO3也可使Au溶解
(4)若用Zn粉将溶液中的1 mol HAuCl4完全还原,则参加反应的Zn的物质的量是__________mol。
(5)用适当浓度的盐酸、NaCl溶液、氨水与铁粉,可按照如下方法从酸溶后的溶液中回收Cu和Ag(图中标注的试剂和物质均不同)。
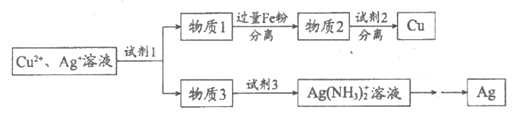
试剂1是_________,物质2是_________。
5. 甲、乙两同学为探究SO2与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)。
已知:浓硫酸在加热到340℃时会部分分解产生SO3
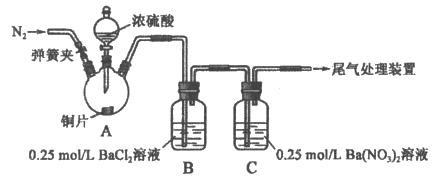
实验操作和现象:
操作 | 现象 |
关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中产生白色沉淀,液面上方略显浅棕色并逐渐消失 |
打开弹簧夹,通入N2,停止加热,一段时间后关闭 | |
从B、C中分别取少量白色沉淀,加稀盐酸 | 均未发现白色沉淀溶解 |
(1)A中反应的化学方程式是_________________。
(2)C中白色沉淀是_____________,该沉淀的生成表明SO2具有____________性。
(3)C中液面上方生成浅棕色气体的化学方程式是________________。
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应。
①为证实各自的观点,在原实验基础上:甲在原有操作之前增加一步操作,该操作是____________;乙在A、B间增加洗气瓶D,D中盛放的试剂是___________。
②进行实验,B中现象:甲中产生大量白色沉淀,乙中产生少量白色沉淀。检验白色沉淀,发现均不溶于稀盐酸。结合离子方程式解释实验现象异同的原因:___________________。
(5)合并(4)中两同学的方案进行实验。B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是_____________________。
【试题答案】
一、选择题(每小题2分,共50分)
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
B | B | C | B | C | D | C | B | B | C | D | B | C |
14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
D | C | D | A | B | C | B | A | D | C | D | B |
二、非选择题(共50分)
1. (8分)
(1)Zn+2H+=Zn2++H2↑
(2)有大量无色气泡产生 2H++2e-=H2↑
(3)大于
热能
电能
(4)ABD
2. (10分)
(1)N2+3H2
 2NH3
2NH3
(2)①2NH4Cl+Ca(OH)2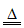 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
②a 极易溶于水
溶于水形成的溶液呈碱性
③NH3+HCl=NH4Cl 取少量白烟于试管中,加入氢氧化钠溶液,加热,将湿润的红色石蕊试纸放置试管口,变蓝。
4Fe(OH)2+O2+2H2O=4Fe(OH)3
3. (12分)
(1)3NO2+H2O=2HNO3+NO
(2)N2(g)+O2(g)=2NO(g)
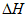 =+183kJ·mol
=+183kJ·mol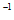
(3)①氧化
②NiO O2+4e-=2O2-
(4)①A. 1.20×10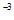 B. 5.80×10
B. 5.80×10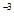
②Ⅰ和Ⅲ
③乙
4. (10分)
(1)过滤
(2)3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
(3)①Au+4NaCl+5HNO3=HAuCl4+NO↑+2H2O+4NaNO3
②AC
(4)2
(5)NaCl溶液 Cu、Fe
5. (10分)
(1)Cu+2H2SO4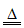 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(2)H2SO4
还原
(3)2NO+O2=2NO2
(4)④通N2一段时间,排除装置中的空气
饱和NaHSO3溶液
②甲:SO42-+Ba2+=BaSO4↓,乙:2Ba2++2SO2+O2+2H2O=2BaSO4↓+4H+
白雾的量远多于装置中O2的量
(5)SO2与可溶性钡的强酸盐不能反应生成BaSO3沉淀