1、本试卷分为Ⅰ卷、Ⅱ卷,共25个小题,满分100分;答题时间为90分钟;
2、可能用到的相对原子质量:H 1 O 16 Mg 24
Ⅰ卷
选择题(共42分)
(共21道小题,每小题只有一个选项符合题意,每小题2分。)
1. 2020年12月17日凌晨,嫦娥五号携带月壤等样本成功返回地球,完成中国探月工程的收官之战。下列说法不正确的是

A. 发射时使用液氢和液氧作推进剂,是利用了燃烧反应提供能量
B. 制造探测器中的瞄准镜时使用光导纤维,其主要成分是Si
C. “月壤“中含有珍贵的3He,3He与4He互为同位素
D. 留在月球的国旗长时间不褪色、不分解,是利用了材料的稳定性
2. 下列说法不正确的是
A. 热稳定性:H2S>PH3 B. 氧化性:Ba2+>Ca2+
C. 碱性:NaOH>Mg(OH)2 D. 酸性:H3PO4<HNO3
3. 中国化学会遴选了118名青年化学家作为“元素代言人“组成“中国青年化学家元素周期表“。元素Po(钋)与S同主族,由暨南大学陈填烽代言,其原子序数为84。下列说法正确的是
A. Po位于元素周期表的第4周期 B. 原子半径:Po<S
C. Po的电负性小于S D. PoO2只有还原性
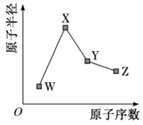
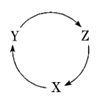
4. 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y原子的最外层电子数是其电子层数的3倍。下列说法正确的是
A. Y和Z的最高正化合价都等于原子的最外层电子数
B. 气态氢化物的热稳定:XH3<H2Y<H2Z
C. 原子半径的大小:r(W)>r(Z)>r(Y)
D. W的最高价氧化物对应水化物的酸性比Z的强
5. 根据物质的下列性质能肯定该物质为离子化合物的是
A. 水溶液能导电的化合物
B. 由金属元素和非金属元素组成的化合物
C. 在熔融状态下能导电的化合物
D. 熔点高的物质
6. 下列化合物既含离子键又含共价键的是
A. H2O2 B. H2S C. NH4Cl D. KBr
7. 下列有关化学用语表示正确的是
A. 某元素基态原子电子排布式:1s22s22p63s2sp63d54s1
B. 硫的原子结构示意图: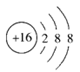
C. 溴化氯的电子式为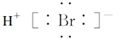
D. C和O形成CO2的过程: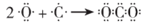
8. 下列事实不能由元素周期律作出解释的是
A. 钠和镁分别与冷水反应,前者反应更剧烈
B. H2S溶液久置于空气中,变浑浊
C. 一定条件下SiO2与焦炭反应,制得硅单质
D. F2和Cl2分别与H2反应,前者反应更容易
9. 下列说法中,不正确的是
A. 元素周期表有7个横行,分为7个周期
B. 元素周期表有18个纵行,分为16个族
C. 副族元素的价电子数等于副族序数
D. 主族元素的价电子就是最外层电子
10. 下列关于元素周期表应用的说法不正确的是
A. 为元素性质的系统研究提供指导,为新元素的发现提供线索
B. 在金属与非金属的交界处,可以寻找半导体材料
C. 在ⅠA、ⅡA族元素中,可以寻找耐高温、耐腐蚀的材料
D. 在过渡元素中,可以找到做催化剂的合金材料
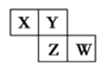
11. 下列各表中的数字代表的是原子序数,表中数字所表示的元素与它们在元素周期表中的位置相符的是
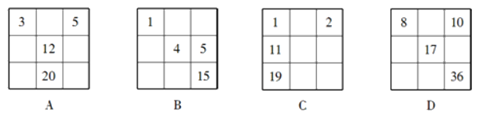
12. 下列说法正确的是
A. 热化学方程式中各物质前的化学计量数表示分子个数
B. 化学反应释放或吸收能量的多少与反应物或产物的量有关
C. 生成物的总焓(能量)大于反应物的总焓时,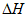 <0
<0
D. 需要加热的反应都是吸热反应
13. 物质发生化学反应时:①电子总数;②质子总数;③物质的结构;④分子总数;⑤物质所具有的总能量;⑥物质的总质量。反应前后肯定发生变化的是
A. ③⑥ B. ⑤⑥ C. ①② D. ③⑤
14. 关于如图的说法不正确的是
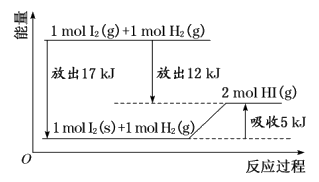
A. 1 mol固态碘与1mol H2化合生成2mol HI气体时,需要吸收5kJ的能量
B. 2 mol HI气体分解生成1 mol I2蒸气与1 mol H2时需要吸收12 kJ的能量
C. 1 mol固态I2变为1 mol I2蒸气时需要吸收17 kJ的能量
D. I2蒸气与H2生成HI气体的反应是吸热反应
15. 在25℃、101 kPa时,H2与O2化合生成1mol液态水时放热285.8kJ,下列相关热化学方程式中,正确的是
A. H2+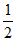 O2
O2
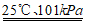 H2O
H2O 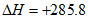 kJ/mol
kJ/mol
B. H2(g)+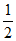 O2(g)=H2O(g)
O2(g)=H2O(g)
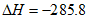 kJ/mol
kJ/mol
C. H2(g)+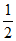 O2(g)=H2O(l)
O2(g)=H2O(l)
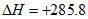 kJ/mol
kJ/mol
D. 2H2(g)+O2(g)=2H2O(l)
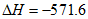 kJ/mol
kJ/mol
16. 几种短周期元素的原子半径及主要化合价如下表所示(已知Cl半径为100pm):
符号 | X | Y | Z | W |
原子半径/pm | 160 | 143 | 70 | 66 |
主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
下列说法中不正确的是
A. X、Y、Z、W元素都在元素周期表中p区
B. Z的最高价氧化物对应水化物与其简单氢化物能发生化合反应
C. Y的最高价氧化物对应水化物可以溶于KOH溶液
D. X单质可以与稀盐酸反应,放出大量的热
17. NA为阿伏加德罗常数的值。下列说法正确的是
A. 1 molH2O2中含有的极性共价键数为3NA
B. 2.4g镁在足量的氧气中燃烧,转移的电子数为0.1NA
C. 标准状况下,5.6L二氧化碳气体中含有的氧原子数为0.5NA
D. 1.8g重水(2H2O)中含有质子数为NA
18. 下列各组物质中,不能实现下图物质一步转化关系的选项是
选项 | X | Y | Z |
A | CO2 | Na2CO3 | NaHCO3 |
B | SO2 | SO3 | H2SO4 |
C | NO | NO2 | HNO3 |
D | Si | SiO2 | H2SiO3 |
19. 下列说法正确的是
A. s电子云是在空间各个方向上伸展程度相同的对称形状
B. p电子云是平面哑铃形
C. 2p能级有一个未成对电子的基态原子的电子排布式一定为1s22s22p5
D. 2d能级包含5个原子轨道,最多容纳10个电子
20. 下列说法中不正确的是
A. 1s22s12p1表示的是激发态原子的电子排布
B. 某含多个电子的原子能级能量大小为:E(4f)>E(4d)>E(4p)
C. 同一原子中,1s、2s、3s电子的能量逐渐增大
D. 同一原子中,2p、3p、4p能级的轨道数依次增多
21. 下列叙述的基态原子电子排布式,一定是主族元素的是
A. 价电子中有3个单电子
B. 最外层有1个单电子
C. 最外层有3个电子
D. 价电子中无单电子
Ⅱ卷
非选择题(共58分)
22.(14分)某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
Ⅰ:(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:①_____________与盐酸反应最剧烈,②_____________与盐酸反应产生的气体最多,实验结果_____________(此空填“①“或“②“)能得出金属性强弱
(2)向Na2S溶液中通入氯气出现黄色浑浊,反应的离子方程式为__________________。可证明非金属性:Cl___________S(填“>”或“<“),从原子结构角度解释原因__________________________。
Ⅱ:利用如图装置可验证同主族元素非金属性的变化规律。
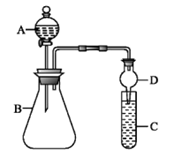
(3)仪器A的名称为_____________。
(4)若要证明非金属性:Cl>I,C中为淀粉碘化钾混合溶液,B中装有KMnO4固体,则A中试剂为_____________,观察到C中溶液变为蓝色,即可证明非金属性:Cl>I。从环境保护的角度考虑,此装置缺少尾气处理装置,可用_____________(写试剂)吸收尾气。
(5)若要证明非金属性是N>C>Si,则在A中加稀硝酸、B中加CaCO3、C中加Na2SiO3溶液。观察到_______________________________________(填现象),即可证明。但有的同学认为硝酸具有挥发性,HNO3可进入C中干扰实验,应在两装置间添加装有_____________溶液的洗气瓶除去HNO3。
23.(15分)海水中含有大量的资源。
Ⅰ:查阅资料:Br2的沸点为58.8℃,密度为3.119g·cm-3,微溶于水,易挥发,有毒。
工业生产中,海水提取溴常用空气吹出法。其生产流程可用下图表示:
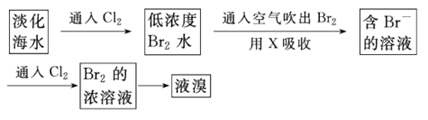
某化学实验小组模拟该法设计了如下实验装置(夹持装置略去)从浓缩的海水中提取液溴。
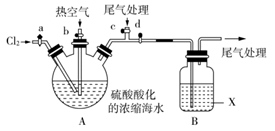
实验步骤如下:
①关闭活塞b、d;打开活塞a、c,向A中缓慢通入Cl2至反应结束;
②关闭a、c,打开b、d,向A中鼓入足量热空气;
③关闭b,打开a,再通过A向B中通入足量的Cl2,得到Br2的产率接近100%;
④将B中所得液体进行蒸馏,收集液溴。
(1)步骤①中反应的离子方程式为_______________________________________。
(2)当观察到A中液面上方出现_____________(实验现象)即可判断步骤①中反应已经结束。
(3)步骤②中,利用了Br2__________________________的性质。
(4)本实验中X试剂可以是_____________(填序号)。
a. H2O b. 饱和食盐水 c. 氢氧化钠溶液 d. 饱和Na2SO3溶液
X试剂吸收溴单质的离子方程式为__________________________。
Ⅱ:海洋生物中含有大量碘元素。海带提碘的流程如下。
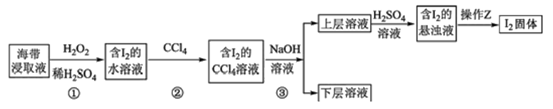
(5)写出步骤①的离子方程式:__________________________。
(6)步骤②的实验操作名称是__________________________。
(7)步骤③中,得到的下层溶液为无色。已知该反应中,氧化产物和还原产物的物质的量比为1:5。请写出离子方程式__________________________。
(8)操作Z为_____________。实验中也可以在合适的条件下分离第②步后得到的I2的CCl4溶液,直接得到I2和CCl4。该分离方法为__________________________。
24.(14分)已知W、X、Y、Z、A、B是五种短周期主族元素,部分原子的原子半径及相关信息如下表所示:
元素 | 相关信息 | 原子半径关系 |
W | 其中一种核素的质量数为18,中子数为10 |
|
X | 第一电离能(I1)在同周期元素中最小 | |
Y | 单质是一种常见的半导体材料 | |
Z | 电负性在同周期元素中最大 | |
A | M层有3个单电子 | |
B | 玻尔成功的解释了其原子光谱,获得了诺贝尔奖 | |
(1)Y元素在元素周期表中的位置是_____________,W元素基态原子的电子排布式和价电子的轨道表示式为__________________________。
(2)W与X以原子个数比1:1形成一种淡黄色化合物,其电子式为_________________,含有的化学键类型为__________________________。
(3)W、X、Z的简单离子半径由大到小的顺序为__________________________(用离子符号表示)。
(4)A和Z的最高价氧化物对应水化物的酸性强弱为_____________(用化学式表示)。
(5)X、Z可以形成化合物,用电子式表示该化合物的形成过程__________________________。
(6)同一周期从左到右,元素第一电离能(I1)有增大的趋势,但是Al的第一电离能小于Mg,原因是_____________(填序号)。
a. Al的价电子为3s23p1,较易失去3p电子,形成较稳定全满结构3s2,故I1较小
b. Mg的价电子为3s2,是较稳定的全满结构,较难失去电子,故I1较大
(7)已知化学键的键能是指断开1mol化学键时吸收的能量。依据表中数据(25℃、101 kPa)
计算,2B2(g)+W2(g)=2B2W(g)
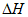 =__________。
=__________。
键 | W=W | W—B | B—B |
键能/(kJ·mol-1) | 498 | 463 | 436 |
25.(15分)某实验小组探究少量Cl2和FeBr2反应的过程。
已知:实验中的KSCN溶液均加入1滴。
(1)配制1.0mol/L的FeBr2溶液(pH=3),该溶液呈淡黄色。
实验1:
取1 mL此溶液,向其中滴入KSCN溶液,变为浅红色。
此FeBr2溶液呈淡黄色的原因是其中含有_____________,用离子方程式解释产生其原因:__________________________。
(2)实验2:
少量氯气和FeBr2反应实验操作及现象如下:
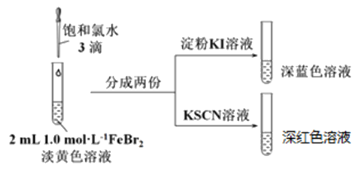
据此甲同学得出结论:少量Cl2既能和Fe2+又能和Br-发生氧化还原反应。
①Cl2和Fe2+发生反应的离子方程式是__________________________。甲同学能得出Cl2和Fe2+发生反应的实验依据是__________________________。
②乙同学认为上述实验不能由”蓝色溶液”证明Cl2和Br-发生反应,结合离子方程式解释原因__________________________。
(3)实验3:
乙同学取1.0 mol/L的FeBr2溶液2 mL,向其中滴加3滴饱和氯水后,再加入CCl4,振荡后静置,观察现象。乙得出结论:少量Cl2只与Fe2+反应,不与Br-反应。乙得出该结论依据的实验现象是__________________________。
(4)丙同学继续设计实验,探究反应过程:
实验4:
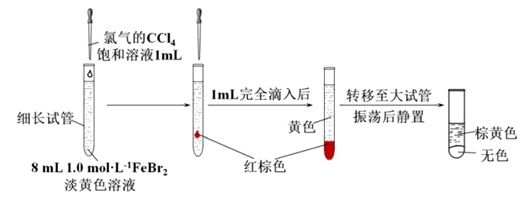
①转移到大试管前CCl4液体中呈红棕色的物质是_____________。
②丙通过此实验可得出结论:__________________________。
③丙同学用Fe粉和HBr溶液重新配置1.0mol/L FeBr2溶液,使铁粉有剩余,取上清液100 mL,将标况下2.24LCl2缓慢通入该溶液中,充分反应,离子方程式为__________________(用一个反应表示)。
【试题答案】
Ⅰ卷
选择题
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
答案 | B | B | C | D | C | C | A | C | C | C | D |
题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | |
答案 | B | D | D | D | A | C | D | A | D | C |
Ⅱ卷
非选择题
22.(14分)
Ⅰ.(1)钾
铝
①
(2)Cl2+S2-=S↓+2Cl-(2分)
>
Cl和S电子层数相同,Cl的质子数更大,原子半径更小,得电子能力更强,非金属性更强。(2分)
Ⅱ. (3)分液漏斗
(4)浓盐酸 NaOH溶液
(5)B中产生大量无色气泡,C中产生白色沉淀
(2分)
饱和NaHCO3
23.(15分)
Ⅰ. (1)Cl2+2Br-=2Cl-+Br2(2分)
(2)黄绿色
(3)微溶于水,易挥发
(4)d Br2+SO32-+H2O=SO42-+2Br-+2H+(写了此反应即给2分)
Ⅱ. (5)2I-+2H++H2O2=I2+2H2O(2分)
(6)萃取分液(2分)
(7)3I2+6OH-=IO3-+5I-+3H2O(2分)
(8)过渡
蒸馏
24.(14分)
(1)第3周期
ⅣA族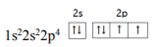
(2)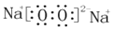
离子键,非极性键(共价键也给分)
(3)Cl->O2->Na+
(4)HClO4>H3PO4
(5)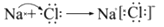 (2分)
(2分)
(6)ab(2分)
(7)-482kJ/mol
25.(15分)
(1)Fe3+(1分) 4Fe2++O2+4H+=4Fe3++2H2O
(2)①Cl2+2Fe2+=2Cl-+2Fe3+,实验1中加入KSCNaq后,溶液呈浅红色,实验2中加入KSCNaq后,溶液呈深红色
②溶液中含有Fe3+,2Fe3++2I-=2I2+2Fe2+,也能使淀粉变蓝,不一定是Br2氧化出的I2。
(3)静置后,上层溶液为黄色,下层溶液无色(1分)
(4)①Br2(1分)
②少量Cl2能与Br-反应,生成的Br2会继续氧化溶液中的Fe2+
③2Cl2+2Fe2++2Br-=4Cl-+2Fe3++Br2