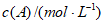(试卷满分为100分,考试时间为90分钟)
Ⅰ卷 选择题
一、选择题(每小题只有1个选项符合题意,每小题3分,共42分)
1. 用下图所示装置及药品进行相应实验,能达到实验目的的是( )
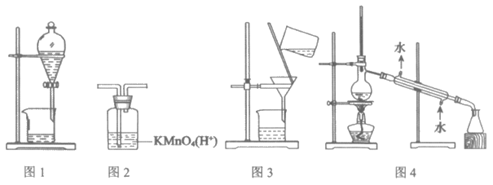
A. 图1分离乙醇和乙酸 B. 图2除去乙炔中的乙烯
C. 图3除去溴苯中的溴单质 D. 图4除去工业酒精中的甲醇
2. 下列有关物质水解的说法正确的是( )
A. 纤维素不能水解成葡萄糖 B. 油脂水解产物之一是甘油
C. 蛋白质水解的最终产物是多肽 D. 蔗糖水解产物仅有葡萄糖
3. 元素铬(Cr)的几种化合物存在下列转化关系:

已知:2CrO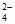 +2H+
+2H+ Cr2O
Cr2O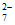 +H2O。下列判断不正确的是( )
+H2O。下列判断不正确的是( )
A. 反应①表明Cr2O3有酸性氧化物的性质
B. 反应②利用了H2O2的氧化性
C. 反应③中溶液颜色变化是由化学平衡移动引起的
D. 反应①②③中铬元素的化合价均发生了变化
4. 白屈菜有止痛、止咳等功效,从其中提取的白屈菜酸的结构简式如图。下列有关白屈菜酸的说法中,不正确的是( )
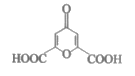
A. 分子式是C7H4O6 B. 能发生加成反应
C. 能发生水解反应 D. 能发生缩聚反应
5. 某同学制作的燃料电池示意图如下,先闭合K1接通电源一段时间后,再断开K1、闭合K2时,电流表指针偏转。下列分析正确的是( )
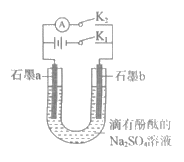
A. 闭合K1时,Na2SO4开始电离
B. 闭合K1时,石墨a附近溶液逐渐变红
C. 断开K1、闭合K2时,石墨a附近溶液酸性逐渐减弱
D. 断开K1、闭合K2时,石墨b极上发生反应:H2-2e-=2H+
6. 工业上消除氮氧化物的污染,可用如下反应:( )
CH4(g)+2NO2(g)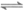 N2(g)+CO2(g)+2H2O(g)
N2(g)+CO2(g)+2H2O(g)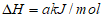
在温度T1和T2时,分别将0.50 mol CH4和1.2mol NO2充入体积为1L的密闭容器中,测得n(CH4)随时间变化数据如下表:
温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4) | 0.50 | 0.30 | 0.18 | …… | 0.15 |
下列说法不正确的是
A. 10min内,T1时v(CH4)比T2时小 B. 温度: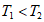
C. 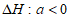 D. 平衡常数:
D. 平衡常数: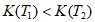
7. 用下列装置(加热和尾气处理装置略去)进行相关实验,能实现实验目的的是( )
实验目的 | a中试剂 | b中试剂 | c中试剂 | |
A | 比较H2CO3、苯酚的酸性 | 醋酸溶液 | 碳酸钠 | 苯酚钠溶液 |
B | 溴乙烷发生消去反应 | 溴乙烷 | NaOH醇溶液 | 溴水 |
C | 证明苯和液溴发生取代反应 | 苯和液溴 | 铁粉 | 硝酸银溶液 |
D | 证明C2H2有还原性 | 饱和食盐水 | 电石 | 酸性高锰酸钾溶液 |
8. 液体锌电池是一种电压较高的二次电池,具有成本低、安全性强、可循环使用等特点,其示意图如图。下列说法不正确的是( )
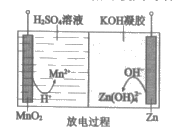
已知:①Zn(OH)2+2OH-=Zn(OH)42-。
②KOH凝胶中允许离子存在、生成或迁移。
A. 放电过程中,H+由正极向负极迁移
B. 放电过程中,正极的电极反应:MnO2+4H++2e-=Mn2++2H2O
C. 充电过程中,阴极的电极反应:Zn(OH)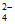 +2e-=Zn+4OH-
+2e-=Zn+4OH-
D. 充电过程中,凝胶中的KOH可再生
9. 某化工厂生产硝酸的流程如图1所示:其他条件相同时,装置③中催化剂铂网的成分、温度与氧化率的关系如图2所示。下列说法不正确的是( )
A. 该流程中,装置①③④中发生了氧化还原反应
B. 装置②中利用氨易液化的性质实现反应物和生成物的分离
C. 装置③中最佳反应条件是铂网成分为纯铂、温度为900℃
D. 装置④中通入过量空气可以提高硝酸的产率
10. 探究Na2O2与水的反应,实验如下:
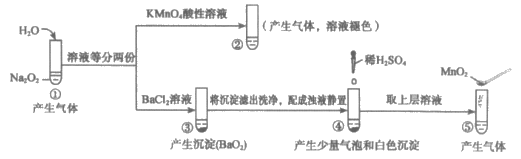
(已知:H2O2
 H++HO2-、HO2-
H++HO2-、HO2- H++O22-)
H++O22-)
下列分析不正确的是( )
A. ①、⑤中产生的气体能使带火星的木条复燃
B. 通过③能比较酸性:HCl>H2O2
C. ②、⑤中KMnO4与MnO2的作用不同,产生气体的量也不同
D. ①、④中均发生了氧化还原反应和复分解反应
11. 一种在工业生产中有广泛用途的有机高分子结构片段如下图。下列关于该高分子的说法正确的是( )
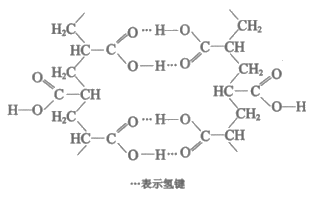
A. 能水解成小分子
B. 单体只含有一种官能团
C. 氢键对该高分子的性能没有影响
D. 结构简式为: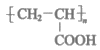
12. 反应A(g)+B(g) 3X在其他条件不变时,通过调节容器体积改变压强,达平衡时c(A)如下表:
3X在其他条件不变时,通过调节容器体积改变压强,达平衡时c(A)如下表:
平衡状态 | ① | ② | ③ |
容器体积/L | 40 | 20 | 1 |
| 0.022a | 0.05a | 0.75a |
下列分析不正确的是( )
A. ①→②的过程中平衡发生了逆向移动 B. ①→③的过程中X的状态发生了变化
C. ①→③的过程中A的转化率不断增大 D. 与①②相比,③中X的物质的量最大
13. 实验:
①0.005mol·L-1FeCl3溶液和0.015mol·L-1KSCN溶液各1mL混合得到红色溶液a,均分溶液a置于b、c两支试管中;
②向b中滴加3滴饱和FeCl3溶液,溶液颜色加深;
③再向上述b溶液中滴加3滴1mol·L-1 NaOH溶液,溶液颜色变浅且出现浑浊;
④向c中逐渐滴加1mol·L-1KSCN溶液2mL,溶液颜色先变深后变浅。
下列分析不正确的是( )
A. 实验②中增大Fe3+浓度使平衡Fe3++3SCN-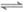 Fe(SCN)3正向移动
Fe(SCN)3正向移动
B. 实验③中发生反应:Fe3++3OH-=Fe(OH)3↓
C. 实验③和④中溶液颜色变浅的原因相同
D. 实验②、③、④均可说明浓度改变对平衡移动的影响
14. 在不同电压下用惰性电极电解饱和NaCl溶液制备少量NaClO,实验结果如下:
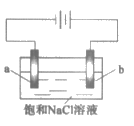
实验 | ① | ② | ③ |
电压 | U1 | U2 | U3 |
现象 | a极产生少量气泡,b极无明显气泡 | a极产生较多气泡,b极产生少量气泡 | a极产生大量气泡,b极逸出大量黄绿色气体 |
下列分析不正确的是( )
A. ①、②、③中,a极均发生了还原反应
B. ①、②、③中均能发生Cl2+2NaOH=NaCl+NaClO+H2O
C. 电解时OH-由b极向a极移动
D. 不宜采用实验③的电压制备NaClO
Ⅱ卷 填空题
二、填空题(5道大题,共58分)
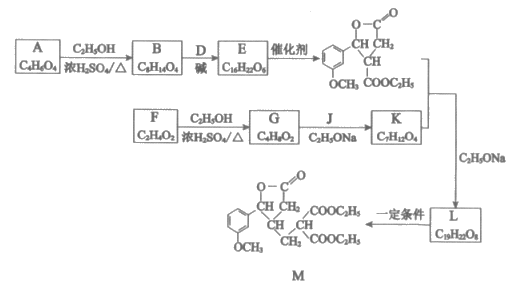
15. (11分)M是合成某药物的中间产物,其合成路线如下:
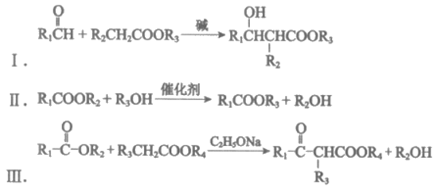
已知:
(1)A分子无支链,只含有一种官能团,官能团的名称是_______________。
(2)B→E的反应类型是_______________。
(3)D的结构简式是_______________。
(4)F→G的化学方程式是_______________。
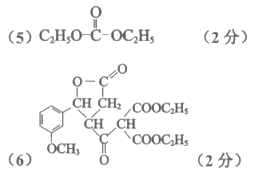
(5)已知J的分子式是C5H10O3,核磁共振氢谱有两个峰,峰面积比为2:3,且1mol J可与2mol NaOH溶液发生水解反应,J的结构简式是_______________。
(6)L的结构简式是_______________。
(7)L→M时,L发生了_______________(填”氧化”或”还原”)反应。
16. (14分)(1)Na2S2O5的制备
①生产Na2S2O5,通常是由NaHSO3过饱和溶液在一定条件下经结晶脱水制得。写出该过程的化学方程式_______________。
②制备Na2S2O5也可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3。
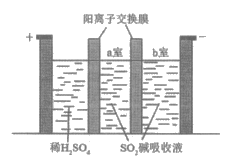
阳极的电极反应式为_______________。
电解后,__________室的NaHSO3浓度增加。将该室溶液进行结晶脱水,可得到Na2S2O5。
③Na2S2O5可用作食品的抗氧化剂,测定某葡萄酒中Na2S2O5残留量时,取葡萄酒样品,用碘标准液滴定至终点,滴定反应的离子方程式为_______________。
(2)可利用太阳能光伏电池电解水制高纯氢,工作示意图如下。通过控制开关连接K1或K2,可交替得到H2和O2。
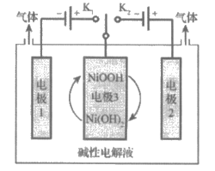
①制H2时,连接_______________,产生H2的电极反应式是_______________。
②改变开关连接方式,可得O2。
③结合①和②中电极3的电极反应式,说明电极3的作用:_______________。
17. (15分)KMnO4在实验室和工业上均有重要应用,其工业制备的部分工艺如下:
Ⅰ. 将软锰矿(主要成分MnO2)粉碎后,与KOH固体混合,通入空气充分焙烧,生成暗绿色熔融态物质。
Ⅱ. 冷却,将固体研细,用稀KOH溶液浸取,过滤,得暗绿色溶液。
Ⅲ. 向暗绿色溶液中通入CO2,溶液变为紫红色,同时生成黑色固体(MnO2)。
Ⅳ. 过滤,将紫红色溶液蒸发浓缩,冷却结晶,过滤,洗涤,干燥,得KMnO4固体。
资料:K2MnO4为暗绿色固体。在强碱性溶液中稳定,在近中性或酸性溶液中易发生歧化反应(Mn的化合价既升高又降低)。
(1)Ⅰ中,粉碎软锰矿的目的是_______________。
(2)Ⅰ中,生成K2MnO4的化学方程式是_______________。
(3)Ⅱ中,浸取时用稀KOH溶液的原因是_______________。
(4)Ⅲ中,CO2和K2MnO4在溶液中反应的化学方程式是_______________。
(5)将K2MnO4溶液采用惰性电极隔膜法电解,也可制得KMnO4。装置如下图:
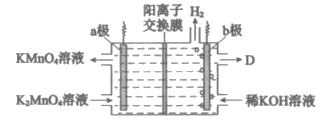
①b极是_________极(填”阳”或”阴”),D是_______________。
②结合电极反应式简述生成KMnO4的原理:_______________。
③传统无膜法电解时,锰元素利用率偏低,与之相比,用阳离子交换膜可以提高锰元素的利用率,其原因是_______________。
(6)用滴定法测定某高锰酸钾产品的纯度,步骤如下:
已知:Na2C2O4+H2SO4=H2C2O4+Na2SO4
5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O
摩尔质量:Na2C2O4 134g·mol-1 KMnO4 158g·mol-1
i. 称取ag产品,配成50mL溶液。
ii. 称取bg Na2C2O4,置于锥形瓶中,加蒸馏水使其溶解,再加入过量的硫酸。
iii. 将锥形瓶中溶液加热到75℃~80℃,恒温,用i中所配溶液滴定至终点,消耗溶液V mL(杂质不参与反应)。产品中KMnO4的质量分数的表达式为_______________。
18. (7分) 某小组同学以不同方案探究Cu粉与FeCl3溶液的反应。
(1)甲同学向FeCl3溶液中加入Cu粉,观察到溶液的颜色变为浅蓝色,由此证明发生了反应,其离子方程式是_______________。
(2)乙同学通过反应物的消耗证明了上述反应的发生:将Cu粉加入到滴有少量KSCN的FeCl3溶液中,观察到溶液红色褪去,有白色沉淀A产生。
①针对白色沉淀A,查阅资料:A可能为CuCl和CuSCN(其中硫元素的化合价为-2价)中的一种或两种。实验过程如下:
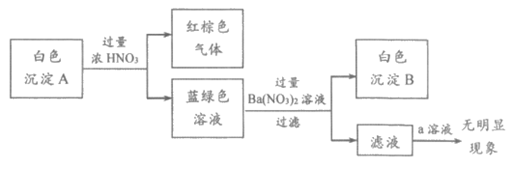
请回答:
Ⅰ. 根据白色沉淀B是____________(填化学式),判断沉淀A中一定存在CuSCN。
Ⅱ. 仅根据白色沉淀A与过量浓HNO3反应产生的实验现象,不能判断白色沉淀A中一定存在CuSCN,从氧化还原角度说明理由:_______________。
Ⅲ. 向滤液中加入a溶液后无明显现象,说明A不含CuCl,则a是_______________(填化学式)。
根据以上实验,证明A仅为CuSCN。
②进一步查阅资料并实验验证了CuSCN的成因,将该反应的方程式补充完整:
_______Cu2++_______SCN-=_______CuSNC↓+_______(SCN)2
③结合上述过程以及Fe(SCN)3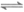 Fe3++3SCN一的平衡,分析(2)中溶液红色褪去的原因:_______________。
Fe3++3SCN一的平衡,分析(2)中溶液红色褪去的原因:_______________。
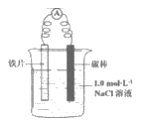
19. (11分)某小组同学利用下图所示装置进行铁的电化学腐蚀原理的探究实验:
装置 | 分别进行的操作 | 现象 |
| i. 连好装置一段时间后,向烧杯中清加酚酞 | __________________ |
ii. 连好装置一段时间后,向烧杯中滴加K3[Fe(CN)6]溶液 | 铁片表面产生蓝色沉淀 |
(1)小组同学认为以上两种检验方法,均能证明铁发生了吸氧腐蚀。
①实验i中的现象是_______________。
②用化学用语解释实验i中的现象:_______________。
(2)查阅资料:K3[Fe(CN)6]具有氧化性。
①据此有同学认为仅通过ii中现象不能证明铁发生了电化学腐蚀,理由是_______________。
②进行下列实验,在实验几分钟后的记录如下:
实验 | 滴管 | 试管 | 现象 |
| 0.5mol·L-1 K3[Fe(CN)6]溶液 | iii. 蒸馏水 | 无明显变化 |
iv. 1.0mol·L-1NaCl溶液 | 铁片表面产生大量蓝色沉淀 | ||
v. 0.5mol·L-1Na2SO4溶液 | 无明显变化 |
a. 以上实验表明:在_______________条件下,K3[Fe(CN)6]溶液可以与铁片发生反应。
b. 为探究Cl-的存在对反应的影响,小组同学将铁片酸洗(用稀硫酸浸泡后洗净)后再进行实验iii,发现铁片表面产生蓝色沉淀。此补充实验表明Cl-的作用是_______________。
(3)有同学认为上述实验仍不严谨。为进一步探究K3[Fe(CN)6]的氧化性对实验ii结果的影响,又利用(2)中装置继续实验。其中能证实以上影响确实存在的是____________(填字母序号)。
实验 | 试剂 | 现象 |
A | 酸洗后的铁片、K3[Fe(CN)6]溶液(已除O2) | 产生蓝色沉淀 |
B | 酸洗后的铁片、K3[Fe(CN)6]和NaCl混合溶液(未除O2) | 产生蓝色沉淀 |
C | 铁片、K3[Fe(CN)6]和NaCl混合溶液(已除O2) | 产生蓝色沉淀 |
D | 铁片、K3[Fe(CN)6]和盐酸混合溶液(已除O2) | 产生蓝色沉淀 |
(4)综合以上实验分析,利用实验ii中试剂,设计能证实铁发生了电化学腐蚀的实验方案_______________。
【试题答案】
一、选择题(每小题只有1个选项符合题意,每小题3分,共42分)
1. D 2. B 3. D 4. C 5. C 6. D 7. B 8. A 9. C 10. B
11. D 12. C 13. C 14. C
二、填空题(5道大题,共58分)
15. (11分)
(1)羧基(1分) (2)加成反应(1分)

(4)CH3COOH+CH3CH2OH  CH3COOC2H5+H2O(2分)
CH3COOC2H5+H2O(2分)
(7)还原(1分)
16. (14分)
(1)①2NaHSO3=Na2S2O5+H2O(2分)
②2H2O-4e-=4H++O2↑(2分) a(2分)
③S2O +2I2+3H2O=2SO
+2I2+3H2O=2SO +4I-+6H+(2分)
+4I-+6H+(2分)
(2)①K1(1分)
2H2O+2e-=H2↑+2OH-(1分)
③制H2时,电极3发生反应:Ni(OH)2+OH--e-=NiOOH+H2O。制O2时,上述电极反应逆向进行,使电极3得以循环使用(2分)
17. (15分)
(1)增大反应物接触面积,加快反应速率(1分)
(2)2MnO2+4KOH+O2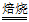 2K2MnO4+2H2O(2分)
2K2MnO4+2H2O(2分)
(3)保持溶液呈强碱性,防止K2MnO4发生歧化反应(2分)
(4)3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3(2分)
(5)①阴(1分) 较浓的KOH溶液(2分)
②a极:MnO42--e-=MnO4-,部分K+通过阳离子交换膜进入阴极区,阳极区生成KMnO4(2分)
③用阳离子交换膜可防止MnO4-、MnO42-在阴极被还原(1分)
(6)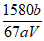 (2分)
(2分)
18.(7分)
(1)Cu+2Fe3+=Cu2++2Fe2+ (1分)
(2)①Ⅰ. BaSO4(1分)
Ⅱ. +1价铜也可将浓HNO3还原(1分)
Ⅲ. AgNO3(1分)
②2……4……2……1(1分)
③Cu和Fe3+反应生成Cu2+使c(Fe3+)减小;Cu2+和SCN-反应生成CuSCN沉淀使c(SCN-)减小,均使该平衡正向移动,导致Fe(SCN)3浓度减小,溶液红色褪去(2分)
19. (11分)
(1)①碳棒附近溶液变红(1分)
②O2+4e-+2H2O=4OH-(1分)
(2)①K3[Fe(CN)6]可能氧化Fe生成Fe2+,会干扰由于电化学腐蚀负极生成Fe2+的检验(2分)
②a. Cl-存在(1分)
b. Cl-破坏了铁片表面的氧化膜(2分)
(3)AC(2分)
(4)连好装置一段时间后,取铁片(负极)附近溶液于试管中,滴加K3[Fe(CN)6]溶液,若出现蓝色沉淀,则说明负极附近溶液中产生了Fe2+,即发生了电化学腐蚀(2分)