(试卷满分100分,考试时间为90分钟)
相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Cl-35.5
K-39 Ca-40 Cu-64 Ba-137
第I卷 选择题(共50分)
一、选择题(每小题只有1个选项符合题意,每小题2分,共50分)
1. 近年来,我国的一些沿海或沿海城市多次出现大雾天气,致使高速公路关闭,航班停飞。雾属于下列分散系中的
A. 溶液 B. 悬浊液 C. 乳浊液 D. 胶体
2. 氧化还原反应的实质是
A. 电子转移 B. 元素化合价变化
C. 氧元素参加反应 D. 原子重新组合
3. 在下列名词中,前者不包含后者的是
A. 混合物 溶液 B. 电解质 化合物
C. 氧化还原反应 置换反应 D. 化学反应 离子反应
4. 氧化还原反应广泛地存在于生产和生活之中。下列过程中不涉及氧化还原反应的是
A. 铁生锈 B. 燃放鞭炮 C. 食物的腐败 D. 豆浆制豆腐
5. 从氮元素的化合价判断,下列物质只能具有还原性的是
A. NH3 B. NO C. NO2 D. HNO3
6. 下列物质中属于强电解质且能导电的是
①氢氧化钠溶液 ②碳酸钙固体 ③铜 ④液态氯化氢 ⑤三氧化硫
⑥熔融氯化钠
A. ②⑤ B. ①③⑥ C. ④⑥ D. ⑥
7. 下列有关钠的叙述中,错误的是
A. 钠的还原性很强,可以用来冶炼金属钛、锆、铌等
B. 钠的化学性质非常活泼,钠元素只能以化合态存在于自然界
C. 钠是一种灰黑色的固体
D. 钠的质地软,可用小刀切割
8. 下列说法中正确的是
A. 烟、牛奶、淀粉溶液的分散质粒子直径均在1~100纳米
B. Fe(OH)3胶体不能通过滤纸
C. FeCl3溶液与Fe(OH)3胶体的本质区别是有无丁达尔效应
D. 向沸腾的NaOH溶液中滴加饱和FeCl3溶液,可获得Fe(OH)3胶体
9. 下列物质分类正确的是
A | B | C | D | |
酸 | HClO4 | 硫酸 | 醋酸 | 盐酸 |
碱 | 熟石灰 | 烧碱 | 纯碱 | NH3·H2O |
盐 | 小苏打 | 胆矾 | 碱式碳酸铜 | NaHSO4 |
氧化物 | 水 | NO | Al2O3 | KClO3 |
电解质 | C2H5OH | 液态HCl | NaCl溶液 | H2O |
10. 下列各组离子一定能大量共存的是
A. 在无色溶液中:NH4+、Fe2+、SO42-、CO32-
B. 在含大量Ca2+的溶液中:Fe3+、Na+、Cl–、OH–
C. 在强碱性溶液中:Na+、K+、Cl–、SO42-
D. 在pH=1的溶液中:K+、Na+、Cl–、CH3COO–
11. 下列各组物质在溶液中的反应,可用同一离子方程式表示的是
A. Cu(OH)2与盐酸 Cu(OH)2与醋酸
B. BaCl2溶液与Na2SO4溶液 Ba(OH)2溶液与CuSO4溶液
C. NaHCO3溶液与 NaHSO4溶液 Na2CO3溶液与NaHSO4溶液
D. Ca(HCO3)2溶液与硝酸溶液 NaHCO3溶液与盐酸溶液
12. 除去粗盐溶液中的Ca2+、Mg2+、SO42-等杂质,需依次加入稍过量的NaOH溶液、X溶液、Y溶液,过滤,最终滴加稀盐酸调至中性。其中X、Y分别是
A. Na2CO3 Ba(NO3)2 B. Na2CO3 AgNO3
C. Na2CO3 BaCl2 D. BaCl2 Na2CO3
13. 反应3I2+6KOH=5KI+KIO3+3H2O中,氧化剂与还原剂的质量之比是
A. 1:1 B. 1:5 C. 5:1 D. 3:2
14. 制备印刷线路板过程会产生含FeCl2、CuCl2等的废液。为了回收铜,并利用铜制备硫酸铜晶体,某化学课外小组设计方案中涉及如下两个反应:
①Fe+CuCl2=Cu+FeCl2 ②Cu+H2SO4+H2O2=CuSO4+2H2O
关于这两步反应叙述正确的是
A. CuCl2失电子是氧化剂 B. H2O2得电子是还原剂
C. H2SO4得电子是氧化剂 D. Fe失电子是还原剂
15. 吃饭时不宜同时大量食用海鲜(如虾、蟹、牡蛎等,其体内含有无毒的+5价的砷(As)元素)和某些蔬菜水果(如西红柿、土豆等,其体内富含维生素C),否则它们之间容易反应,生成剧毒的As2O3。下列叙述中,不正确的是
A. 维生素C能将+5价砷氧化成As2O3
B. 维生素C具有还原性
C. 维生素C在反应中作还原剂
D. 含砷物质发生了还原反应
16. 下列化学反应中水作氧化剂的是
A. Na2O2与水反应 B. 钠与水反应
C. Na2O与水反应 D. SO2与水反应
17. 根据下列化学方程式,判断有关物质的还原性强弱的顺序为
①I2+SO2+2H2O=H2SO4+2HI;②2FeCl2+Cl2=2FeCl3;
③2FeCl3+2HI=2FeCl2+ 2HCl2=I2
A. I–>Fe2+>Cl–>SO2
B. Cl–>Fe2+>SO2>I–
C. Fe2+>I–>Cl–>SO2
D. SO2>I–>Fe2+>Cl–
18. 下列叙述不正确的是
A. 溶解性:Na2CO3>NaHCO3
B. 热稳定性:Na2CO3>NaHCO3
C. 与足量稀盐酸反应: NaHCO3比Na2CO3更剧烈
D. 等质量的Na2CO3和NaHCO3分别与足量稀盐酸反应:Na2CO3比NaHCO3放出的CO2更多
19. 下列化学反应的离子方程式正确的是
A. 钠与水反应:Na+H2O=Na+OH–+H2
B. 向碳酸镁中滴加稀盐酸:CO32-+2H+=CO2↑+H2O
C. 用小苏打治疗胃酸过多:HCO3–+H+=CO2↑+H2O
D. 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH–=BaSO4↓+H2O
20. 为证明CuSO4溶液显蓝色与Cu2+有关而与SO42-无关,某同学设计了下列实验,其中对实验目的没有意义的是
①观察稀硫酸颜色 ②观察无水硫酸铜粉末颜色
③稀释CuSO4溶液,观察溶液蓝色变化 ④观察CuSO4·5H2O的颜色
⑤往CuSO4溶液中滴加足量BaCl2溶液,生成白色沉淀,过滤,观察滤液颜色变化
A. ①②④ B. ②③④ C. ②③⑤ D. ①④⑤
21. Cl2通入70℃的氢氧化钠水溶液中,能同时发生两个自身氧化还原反应(未配平):NaOH+Cl2→NaCl+NaClO+H2O,NaOH+Cl2→NaCl+NaClO3+H2O。反应完成后测得溶液中NaClO与NaClO3的数目之比为5:2,则该溶液中NaCl与NaClO的数目之比为
A. 3:1 B. 2:1 C. 15:7 D. 7:5
22. M2O7x-离子和S2-在酸性溶液中发生如下反应:
M2O7x-+3S2-+14H+=2M3++3S↓+7H2O,则M2O7x-离子中M的化合价是
A. +2 B. +3 C. +4 D. +6
23. 下列离子方程式中,正确的是
A. 石灰石与盐酸反应:CO32-+2H+=CO2↑+H2O
B. 铜和硝酸银溶液反应:Cu+Ag+=Cu2++Ag
C. 向NaHSO4溶液中滴加Ba(OH)2溶液至SO42-离子恰好沉淀完全:
Ba2++2OH–+2H++SO42-=BaSO4↓2H2O
D. NH4HCO3溶液与过量HCl溶液混合:HCO3–+H+=CO2↑+H2O
24. 为除去括号内的杂质,所选用的试剂或方法不正确的是
A. Na2CO3固体(NaHCO3),选用对固体加热的方法
B. NaHCO3溶液(Na2CO3),应通入足量的CO2气体
C. CO2(HCl),将混合气体通过足量的饱和NaHCO3溶液
D. Na2CO3溶液(Na2SO4),加入适量的Ba(OH)2溶液,过滤
25. 在2009年10月1日,新的饮用矿泉水强制性国家标准《饮用天然矿泉水》正式实施,其中”溴酸盐(BrO3–)”这一潜在致癌物质被做了严格限制。有关专家解释,矿泉水在开采过程中会含有少量溴化物(Br–),在后续的生产过程中经臭氧(O3)处理逐渐转化成溴酸盐。下列有关该转化过程的认识正确的是
A. 该过程中溴化物(Br–)得到电子
B. 该过程中臭氧(O3)是氧化剂,溴酸盐(BrO3–)是还原剂
C. 该过程中溴元素被氧化,O3中的氧元素被还原
D. 该过程中溴元素发生还原反应,O3中的氧元素发生氧化反应
第II卷 非选择题(共50分)
26. (10分)下图中A至F是化合物,
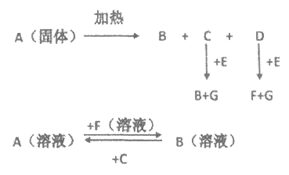
已知:C是CO2,G是单质
(1)判断下列物质的化学式为:
B_________、E_________。
(2)按照要求填空:
C与E反应的化学方程式: ____________________________________。
C与B溶液反应的离子方程式: ____________________________________。
(3)区别Na2CO3和K2CO3的实验方法是_____________________。
27. (6分)有5瓶损坏标签的溶液,分别盛有AgNO3、HNO3、盐酸、BaCl2、K2CO3,为了确定各瓶中是什么试剂,将它们任意编号为A、B、C、D、E,用小试管各盛少量多次进行两两混合反应,反应现象为:A与B、E产生沉淀,B与D、E产生沉淀,C、D与E产生气体,而C与D无反应现象。
(1)判断各试剂瓶中所盛试剂为
B________、D________。
(2)写出下面要求的离子方程式:
A与E:________________________________________________________。
C与E:________________________________________________________。
28. (5分)反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
(1)请将Au2O3之外的反应物与生成物分别填入以下空格内(不用配平)

(2)反应中,被还原的元素是___________。
29. (10分)下图所示为按树状分类法对一组物质进行的分类。回答下列问题
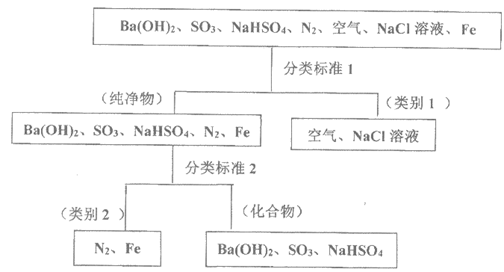
(1)分类标准2__________。
(2)上述物质中属于电解质的是_________,非电解质的是_________。
(3)向NaHSO4溶液中加Fe可产生气体,对应的离子方程式: _________。
(4)将NaHSO4溶液和Ba(OH)2溶液混合,恰好呈中性,对应的离子方程式为: _________。
30. (9分)化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如:
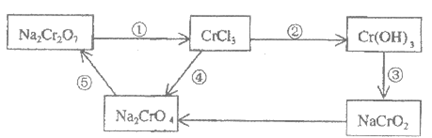
(1)在上述有编号的步骤中,需用还原剂的是________,需用氧化剂的是(填编号)________。
(2)完成并配平下列反应的化学方程式,按要求标出电子转移的方向和数目,并回答问题:
__Na2Cr2O7+__KI+__HCl——___CrCl3+__NaCl+__KCl+__I2+____
(用单线桥标出电子转移的方向和数目)
还原剂____________
31. (10分)某小组通过实验研究Na2O2与水的反应。
操作 | 现象 |
向盛有0. 2gNa2O2的烧杯中加入50mL蒸馏水 | 剧烈反应,产生能使带火星木条复燃的气体,得到的溶液a能产生丁达尔效应 |
向溶液a中滴入两滴酚酞 | i. 溶液变红 ii. 10分钟后溶液颜色明显变浅,稍后,溶液变为无色 |
(1)Na2O2与水反应的化学方程式是_______。
(2)ii中溶液褪色可能是溶液a中存在较多的H2O2,H2O2与酚酞发生了反应。
I. 甲同学通过实验证实了H2O2的存在:取少量溶液a,加入试剂_______(填化学式),有气体产生。
Ⅱ. 乙同学查阅资料获悉:用稀H2SO4酸化的KMnO4(被还原为Mn2+)
可以测定H2O2的含量,反应过程中会产生气体,则KMnO4与H2O2反应的离子方程式是________。
(3)为探究现象ii产生的原因,同学们继续进行了如下实验:
I. 向H2O2溶液中滴入两滴酚酞,振荡,加入5滴0. 1mol·L-1 NaOH溶液,溶液变红且产生气体,10分钟后溶液变无色,该过程无明显热效应。
Ⅱ. 向0.1 mol·L-1 NaOH溶液中滴入两滴酚酞,振荡,溶液变红,10分钟后溶液颜色无明显变化;向该溶液中通入氧气,溶液颜色无明显变化。
①从实验I和Ⅱ中,可得出的结论是________。
②同学们进一步通过实验证实了溶液a中滴入本分酚酞后,H2O2与酚酞发生了化学反应。实验方案是:取少量溶液a于试管中,________。
参考答案
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
D | A | B | D | A | D | C | A | B | C | D | D | C |
14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
D | A | B | D | D | C | B | A | D | D | D | C |
26. (10分)(1)B: Na2CO3 E: Na2O2
(2)2Na2O2+2CO2=2Na2CO3+O2↑
CO32-+CO2+H2O=2HCO3–
(3)焰色试验
27. (6分)(1)B:AgNO3(1分),D:盐酸(1分)
(2)Ba2++CO32-===BaCO3↓(2分)
CO32-+2H+=CO2↑+H2O(2分)
28. (5分)(1)Na2S2O3 H2O;Na2S4O6 AuO NaOH
(2)Au(+3价)
29. (10分)(1)元素种类(2分)
(2)NaHSO4、Ba(OH)2(2分);SO3(2分)
(3)Fe+2H+=Fe2++H2↑(2分)。
(4)2H++SO42-+Ba2++2OH–=BaSO4↓+2H2O (2)
30. (9分)
(1)①,④。
(2)
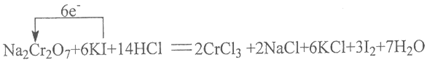
还原剂:KI
31. (10分)
(1)2Na2O2+2H2O=4NaOH+O2↑
(2)I. MnO2
Ⅱ. 2MnO4–+5H2O2+6H+=2Mn2++5O2↑+8H2O
(3)①碱性条件下,H2O2能与酚酞反应而O2不能
②加入MnO2,充分反应后,向上层清液中滴入2滴酚酞后变红,10分钟后溶液颜色无明显变化
