本试卷共100分。考试时长90分钟。
可能用到的相对原子质量:H 1 O 16 Cu 63.5
第一部分
本部分共14题,每题3分,共42分。在每题列出的四个选项中,选出最符合题目要求的一项。
1. 下列图示的混合物不属于胶体的是
|
|
|
|
A. 氯化钠注射液 | B. 云雾 | C. 稀豆浆 | D. 烟水晶 |
2. 糖类、油脂、蛋白质是重要的营养物质,下列说法正确的是
A. 糖类、油脂、蛋白质均可水解
B. 纤维素和淀粉互为同分异构体
C. 油脂属于酯类物质可发生皂化反应
D. NH4Cl溶液和CuSO4溶液均可使蛋白质变性
3. 化学与生产生活密切相关,下列说法不正确的是
A. 铁粉有还原性可作吸氧剂
B. 生石灰能与水反应可作干燥剂
C. 福尔马林能杀菌防腐可作食品保鲜剂
D. 明矾能水解形成胶体可作净水剂
4. 117号元素Ts的原子最外层电子数是7,下列说法不正确的是
A. Ts是第七周期第VIIA族元素
B. 还原性:I–<Ts–
C. 原子半径:I<Ts
D. 中子数为176的Ts的核素符号: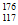 Ts
Ts
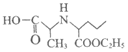
5. 蜂胶中某活性物质X的结构简式如下,下列关于X的说法正确的是
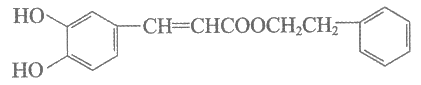
A. X不具有顺式和反式结构
B. X不能与浓溴水发生取代反应
C. 1 mol X最多能与2 mol NaOH反应
D. 一定条件下X可发生加聚反应
6. 下列化学用语的表述正确的是
A. 乙酸与乙醇的酯化反应:CH3COOH+C2H518OH CH3COOC2H5+H218O
CH3COOC2H5+H218O
B. 镁离子的结构示意图:
C. 二氧化碳分子的比例模型:
D. NaCl溶液导电:NaCl Na++Cl–
Na++Cl–
7. 下列说法不正确的是
A. 常温常压下,3.2 g O2和O3的混合气体中含有氧原子的数目约为0.2×6.02×1023
B. 1 L0.5 mol·L-1 CH3COONa溶液中含有CH3COOH和CH3COO–的总数约为0.5×6.02×1023
C. 标准状况下,1.12 LHCl气体中含有电子的数目约为0.9×6.02×1023
D. 0.1 mol环氧乙烷( )中含有共价键的总数约为0.3×6.02×1023
)中含有共价键的总数约为0.3×6.02×1023
8. 以氮气和水蒸气为原料,电化学合成氨装置(电极不参与反应)示意图如下。下列说法不正确的是
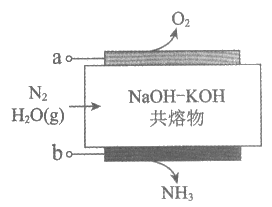
A. 电极a连接电源的正极
B. OH–向电极a迁移
C. 电极b的电极反应:N2+6e–+6H+=2NH3
D. 总反应:2N2+6H2O(g)  4NH3+3O2
4NH3+3O2
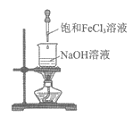
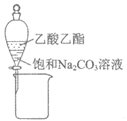
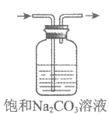
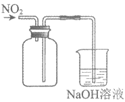
9. 下列实验装置(部分夹持装置已略去)可以达到对应实验目的的是
A | B | C | D | |
实验 目的 | 制备氢氧化铁胶体 | 分离乙酸乙酯和饱和Na2CO3溶液 | 除去CO2中的少量HCl | 收集NO2 |
实验 装置 |
|
|
|
|
10. 下列关于离子检验的说法不正确的是
A. 取某盐溶液加入浓NaOH溶液,加热,产生的气体可使湿润的红色石蕊试纸变蓝,该溶液中含有NH4+
B. 取某溶液滴加KSCN溶液,无明显现象,滴加氯水,溶液变红色,该溶液中含有Fe2+
C. 取某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液中一定含有SO42-
D. 取某无色溶液通入Cl2,再加入CCl4,振荡,静置,下层呈紫色,该溶液中一定含有I–
11. 处理某废水时,反应过程中部分离子浓度与反应进程关系如下图,反应过程中主要存在N2、HCO3–、ClO–、CNO–(C+4价,N-3价)、Cl–等微粒。下列说法不正确的是
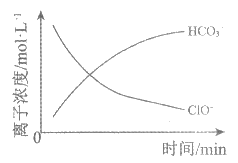
A. 该废水呈强酸性
B. 废水处理后转化为无害物质
C. 反应的离子方程式:3ClO–+2CNO–+H2O=N2+2HCO3–+3Cl–
D. 每处理1 mol CNO–转移3mol e–
12. CH4-CO2催化重整可以得到合成气(CO和H2),有利于减小温室效应,其主要反应为CH4(g)+CO2(g)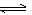 2CO(g)+2H2(g) △H=+247 kJ·mol-1
2CO(g)+2H2(g) △H=+247 kJ·mol-1
同时存在以下反应:
积碳反应:CH4(g)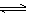 C(s)+2H2(g) △H=+75 kJ·mol-1
C(s)+2H2(g) △H=+75 kJ·mol-1
消碳反应:CO2(g)+C(s)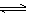 2CO(g) △H=+172 kJ·mol-1
2CO(g) △H=+172 kJ·mol-1
积碳会影响催化剂的活性,一定时间内积碳量和反应温度的关系如下图。
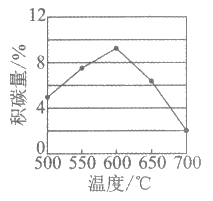
下列说法正确的是
A. 高压利于提高CH4的平衡转化率并减少积碳
B. 增大CO2与CH4的物质的量之比有助于减少积碳
C. 温度高于600℃,积碳反应的化学反应速率减慢,消碳反应的化学反应速率加快,积碳量减少
D. 升高温度,积碳反应的化学平衡常数K减小,消碳反应的K增大
13. 将镁条置于pH=8.4的饱和NaHCO3溶液中,镁条表面产生气体a,一段时间后产生白色沉淀b。继续进行如下实验:
I. 将a通过澄清石灰水,变浑浊,继而通过足量NaOH溶液,再通入肥皂液,出现气泡,点燃气泡听到爆鸣声;
II. 向沉淀b中加入足量的稀盐酸,沉淀完全溶解,且产生无色气泡。
下列说法不正确的是
A. 饱和NaHCO3溶液中,c(CO32-)<c(H2CO3)
B. 气体a中含有CO2和H2
C. 沉淀b是MgCO3
D. CO2可能是HCO3–水解被促进产生的
14. 探究甲醛与新制的Cu(OH)2的反应:
(1)向6 mL 6 mol·L-1 NaOH溶液中滴加8滴2% CuSO4溶液,振荡,加入0.5 mL 15%甲醛溶液,混合均匀,水浴加热,迅速产生红色沉淀,其周围剧烈产生无色气体。
(2)反应停止后分离出沉淀,将所得沉淀洗净后加入浓盐酸,不溶解。
(3)相同条件下,甲酸钠溶液与新制的Cu(OH)2反应,未观察到明显现象。
已知:Cu2O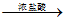 [CuCl2]–,甲醛是具有强还原性的气体。
[CuCl2]–,甲醛是具有强还原性的气体。
下列说法正确的是
A. 红色沉淀的主要成分不是Cu2O,可能是Cu
B. 将产生的无色气体通过灼热的CuO后得到红色固体,气体中一定含有CO
C. 从甲醛的结构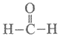 推测,其氧化产物可能为碳酸(
推测,其氧化产物可能为碳酸(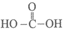 ),因此实验中得到的无色气体是CO2
),因此实验中得到的无色气体是CO2
D. 含有-CHO的有机物都可以被新制Cu(OH)2氧化
第二部分
本部分共5题,共58分。
15. (11分)某铜合金中Cu的质量分数为80%~90%,还含有Fe等。通常用间接碘量法测定其中Cu的含量,步骤如下:
I. 称取a g样品,加入稀H2SO4和H2O2溶液使其溶解,煮沸除去过量的H2O2,冷却后过滤,滤液定容于250 mL容量瓶中;
II. 取50.00 mL滤液于锥形瓶中,加入NH4F溶液,控制溶液pH为3~4,充分反应后,加入过量KI溶液,生成白色沉淀,溶液呈棕黄色;
III. 向II的锥形瓶中加入c mol·L-1 Na2S2O3溶液滴定,至锥形瓶中溶液为浅黄色时,加入少量淀粉溶液,继续滴至浅蓝色,再加入KSCN溶液,剧烈振荡后滴至终点;
IV. 平行测定三次,消耗Na2S2O3溶液的体积平均为v mL,计算铜的质量分数。
已知:i. F–与Fe3+生成稳定的FeF63-(无色)。
ii. I2在水中溶解度小,易挥发。
iii. I2+I–
– I3–(棕黄色)。
I3–(棕黄色)。
iv. I2+2Na2S2O3=2NaI+Na2S4O6(无色)。
(1)I中Cu溶解的离子方程式是___________。
(2)Ⅱ中Cu2+和I–反应生成CuI白色沉淀和I2。
①加入NH4F溶液的目的是___________。
②Cu2+和I–反应的离子方程式是_________。
③加入过量KI溶液的作用是__________。
(3)室温时,CuSCN的溶解度比CuI小。CuI沉淀表面易吸附I2和I3–,使测定结果不准确。III中,在滴定至终点前加入KSCN溶液的原因是________。
(4)样品中Cu的质量分数为_________(列出表达式)。
16. (8分)某炼锌厂利用含ZnO的烟尘脱除硫酸工艺烟气中的SO2制ZnSO4。
已知:I. ZnSO3·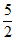 H2O微溶于水,ZnSO4易溶于水。
H2O微溶于水,ZnSO4易溶于水。
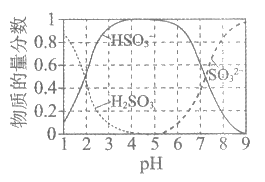
II. 25℃时,溶液中S(+4价)各组分的物质的量分数随pH变化曲线如下图。
III. O3为强氧化剂,1 mol O3被还原转移2 mol e–,同时生成1 mol O2。
(1)SO2造成的环境问题主要是_________。
(2)ZnO将SO2转化为ZnSO3·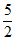 H2O的化学方程式是_________。
H2O的化学方程式是_________。
(3)将ZnSO3·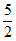 H2O悬浊液转化为ZnSO4时,因其被O2氧化的速率很慢,易造成管道堵塞,实验室模拟O3氧化解决该问题。初始时用盐酸将5%ZnSO3悬浊液调至pH=3.5,以一定的进气流量通入O3,研究O3氧化ZnSO3·
H2O悬浊液转化为ZnSO4时,因其被O2氧化的速率很慢,易造成管道堵塞,实验室模拟O3氧化解决该问题。初始时用盐酸将5%ZnSO3悬浊液调至pH=3.5,以一定的进气流量通入O3,研究O3氧化ZnSO3·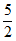 H2O,其中溶液pH随时间变化的曲线如下。
H2O,其中溶液pH随时间变化的曲线如下。
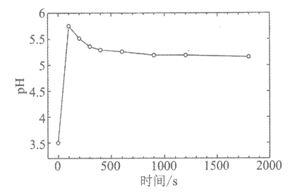
①pH=3.5的溶液中含S(+4价)的离子主要是________。
②一段时间后,溶液的pH减小,此过程中主要反应的离子方程式是_________。
③解释O3氧化可防止管道堵塞的原因:__________。
17. (10分)研究1,3-丁二烯和Br2以物质的量之比为1:1加成时的反应:
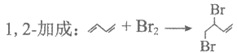 (产物A)
(产物A)
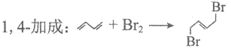 (产物B)
(产物B)
文献:I. 一般情况,在相同条件下,化学反应的活化能(E)越大,化学反应速率越小。
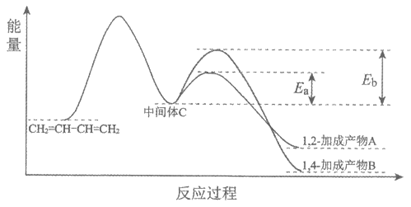
II. 1,3-丁二烯和Br2以物质的量之比为1:1加成时的反应过程和能量变化的示意图如下:
(1)已知: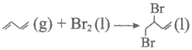 △H1=-a(a>0)kJ·mol-1
△H1=-a(a>0)kJ·mol-1
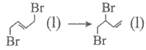 △H2=+c(c>0)kJ·mol-1
△H2=+c(c>0)kJ·mol-1
①稳定性:A_________B(填”>”、”=”或”<“)。
②气态1,3-丁二烯和液态Br2以物质的量之比为1:1加成生成液态B的热化学方程式是_________。
(2)探究1,2-加成和1,4-加成的影响因素。
实验1 将1,3-丁二烯和Br2以物质的量之比1:1加成,不同温度,相同时间内测定A和B在产物中的含量,低温时产物以A为主,较高温时以B为主。
实验2 加热实验1中低温时的反应产物,A的含量减少,B的含量增大。
实验3 在实验1的基础上,充分延长反应时间,无论是低温还是高温,产物中B的含量均增大。
①结合反应过程和能量变化的示意图,解释实验1中低温时产物以A为主的原因:
_________。
②说明实验2中,升高温度,A转化为B经历的物质转化过程:_________。
③综上所述,有利于1,4加成的措施是_________。
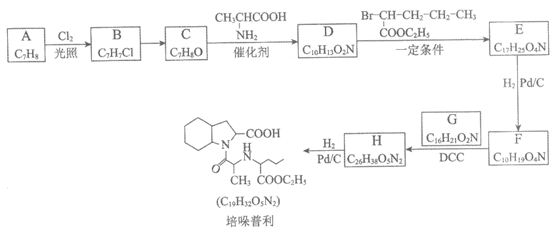
18. (14分)培哚普利主要用于治疗高血压与充血性心力衰竭,其合成路线如下:
已知:i.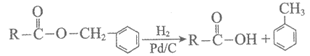
ii. DCC是一种很强的脱水剂。
(1)芳香烃A的名称是________。
(2)B→C所需的试剂及条件是________。
(3)C→D的化学方程式是________。
(4)D→E的反应类型是________。
(5)F的结构简式是________。
(6)K存在互变异构体K’,G可由如下路线合成:
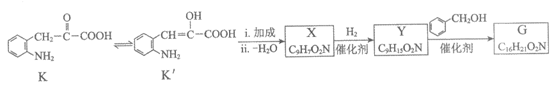
①X含有五元环和碳碳双键,其结构简式是________。
②上述合成培哚普利的路线中,将Y转化为G,再与F反应,而不直接用Y的主要目的是________,与合成路线中__→__(填字母)的转化目的相同。
19. (15分)某小组电解K2Cr2O7溶液,研究过程如下:
实验一 电压不同时,用石墨电极电解硫酸酸化的pH=2.5的饱和K2Cr2O7溶液,实验现象如下:
电压/V | 实验现象 |
2.0 | 阳极缓慢产生少量气泡,阴极没有气泡 |
3.0 | 阳极产生较多气泡,阴极产生少量气泡 |
>5.0 | 两极均快速产生大量气泡,阴极产生气泡的速率约为阳极的2倍 |
(1)阳极严生的气体是_________。
(2)电压为2.0 V时,阴极区检出Cr3+,结合实验现象判断在阴极放电的主要离子是_________。
(3)电压高于5.0 V时,被电解的主要物质是_________。
实验二 探究其他因素对电解K2Cr2O7溶液的影响。用相同强度的稳恒电流(单位时间内转移的电子数始终相同),分别电解3份500 mL相同浓度的K2Cr2O7溶液,电解时间均为30 min。实验结果如下:
实验序号 | I | II | III |
电极材料 | 阴极:石墨 阳极:石墨 | 阴极:石墨 阳极:石墨 | 阴极:石墨 阳极:铁 |
加入的物质 | 1 mL 浓硫酸 | 1 mL 浓硫酸、少量硫酸铁 | 1 mL 浓硫酸 |
电极表面是否产生气泡 | 两极均产生气泡 | 两极均产生气泡 | 阴极:产生气泡 阳极:无明显气泡产生 |
Cr2O72-还原率/% | 12.7 | 20.8 | 57.3 |
阴极变化 | 实验结束后取出电极,仅I中阴极上附着银白色固体,经检验为金属Cr | ||
(4)对比I、II可知,阴极表面是否析出金属Cr,以及II中Cr2O72-的还原率提高均与_________(填离子符号)有关。
(5)III中Cr2O72-还原率较I、II有较大提高,分析其原因:
①阳极区:阳极反应:_________,进而使Cr2O72-被还原。
②阴极区:由于_________,进而促进了Cr2O72-在阴极区被还原,依据的实验现象是_________。
(6)工业上处理含Cr2O72-的废水,用铁作阳极,控制一定的电压,初始pH为3~4,将Cr2O72-最终转化为难溶的Cr(OH)3除去。
结合上述实验,电压不宜过高、pH不宜过小的目的,除节约成本和防止腐蚀设备外,还有_________。
参考答案
第一部分(共42分)
每小题3分。
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
答案 | A | C | C | D | D | B | D |
题号 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
答案 | C | B | C | A | B | C | A |
第二部分(共58分)
说明:其他合理答案均可参照本参考答案给分。
15. (每空2分,共11分)
(1)Cu+H2O2+2H+=Cu2++2H2O
(2)①将溶液中的Fe3+转化为FeF63-,防止其氧化I–
②2Cu2++4I–=2CuI↓+I2
③将Cu2+充分还原为CuI;I–与I2结合生成I3–,减少I2的挥发
(3)将CuI沉淀转化为溶解度更小的CuSCN沉淀,释放出吸附的I2和I3–,提高测定结果的准确程度
(4)(63.5×5×cv×10-3/a×100%(1分)
16. (每空2分,共8分)
(1)酸雨(1分)
(2)2ZnO+2SO2+5H2O=2ZnSO3·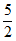 H2O
H2O
(3)①HSO3–(1分)
②HSO3–+O3=SO42-+O2+H+(2HSO3–+O3=SO42-+O2+H2SO3)
③O3将ZnSO3·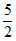 H2O氧化为可溶的ZnSO4的化学反应速率快,单位时间内固体残留量少,防止管道堵塞
H2O氧化为可溶的ZnSO4的化学反应速率快,单位时间内固体残留量少,防止管道堵塞
17. (每空2分,共10分)
(1)①<
② △H=-(a+c)kJ·moL-1
△H=-(a+c)kJ·moL-1
(2)①从图中可知,生成A的活化能比生成B的小,化学反应速率快,所以低温时,产物以A为主
②升高温度,A生成中间体C,中间体C生成B
③升高温度(1分) 延长反应时间(1分)
18. (每空2分,共14分)
(1)甲苯 (2)NaOH的水溶液 加热
(3)
(4)取代反应
(5)
(6)①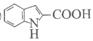 ②保护Y中的羧基(1分) C→D(1分)
②保护Y中的羧基(1分) C→D(1分)
19. (每空2分,共15分)
(1)O2(1分)
(2)Cr2O72-
(3)H2O(H+和OH–)
(4)Fe3+
(5)①Fe-2e–=Fe2+
②Fe3+迁移进入阴极区,在阴极得电子生成Fe2+
II中比I中的Cr2O72-还原率高,II、III中阴极上均没有析出Cr
(6)避免电压过高、pH过小导致H+在阴极放电,从而降低Cr2O72-的还原率:pH过小不利于Cr3+转化为Cr(OH)3