本试卷共两部分,24道小题,满分45分。考试时间:与生物合计90分钟。
可能用到的相对原子质量:Mg 24 Cl 35.5
第一部分 选择题(共12分)
(每小题只有1个选项符合题意。每小题1分)
1. 空气成分中,体积分数约为21%的是
A. 氧气 B. 氮气 C. 稀有气体 D. 二氧化碳
2. 下列变化过程中,只发生物理变化的是
3. 一些物质的pH范围如下,其中呈酸性的是
A. 番茄汁(4.0~4.4) B. 鸡蛋清(7.6~8.0)
C. 肥皂水(8.3~9.1) D. 草木灰水(10.3~11.1)
4. 下列物质中,属于溶液的是
A. 蒸馏水 B. 碘酒 C. 果粒橙 D. 豆浆
5. 下列操作不正确的是
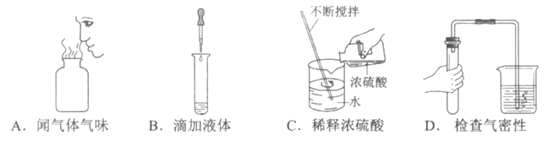
6. 下列符号中,表示2个氧原子的是
A. O2 B. 2O C. 2O2- D. 2O2
7. 下列物质常用于改良酸性土壤的是
A. 食盐 B. 烧碱 C. 熟石灰 D. 石灰石
8. 一种镉原子的原子核内有48个质子和64个中子,该原子的核外电子数为
A. 16 B. 48 C. 64 D. 112
9. 下列物质的用途中,利用其化学性质的是
A. 铜用于制作导线 B. 一氧化碳用于炼铁
C. 干冰用于制冷 D. 稀有气体用于电光源
10. 用下图所示装置进行实验,能达到实验目的的是
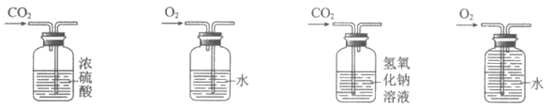
A. 干燥CO2 B. 监控O2流速 C. 吸收CO2 D. 收集O2
11. 如图所示,在点滴板1~6的孔穴中,分别滴加2滴紫色石蕊溶液。以下说法不正确的是
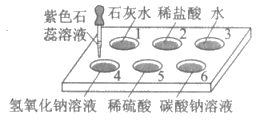
A. 孔穴1、4溶液变为蓝色
B. 孔穴2、5溶液变红的原因是溶液中都含有H+
C. 孔穴3是空白对照实验
D. 孔穴6溶液变为蓝色说明碳酸钠属于碱
12. 甲、乙两种固体物质的溶解度曲线如图所示。下列说法不正确的是

A. 40℃时,甲的溶解度大于乙的溶解度
B. 甲、乙物质的溶解度都随温度的升高而增大
C. 将20℃时甲的饱和溶液降温至0℃,无晶体析出
D. 将40℃时乙的饱和溶液降温至20℃,仍然是饱和溶液
第二部分 非选择题(共33分)
〖生活现象解释〗
13. (1分)科学家研发出在光照条件下,以氧化钴纳米粒子为催化剂分解水获得氢气的方法。该反应的化学方程式是_______________。
14. (2分)泡腾片放入水中,立即生成大量CO2,状如沸腾。
(1)某VC泡腾片的营养成分表如图,含量最高的营养素是____________。
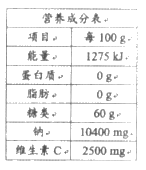
(2)列举出一个学过的能与酸反应生成CO2的物质_______________。
15. (2分)海水是溶有氯化钠等盐分的混合物。反渗透海水淡化法部分流程示意图如下:
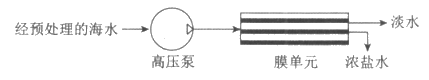
(1)高压泵需要的能量可由天然气燃烧提供。天然气的主要成分完全燃烧的化学方程式是______________。
(2)推测:泵入”膜单元”的海水、得到的淡水和浓盐水中,所含氯化钠的质量分数最大的是___________。
〖科普阅读理解〗
16. (5分)阅读下列科普短文。
甲醛(CH2O) 为无色有刺激性气味的气体,极易溶于水,是重要的工业原料。由于甲醛影响人体健康,国家标准规定室内甲醛浓度不高于0.08mg/m3。下面介绍几种吸收甲醛的方法。
活性炭包 活性炭内部有大量细微孔道,可吸附甲醛。
空气净化器 其内置主要有电机和滤网。电机可加快抽入气体的循环流动速度。滤网除活性炭滤网外,还有静电驻极过滤网、光触媒滤网等。静电驻极过滤网靠静电力捕获带电微粒,但不能捕获甲醛。光触媒滤网在紫外线照射下产生氧化能力极强的物质,该物质可杀菌和分解甲醛等有机污染物。
植物 某小组在3个密闭容器内分别放入吊兰、绿萝和芦荟,测定0~24 h甲醛的浓度,计算不同植物对甲醛的去除率(见表),比较其吸收效果,并绘制了吊兰的吸收曲线(见图)。柚子皮和菠萝不具有吸附性,也不与甲醛反应,常温下只能靠自身的气味掩盖甲醛的味道。
吊兰 | 绿萝 | 芦荟 | |
0h时甲醛的浓度(mg/m3) | 0.88 | 0.80 | 1.13 |
24h时甲醛的浓度(mg/m3) | 0.13 | 0.07 | 0.19 |
去除率(%) | 85.2 | 91.3 | 83.2 |
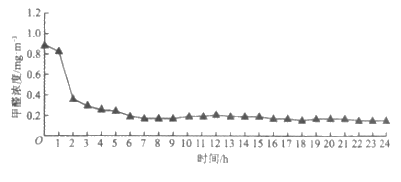
以上方法效果不一,可根据不同情况选用适合的方法。
依据文章内容,回答下列问题。
(1)甲醛(CH2O)属于____________(填序号,下同)。
A. 混合物 B. 化合物 C. 氧化物
(2)空气净化器吸收甲醛比活性炭包效率高的原因是_________(答1条即可)。
(3)依图分析,吊兰吸收效率最高的时间是__________。
A. 0~1 h B. 1~2 h C. 7~8 h
(4)依表判断,吸收效果最好的植物是___________。
(5)下列说法正确的是__________。
A. 甲醛是重要的工业原料,但使用时需考虑其对环境的影响
B. 空气净化器的每层滤网都可以吸收甲醛
C. 本实验中,3种植物都不能使密闭容器内甲醛含量降低至国家标准以下
D. 柚子皮和菠萝吸收甲醛的效果较好
〖生产实际分析〗
17. (2分)光气(COCl2)在塑料制革等工业中有许多用途。工业制光气的主要流程如下:
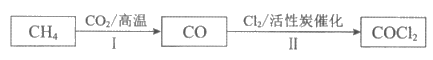
(1)Ⅰ中产生CO和一种气体单质,反应中化合价发生改变的元素有___________。
(2)Ⅱ中发生化合反应,该反应的化学方程式是__________________。
18. (3分)利用氢氧化镁制备金属镁的主要流程如图:
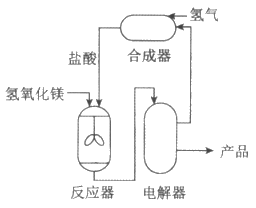
(1)反应器中搅拌的目的是___________。
(2)反应器中发生的反应属于基本反应类型中___________反应。
(3)电解器中发生反应的化学方程式为:
MgCl2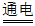 Mg+Cl2↑。生产24 kg金属镁,理论上需要氯化镁的质量是___________kg。
Mg+Cl2↑。生产24 kg金属镁,理论上需要氯化镁的质量是___________kg。
〖基本实验及其原理分析〗
19. (3分)去除粗盐中难溶性杂质的主要操作如下图所示。
(1)操作①中玻璃棒的作用是___________。
(2)操作③的名称是___________。
(3)正确的实验操作顺序是___________(填序号)。
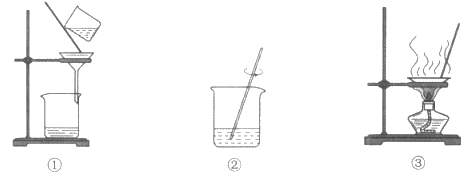
20. (2分)用下图装置研究二氧化碳的性质。
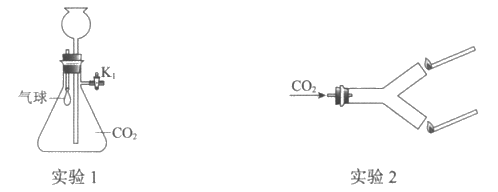
(1)实验1:打开K1,从长颈漏斗加水没过漏斗下端,关闭K1,振荡。观察到的实验现象是___________。
(2)实验2:下端木条先熄灭,可以验证CO2的性质是___________。
21. (2分)补全实验方案。请从A~C中任选二个作答,若均作答,按前二个计分。
序号 | 目的 | 操作 | 现象 | 结论 |
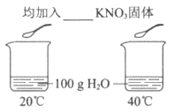
A | 验证温度对KNO3溶解度的影响 |
已知:20℃和40℃时,KNO3溶解度分别为31.6g和63.9g | 20℃时固体部分溶解,40℃时固体全部溶解 | KNO3的溶解度随温度的升高而增大 |
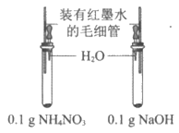
B | 研究NH4NO3和NaOH溶解时的温度变化 |
| ___________ | NH4NO3溶解时温度降低;NaOH溶解时温度升高 |
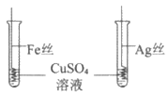
C | 比较Fe、Cu和Ag的金属活动性顺序 |
| Fe丝表面有红色固体析出,Ag丝表面无明显现象 | ____________ |
22. (2分)如下图装置进行实验(夹持仪器略去)。
(1)A中发生反应的化学方程式是___________。
(2)B中的实验现象是___________。
23. (3分)实验小组用传感器研究稀盐酸和稀NaOH溶液的反应。实验过程中温度和pH变化趋势如图所示。
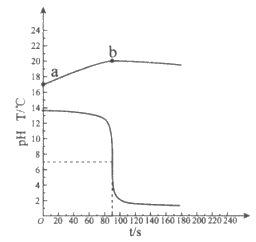
(1)上述反应的化学方程式是___________。
(2)曲线a~b上升的原因是___________。
(3)下列说法正确的是___________(填序号)。
A. 该实验是将稀盐酸滴入稀NaOH溶液中
B. 60s时对应溶液中的溶质是NaCl
C. 120s时向溶液中加入酚酞,溶液不变色
D. 180s时向溶液中加入Na2CO3溶液,能证明稀盐酸和稀NaOH溶液发生反应
〖科学探究〗
24. (6分)用下图装置进行铁与水蒸气在较高温度下反应的实验。取适量的铁粉与氢氧化钙平铺在试管底部,点燃酒精灯,待有较大气泡产生时,用燃着的木条靠近气泡直至有爆鸣声。
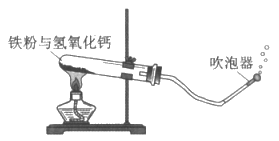
【提出问题】改变铁粉和氢氧化钙的质量及两者放置的方式是否会影响实验效果呢?
【查阅资料】①Ca(OH)2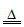 CaO+H2O↑
CaO+H2O↑
②”气泡爆鸣时间”指从开始加热到第一个气泡爆鸣所用的时间
③”气泡爆鸣时间”越短,实验效果越好
【进行实验】按下表进行实验,记录”气泡爆鸣时间”。
表1
实验 | 铁粉与氢氧化钙的放置方式 | 铁粉的质量/g | 氢氧化钙的质量/g | 气泡爆鸣时间/s |
1 | 铁粉在上层 | 0.5 | 1.5 | 151 |
2 | 1.0 | 1.0 | 119 | |
3 | 1.5 | 0.5 | 66 | |
4 | 铁粉在下层 | 0.5 | 0.5 | 88 |
5 | 1.0 | a | 44 | |
6 | 1.5 | 1.0 | 54 | |
7 | 二者均匀混合 | 0.5 | 1.0 | 77 |
8 | 1.0 | 0.5 | 58 | |
9 | 1.5 | 1.5 | 60 |
【处理数据】根据表1,计算”气泡爆鸣时间”均值,结果如下:
表2
因素 | 放置方式 | 铁粉的质量/g | 氢氧化钙的质量/g | ||||||
铁粉在上层 | 铁粉在下层 | 均匀 混合 | 0.5 | 1.0 | 1.5 | 0.5 | 1.0 | 1.5 | |
气泡爆鸣时间均值/s | 112 | 62 | 65 | 105 | 74 | 60 | 70 | 83 | 85 |
【解释与结论】
(1)实验中,使用氢氧化钙的目的是___________。
(2)实验中,生成的气体为氢气,其理由是___________。
(3)表1中,a为_________g。
(4)根据表2推断,最佳的实验条件为___________。
【反思与评价】
(5)表2中,1.5 g铁粉对应的均值为60。计算该值依据的3个数据分别是___________。
(6)实验中,铁粉在下层比上层的实验效果好。从金属性质的角度解释原因:___________。
【试题答案】
第—部分 选择题(每小题只有一个选项符合题意,共12个小题,每小题1分,共12分)
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
答案 | A | D | A | B | A | B | C | B | B | C | D | C |
第二部分 非选择题(共12个小题,共33分)说明:每空1分。其他合理答案均可给分。
13. (1分)
2H2O 2H2↑+O2↑
2H2↑+O2↑
14. (2分)
(1)糖类 (2)碳酸钠等
15. (2分)
(1)CH4+2O2 CO2+2H2O (2)浓盐水
CO2+2H2O (2)浓盐水
16. (5分)
(1)B
(2)空气净化器的电机可加快抽入气体的循环流动速度或空气净化器中活性炭滤网和光触媒滤网均可除去甲醛。
(3)B (4)绿萝 (5)A
17. (2分)
(1)H、C (2)CO+Cl2 COCl2
COCl2
18. (3分)
(1)使反应物充分接触,加快反应速率,反应更充分
(2)复分解 (3)95
19. (3分)
(1)引流 (2)蒸发 (3)②①③
20. (2分)
(1)气球鼓起 (2)一般情况下,二氧化碳密度比空气大、不燃烧、不支持燃烧
21. (2分)
A X g(31.6<X≤63.9)
B 左侧毛细管中的红墨水向下移动;右侧毛细管中的红墨水向上移动
C 金属活动性由强到弱的顺序是:Fe、Cu、Ag
22. (2分)
(1)2H2O2 2H2O+O2↑
2H2O+O2↑
(2)发白光,放出热量,石灰水变浑浊
23. (3分)
(1)NaOH+HCl=NaCl+H2O
(2)稀盐酸和稀NaOH溶液反应放出热量
(3)AC
24. (6分)
(1)氢氧化钙受热分解生成水,为铁和水蒸气反应提供反应物
(2)生成可燃性气体且依据元素守恒,反应物中含有氢元素
(3)1.5
(4)铁粉在下层,铁粉为1.5 g,氢氧化钙为0.5 g
(5)66 54 60
(6)铁粉具有导热性,能够保证反应所需温度