本试卷共100分。考试时长90分钟。
可能用到的相对原子质量:
H 1 N 14 O 16 Na 23 S 32 Zn 65 I 127
第一部分
本部分共14题,每题3分,共42分。在每题列出的四个选项中,选出最符合题目要求的一项。
1. 下列资源利用过程中,不涉及化学变化的是
|
|
|
|
A. 石油分馏 | B. 煤的干馏 | C. 发酵法制沼气 | D. 海水提镁 |
2. 利用化学方法可以改善大气质量、进行水处理等。下列说法不正确的是
A. 减少化石燃料的燃烧有益于缓解温室效应
B. 向天然水中加入明矾可起到杀菌消毒的作用
C. 可用熟石灰处理钢铁厂、电镀厂产生的酸性废水
D. 在汽车尾气系统中安装催化转化器可减少尾气污染
3. 下列物质混合后,能产生蓝色沉淀的是
A. FeCl3溶液与NaOH溶液
B. FeSO4溶液与K3[Fe(CN)6]溶液
C. AgNO3溶液与氨水
D. 鸡蛋清与浓硝酸
4. 2019年,我国青年化学家雷晓光被遴选为”青年化学家元素周期表”氮元素的代言人。下列与氮元素有关的说法正确的是
A. 14N与14C互为同位素 B. —NH2的电子式为
C. NH3的热稳定性比HF的强 D. Si3N4中N为+3价
5. 下列实验操作能达成实验目的且涉及到氧化还原反应的是
选项 | 实验目的 | 实验操作 |
A | 除去CO2中的SO2 | 先后通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶 |
B | 除去MgCl2溶液中的AlCl3 | 加入过量NaOH溶液,过滤,向沉淀中加入适量盐酸 |
C | 检验溶液中含有Fe3+ | 加入KSCN溶液 |
D | 检验稀硫酸催化淀粉水解的产物为葡萄糖 | 向水解后的溶液中直接加入新制Cu(OH)2,加热 |
6. 芹菜中的芹黄素具有抗肿瘤、抗病毒等生物学活性,其熔点为347~348℃,结构简式如下图所示。下列关于芹黄素的说法不正确的是
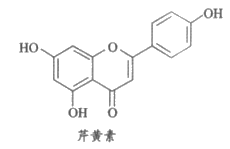
A. 常温下为固体,需密封保存
B. 分子中含有3种含氧官能团
C. 与溴水只发生加成反应
D. 1 mol芹黄素最多能与3 mol NaOH反应
7. 将物质的量之比为1:3的氮气和氢气充入恒容密闭容器中,测定不同温度、压强下平衡混合物中氨的物质的量分数,结果如图所示。下列说法不正确的是
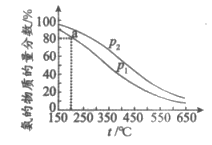
A. p1<p2
B. 该反应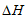 <0
<0
C. a点,N2的转化率为40%
D. 合成氨工业实现了人工固氮
8. 实验室药品必须按规定存放,下列对错误存放后出现现象的解释合理的是
A. 石灰水敞口存放,出现白色固体:2OH-+CO2=CO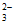 +H2O
+H2O
B. 浓硝酸存放于无色细口瓶中,颜色变黄:2HNO3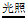 2NO↑+O2↑+H2O
2NO↑+O2↑+H2O
C. 酸化的硫酸亚铁溶液长时间存放,溶液变黄:4H++2Fe2++SO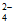 =2Fe3++SO2↑+2H2O
=2Fe3++SO2↑+2H2O
D. 将氨水和浓盐酸存放在同一个药品柜中,柜壁出现白色固体:NH3+HCl=NH4Cl
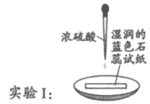
9. 下列依据实验方案和现象对浓硫酸性质做出的判断合理的是
实验方案 |
|
|
实验现象 | 试纸中心区域变黑,边缘变红 | 黑色固体溶解,溶液接近无色(溶液中锰元素仅以Mn2+存在),产生能使带火星的木条复燃的无色气体 |
A. 由Ⅰ可知,浓硫酸具有脱水性 B. 由Ⅰ可知,浓硫酸具有弱酸性
C. 由Ⅱ可知,浓硫酸具有强氧化性 D. 由Ⅱ可知,浓硫酸具有吸水性
10. 常温下,下列各离子组在指定溶液中能大量存在的是
A. 无色溶液中:K+、MnO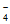 、NO
、NO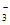 、Cl-
、Cl-
B. c(Fe3+)=0.1mol/L的溶液中:H+、I-、Br-、SO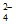
C. 使石蕊变红的溶液中:Na+、NH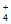 、NO
、NO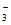 、SO
、SO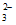
D. pH=13的溶液中:Na+、ClO-、CO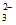 、SO
、SO
11. 丙烷的一溴代反应产物有两种:CH3CH2CH2Br和CH3CHBrCH3,部分反应过程的能量变化如图所示(Ea表示活化能)。下列叙述不正确的是
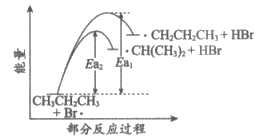
A. 1 mol丙烷中有10mol共价键
B. C3H8与Br2的反应涉及极性键和非极性键的断裂
C. CH3CH2CH3+Br·=·CH2CH2CH3+HBr
D. 比较Ea1和Ea2推测生成速率:·CH2CH2CH3>·CH(CH3)2
12. 金属铬常用于提升特种合金的性能。工业上以铬铁矿(主要成份为FeO·Cr2O3,含有少量Al2O3)为原料制备金属铬的流程如下图。下列说法不正确的是
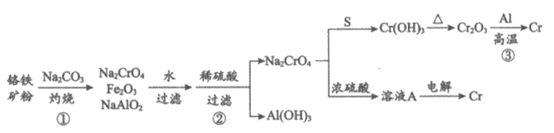
A. ①中需持续吹入空气做氧化剂 B. ②中需加入过量稀硫酸
C. ③中发生了置换反应 D. 溶液A为橙色
13. 考古发掘出的古代青铜器(含铜锡等金属)表面经常出现小孔腐蚀,这是一种电化学腐蚀现象。小孔腐蚀的过程及铜腐蚀产物(铜锈)的成分如下图所示。
已知:2CuCl+H2O 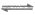 Cu2O+2HCl
Cu2O+2HCl
下列分析不正确的是
A. 氧气是正极反应物
B. 铜锈的成份与氧气浓度、pH有关
C. 图2中,Cl-从小孔内向小孔外移动
D. 青铜中的锡也会发生电化学腐蚀
14. 84消毒液的主要成分是NaCl和。NaClO。实验小组同学围绕”84消毒液能否与医用酒精发生反应”这一问题进行了如下实验。
序号 | 实验 | 现象 |
① | 分别取40mL 84消毒液和医用酒精混合均匀,并测量溶液温度变化 | 溶液温度由20℃升高至23℃,并产生大量气泡,略有刺激性气味,溶液颜色无明显变化 |
② | 分别取40mL医用酒精和蒸馏水混合均匀,水浴至23℃ | 溶液中无明显现象 |
③ | 分别取40mL 84消毒液和蒸馏水混合均匀,水浴至23℃ | 溶液中无明显现象,略有刺激性气味 |
④ | 分别取40mL 84消毒液、40mL医用酒精和少量白醋,混合均匀 | 产生大量气泡,有强烈的刺激性气味,溶液逐渐变为淡黄色 |
下列推理不合理的是
A. 由①②可知,①中产生的大量气泡与酒精挥发无关
B. 由①③可知,①中刺激性气味的产生可能与酒精无关
C. 由①②③可推断,84消毒液与医用酒精混合后,溶液中发生了化学反应
D. 由①④可推断,酸性条件有利于84消毒液与医用酒精发生反应
第二部分
本部分共5题,共58分。
15. (8分)”地沟油”泛指生活中产生的、不宜继续食用的油脂。地沟油经脱胶、洗涤、脱色等预处理,用来制备脂肪酸钠(RCOONa),在消除危害的同时,还可用于处理含Cu2+的废水。
已知:2RCOO-+Cu2+ (RCOO)2Cu
(RCOO)2Cu
(1)可利用活性炭对地沟油进行脱色处理,这利用了活性炭的_________性。
(2)取30 mL三油酸甘油酯在不同条件下水解,实验结果如下表所示。
序号 | 试剂 | 温度 | 时间 | 水解率 |
a | 20mL 3mol/L H2SO4 | 95℃ | 3小时 | 52.1% |
b | 20mL 6mol/L NaOH | 70℃ | 1.5小时 | 97.7% |
①实验a中,三油酸甘油酯水解的产物是_________(填物质名称)。
②对比实验a、b可以得到的结论有___________(写出2条)。
(3)将预处理后的地沟油水解,用水解所得液体去除Cu2+的实验过程如下图所示。

①RCOONa属于_________(填”离子化合物”或”共价化合物”)。
②实验表明,硫酸酸化后液体的pH会影响Cu2+的去除率。实验测得,pH=5时Cu2+的去除率低于pH=7时的,其原因为______________。
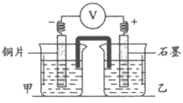
16. (12分)维持pH的稳定对生命体的生理活动、化学电源的高效工作等具有重要意义。
(1)常温下,在不同试剂中加入酸或碱后体系pH的变化如下表所示。
试剂 | pH | ||
初始 | 通入0.01molHCl气体 | 加入0.01molNaOH固体 | |
i. 1L H2O | 7 | a | 12 |
ii. 0.10mol CH3COOH+0.10mol CH3COONa配制成1L的溶液 | 4.76 | 4.67 | 4.85 |
①a=___________(忽略通入HCl气体前后体系的体积变化)。
②结合化学用语解释试剂ii显酸性的原因:_______________。
③试剂ii中微粒浓度关系正确的有____________(填序号)。
a. c(CH3COOH)>c(Na+)>c(CH3COO-)
b. 2c(H+)=c(CH3COO-)-c(CH3COOH)+2c(OH-)
c. c(CH3COOH)+c(CH3COO-)=0.2mol/L
④由表中数据可知,试剂ii的pH受一定量的酸和碱的影响不大。溶液的这种能对抗外来少量强酸、强碱或适当稀释,而保持溶液的pH几乎不变的作用称为缓冲作用。下列溶液具有缓冲作用的是__________(填序号)。
a. HCl—NaCl b. Na2CO3-NaHCO3
c. NH3·H2O—NH4Cl d. KOH—KCl
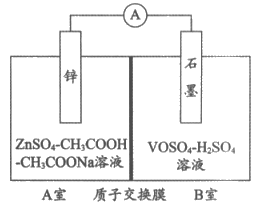
(2)缓冲溶液应用在某种液钒电池中能稳定电池的输出电流,该电池装置示意图如下图所示,电池的总反应如下:
Zn+2VOSO4+2H2SO4
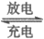 ZnSO4+V2(SO4)3+2H2O
ZnSO4+V2(SO4)3+2H2O
已知:VOSO4和V2(SO4)3的电离方程式分别为
VOSO4=VO2++SO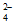
V2(SO4)3=2V3++3SO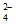
①放电时,B室中c(H+)__________(填”增大””减小”或”不变”),结合化学用语说明理由:________________。
②充电时,A室中的c(H+)变化缓慢的原因是_________________。
17. (13分)有机物A是一种重要的化工原料,用A制取新型聚合物F的合成路线如下:
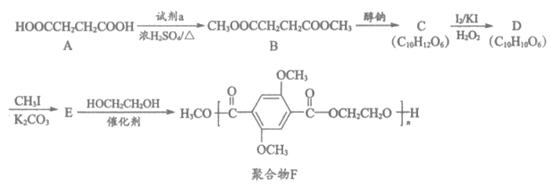
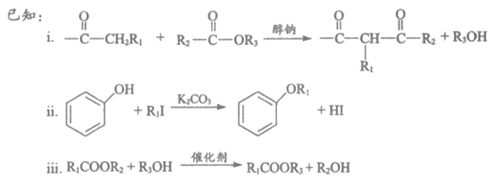
(1)A中官能团的名称为_____________。
(2)试剂a为_____________。
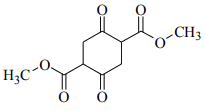
(3)C中含有一个六元环,C的结构简式为_____________。
(4)C→D的反应类型为_____________。
(5)E→F的化学方程式是_____________。
(6)下列说法正确的是_____________(填序号)。
a. A能与NaHCO3溶液反应
b. 醇钠可由醇与金属钠反应制得
c. 可用FeCl3溶液鉴别D和E
d. HOCH2CH2OH俗称甘油
(7)以乙醇为起始原料,利用已知信息、选择必要的无机试剂合成CH3COCH2COOC2H5,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
18. (13分)H2S是一种大气污染物。工业尾气中含有H2S,会造成严重的环境污染;未脱除H2S的煤气,运输过程中还会腐蚀管道。
(1)干法氧化铁脱硫是目前除去煤气中H2S的常用方法,其原理如图所示。
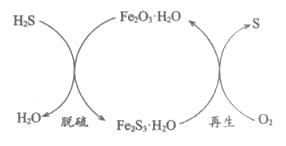
①下列说法正确的是_____________(填序号)。
a. 单质硫为黄色固体
b. 脱硫反应为3H2S+Fe2O3·H2O=Fe2S3·H2O+3H2O
c. 再生过程中,硫元素被还原
d. 脱硫过程中,增大反应物的接触面积可提高脱硫效率
②从安全环保的角度考虑,再生过程需控制反应温度不能过高的原因是_____________。
(2)电化学溶解—沉淀法是一种回收利用H2S的新方法,其工艺原理如下图所示。
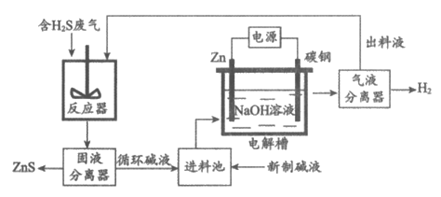
已知:Zn与强酸、强碱都能反应生成H2;Zn(Ⅱ)在过量的强碱溶液中以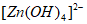 形式存在。
形式存在。
①锌棒连接直流电源的_____________(填”正极”或”负极”)。
②反应器中反应的离子方程式为_____________。
③电解槽中,没接通电源时已经有H2产生,用化学用语解释原因:_____________。
(3)常用碘量法测定煤气中H2S的含量,其实验过程如下:
i. 将10 L煤气通入盛有100 mL锌氨络合液的洗气瓶中,将其中的H2S全部转化为ZnS沉淀,过滤;
ii. 将带有沉淀的滤纸加入盛有15 mL 0.1 mol/L碘标准液、200 mL水和10 mL盐酸的碘量瓶中,盖上瓶塞,摇动碘量瓶至瓶内滤纸摇碎,置于暗处反应10 min后,用少量水冲洗瓶壁和瓶塞。(已知:ZnS+I2=ZnI2+S)
iii. 用0.1mol/L Na2S2O3标准液滴定,待溶液呈淡黄色时,加入1mL淀粉指示剂,继续滴定至终点。(已知:2Na2S2O3+I2=Na2S4O6+2NaI)
①i中,将煤气中的H2S转化为ZnS的目的是_____________。
②滴定终点的现象是_____________。
③若消耗Na2S2O3标准液的体积为20 mL,则煤气中H2S的含量为____________mg/m3。
19. (12分)工业上用Cu(NH3)4SO4和氨水的混合液浸取废铜矿渣中的单质铜,得到[Cu(NH3)2]2SO4。
某小组同学欲通过实验探究其原理。
【查阅资料】i. [Cu(NH3)4]2+呈深蓝色,[Cu(NH3)4]2+ Cu2++4NH3;受热易分解,放出氨气。
Cu2++4NH3;受热易分解,放出氨气。
ii. Cu+在水溶液中不稳定,Cu(I)在溶液中只能以[Cu(NH3)2]+等络合离子的形式稳定存在;[Cu(NH3)2]+无色,易被氧气氧化为[Cu(NH3)4]2+。
【实验1】制备Cu(NH3)4SO4。
向盛有2mL 0.1mol/L CuSO4溶液的试管中滴加2mL 1mol/L氨水,观察到溶液中立即出现浅蓝色沉淀;随后沉淀逐渐溶解,得到深蓝色溶液。经分离得到Cu(NH3)4SO4晶体。
(1)资料表明,向CuSO4溶液中滴加氨水,可能会生成浅蓝色Cu2(OH)2SO4沉淀。
①该小组同学取实验1中浅蓝色沉淀,洗涤后,_____________(补全实验操作和现象),证明沉淀中含有SO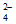 。
。
②补全实验1中生成Cu2(OH)2SO4沉淀的离子方程式:
2Cu2++___________+SO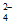 =Cu2(OH)2SO4↓+_________
=Cu2(OH)2SO4↓+_________
(2)甲同学设计实验证明深蓝色溶液中含Cu(NH3)4SO4:加热深蓝色溶液并检验逸出气体为氨气。你认为此方案__________(填”可行”或”不可行”),理由是____________。
【实验2】探究用Cu(NH3)4SO4和氨水的混合液浸取单质铜得到[Cu(NH3)2]2SO4的原理。
编号 | 实验装置及部分操作 | 烧杯中溶液 | 实验现象 |
2-1 |
实验开始,先读取电压表示数,后迅速将其换成电流表,继续实验,10 min内记录甲烧杯中现象 | 甲:0.05mol/L Na2SO4 乙:0.05mol/L Cu(NH3)4SO4 | 电压表指针迅速偏转至0.1V; 甲中溶液无明显变化 |
2-2 | 甲:0.05mol/LNa2SO4 乙:0.05mol/L CuSO4 | 电压表指针迅速偏转至0.3V; 甲中溶液无明显变化 | |
2-3 | 甲:0.1mol/L Na2SO4与1mol/L氨水等体积混合 乙:溶液A | 电压表指针迅速偏转至0.35V;甲中溶液无明显变化 | |
2-4 | 甲:0.1mol/LNa2SO4与1mol/L氨水等体积混合 乙:0.05mol/LCuSO4 | 电压表指针迅速偏转至0.65V;几分钟后,甲烧杯溶液逐渐由无色变蓝色 |
已知:其他条件相同时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,检测到的电压越大
(3)溶液A为_____________。
(4)对比实验2-1和2-2,可以得到结论是_____________。
(5)实验2-4中,甲烧杯中溶液由无色变为蓝色的原因是_____________。
(6)依据上述实验,分析用Cu(NH3)4SO4和氨水的混合液浸取单质铜的原理:_____________。
【试题答案】
第一部分 选择题
(每小题只有 1个选项符合题意,共 14个小题,每小题 3分,共 42分)
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
答案 | A | B | B | B | A | C | C |
题号 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
答案 | D | A | D | D | B | C | D |
第二部分 非选择题
评阅非选择题时请注意:
· 若无特别说明,每空 2 分。
· 文字表述题中其他答案合理也给分。
· 方程式中的产物漏写”↑”或”↓”不扣分。
· 化学专用词汇若出现错别字为 0 分。
15.(8分)
(1)吸附(1分)
(2)① 油酸、甘油
②实验条件下,碱性环境中水解速率快,温度对水解反应的影响小于溶液酸碱性的影响
(3)① 离子化合物(1分)
②与 pH=7 相比,pH=5 时,H+浓度增大,使平衡 RCOO–+H+
 RCOOH 正向 移动,RCOO浓度降低,不利于反应 2RCOO–+Cu2+
RCOOH 正向 移动,RCOO浓度降低,不利于反应 2RCOO–+Cu2+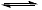 (RCOO)2Cu 正向进行。
(RCOO)2Cu 正向进行。
16.(12分)
(1)①2(1分)
②试剂 ii 中同时存在醋酸的电离平衡 CH3COOH 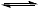 CH3COO-+H+ 和醋酸根的水解平衡 CH3COO+H2O
CH3COO-+H+ 和醋酸根的水解平衡 CH3COO+H2O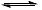 CH3COOH+OH-,相同条件下,醋酸的电离平衡的限度大于醋酸根的水解平衡限度,当CH3COOH与CH3COO-的初始浓度相等时,溶液中c(H+)>c(OH-)
CH3COOH+OH-,相同条件下,醋酸的电离平衡的限度大于醋酸根的水解平衡限度,当CH3COOH与CH3COO-的初始浓度相等时,溶液中c(H+)>c(OH-)
③ bc
④bc
(2)①减小(1分)
放电时,B 室发生正极反应:VO2++e-+2H+=V3++H2O;由电极反应可知,转移 1 mol e-消耗 2 mol H+,同时有1mol H+通过质子交换膜进入B室,因此总体c(H+)降低
② 充电时,H+通过质子膜从B室进入A室,A室溶液中的 CH3COO与H+结合成2CH3COOH(或”CH3COOH-CH3COONa 溶液有缓冲作用”),从而使c(H+)的变化减缓
17.(13分)
(1)羧基(1分)
(2)CH3OH(或甲醇)(1分)
(3)
(4)氧化反应(1分)
(5)(3分)
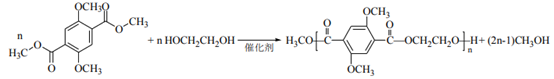
(6)abc
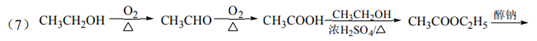
CH3COCH2COOC2H5(或其他合理答案)(3分)
18.(13分)
(1)①abd
②防止硫粉燃烧产生SO2,污染环境、导致爆炸(1分)
(2)①正极(1分)
②H2S+[Zn(ON)4]2-=ZnS↓+2H2O+2OH-
③Zn+2OH-+2H2O=[Zn(OH)4]2-+H2↑
(3)① 富集、提纯煤气中的 H2S(1分)
② 溶液蓝色恰好消失,且半分钟内不恢复蓝色
③ 1700
19.(12分)
(1)① 先加入过量稀盐酸,再加入BaCl2溶液,观察到有白色沉淀产生(3分)
② 2NH3·H2O 2NH4+ (1分)
(2)不可行,实验 1 中氨水过量,过量的氨水受热分解也会产生氨气
(3)0.05mol/L Cu(NH3)4SO4 溶液(1分)
(4)相同条件下,Cu(NH3)4SO4 的氧化性弱于 CuSO4
(5)甲烧杯中发生电极反应:Cu-e-+2NH3=[Cu(NH3)2]+,[Cu(NH3)2]+被空气中的氧气氧化为蓝色[Cu(NH3)4]2+(1分)
(6)[Cu(NH3)4]2+将 Cu 氧化为[Cu(NH3)2]+,氨水对浸取单质铜的反应有促进作用