本试卷共两部分,24道小题。满分45分。
可能用到的相对原子质量:H 1 C 12 O 16 S 32 Ti 48
第一部分 选择题(共12分)
(每小题只有1个选项符合题意。每小题1分)
1. 空气中体积分数约占78%的气体是
A. 稀有气体 B. 二氧化碳 C. 氧气 D. 氮气
2. 下列人体所必须的元素中,青少年缺少会引起佝偻病的是
A. 钙 B. 铁 C. 锌 D. 碘
3. 下列物质含有氧气分子的是
A. 空气 B. H2O2 C. MnO2 D. CO2
4. 下列金属活动性最强的是
A. 锌 B. 铝 C. 铜 D. 银
5. 下列物质不能溶于水形成溶液的是
A. 香油 B. 蔗糖 C. 食盐 D. 味精
6. 下面是人体内一些液体的正常pH范围,其中显酸性的是
A. 血浆7.35~7.45 B. 胃液0.9~1.5
C. 胆汁7.1~7.3 D. 胰液7.5~8.0
7. 在”粗盐中难溶性杂质的去除”实验中,下列实验步骤的正确顺序是
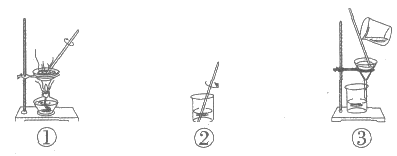
A. ①②③ B. ②①③ C. ③②① D. ②③①
8. “依稀记得校园里的那株桂花树,一到花开时节,每个角落都能闻到它的香气”。每个角落都能闻到花香的原因是
A. 分子的质量很小 B. 分子间有间隔
C. 分子由原子构成 D. 分子在不断运动
9. 屠呦呦因提取研究青蒿素(C15H22O5)用于治疗疟疾,而荣获2015年诺贝尔生理学或医学奖。
下列有关青蒿素的说法不正确的是
A. 它由碳、氢、氧三种元素组成
B. 其分子中,碳、氧原子个数比为3:1
C. 其中碳、氢、氧元素的质量比为15:22:5
D. 其中碳元素的质量分数最大
10. 下图所示装置可用于测定空气中氧气的含量。下列说法不正确的是
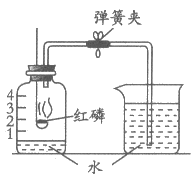
A. 实验前一定要检查装置的气密性
B. 红磷足量是实验成功的关键之一
C. 该实验所用的红磷可用铁丝代替
D. 待反应装置冷至室温打开弹簧夹
11. 下图是某反应前后分子种类变化的微观示意图。下列说法正确的是
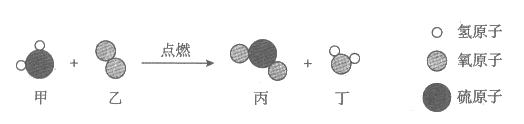
A. 反应前后分子个数不变
B. 反应中涉及到3种氧化物
C. 反应中甲、乙分子个数比为1:1
D. 丙的相对分子质量为64
12. 已知:20℃时,KCl和KNO3的溶解度分别为34 g和31.6 g。配制20℃时的如下四种溶液:
| 溶液 | ① | ② | ③ | ④ |
固体种类 | KCl | KCl | KNO3 | KNO3 | |
加入固体的质量/g | 20 | 35 | 20 | 35 | |
水的质量/g | 100 | 100 | 100 | 100 |
下列有关溶液①~④的说法不正确的是
A. 属于饱和溶液的是②④
B. 溶液的质量②=④
C. 溶液中溶质的质量分数①=③
D. ②中溶质与溶剂的质量比为17:50
第二部分 非选择题(共33分)
【生活现象解释】
13. (1分)请将下列物质和对应的用途连线。
物质 |
干冰 活性炭 食醋 |
14. (2分)金属材料应用广泛。
(1)下列物品由金属材料制成的是_________(填字母序号)。
|
|
|
A. 不锈钢锅 | B. 紫砂壶 | C. 木勺 |
(2)铁是应用最广泛的金属材料。写出工业上用赤铁矿(主要成分为Fe2O3)为原料进行高炉炼铁的化学方程式:________。
15. (2分)84消毒液是北京第一传染病医院(地坛医院)于1984年研制成功的常用消毒剂,在新冠病毒防疫中起到重要的作用。其成分为次氯酸钠(NaClO)、表面活性剂和水等。

(1)84消毒液属于________(填字母序号)。
A. 纯净物 B. 混合物 C. 化合物
(2)84消毒液的消毒原理是:次氯酸钠溶液和空气中的二氧化碳反应,生成碳酸氢钠和次氯酸(HClO),写出该反应的化学方程式:________。
【科普阅读理解】
16. (5分)阅读下面科普短文。
在人体中,钠元素有重要的生理功能:调节水量、维持酸碱平衡、维持血压等。我国居民膳食中每日通过食品或调料获得钠元素的主要来源如图1所示。
图2为2015年我国某省份人均每日食盐摄入量与国家推荐标准和世界卫生组织(WHO)推荐的国际标准的比对。
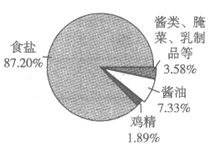
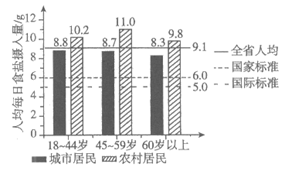
图1 图2
事实证明,中国人的膳食结构中钠元素过多,钾元素过少,这样的情况易导致高血压的发生。为此,以碘盐为基础,加入有咸味的氯化钾,用氯化钾代替部分氯化钠(减钠增钾),使钠、钾比例合理,形成低钠盐。低钠盐有利于防治高血压,通常属于推荐用盐。但高温作业者、重体力劳动强度的工作人员(汗液流失会带走大量钠离子)、肾脏病或高钾血症患者不建议选用。
表1 北京超市中常见的深井岩盐和低钠岩盐成分配料表
种类 | NaCl (g/100 g) | KCl (g/100 g) | KIO3(以I计) (mg/kg) | K4Fe(CN)6(以[Fe(CN)6]4-计) (mg/kg) |
深井岩盐 | ≥98.5 | 0 | 18~33 | ≤10 |
低钠岩盐 | 65~80 | 20~35 | 18~33 | ≤10 |
依据文章内容回答下列问题。
(1)由图1可知,人们获得钠元素的主要来源是_________。
(2)食盐中K4Fe(CN)6的主要作用是抗结剂,K4Fe(CN)6是由_________种元素组成的。
(3)由图2可知,下列说法不正确的是_________(填字母序号)。
A. 该省份人均每日摄入食盐的量超过了国家推荐的标准
B. 我国对食盐摄入量的推荐标准高于世界卫生组织(WHO)推荐的国际标准
C. 无论是城市居民还是农村居民,都是年龄越大,人均每日摄入食盐越少
D. 在图示的每个年龄段中,农村居民的人均每日食盐摄入量都比城市居民多
(4)低钠盐既保证了调味需求,还有利于防治高血压,原因是_________。
(5)依据表1,你建议外卖小哥在炎热的夏天选用的盐是_________。
【生产实际分析】
17. (2分)二十一世纪是钛的世纪。利用钛白粉(TiO2)生产海绵钛(Ti)的过程如下:
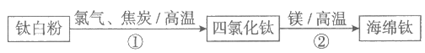
(1)①中的反应为TiO2+2Cl2+2C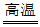 TiCl4+2CO,若有80 t,TiO2参与反应,理论上参加反应的碳的质量为_________t。
TiCl4+2CO,若有80 t,TiO2参与反应,理论上参加反应的碳的质量为_________t。
(2)②中发生置换反应的化学方程式为_________。
18. (3分)双氧水脱硫处理烟气(含SO2),并用铝灰(主要成分为Al、Al2O3)制备硫酸铝的主要工艺流程如下:
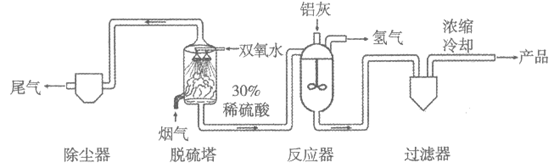
注:除尘器的作用为除去悬浮在气体中的粉尘。
(1)脱硫塔中,双氧水(H2O2溶液,H2O2中O为-1价)脱硫过程发生的反应主要有:
①SO2+H2O=H2SO3
②H2O2+H2SO3=H2SO4+H2O
反应①和②中化合价均未发生变化的元素为_________。
(2)反应器中,生成氢气的原因是_________(用化学方程式解释)。
(3)上述流程中,烟气经过脱硫塔和_________设备的处理,减少了其对环境的污染。
【基本实验及原理分析】
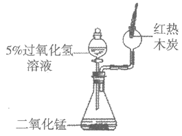
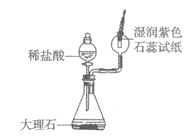
19. (2分)请从19-A或19-B两题中任选1个作答,若两题均作答,按19-A计分。图中装置的夹持仪器略去。
19-A用下图装置研究氧气 | 19-B用下图装置研究二氧化碳 |
|
|
(1)滴入过氧化氢溶液后,锥形瓶中发生反应的化学方程式为_________。 (2)木炭在氧气中燃烧时,现象是_________。 | (1)滴入稀盐酸后,锥形瓶中发生反应的化学方程式为_________。 (2)石蕊试纸处的现象是_________。 |
20. (2分)小明用下图装置进行实验。向充满二氧化碳的三个软质塑料瓶中分别注入等体积的饱和氢氧化钠溶液、饱和石灰水、水,立即拧紧瓶塞,振荡,观察现象。
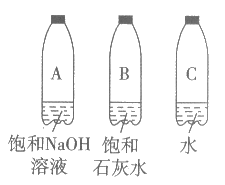
(1)振荡B瓶的过程中观察到的现象是_________。
(2)小明观察到A瓶比C瓶变瘪得更明显,原因是_________。
21. (2分)已知:红磷的着火点为240℃,白磷的着火点为40℃。
用下图所示装置进行实验(夹持仪器略去),加热b处、c处的正中间,当b处白磷燃烧时,a处白磷和c处红磷均不燃烧。
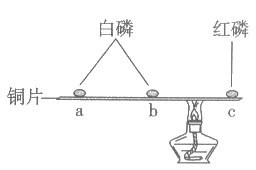
(1)实验中利用了铜的性质是_________。
(2)能验证”可燃物燃烧温度需要达到着火点”的现象是_________(填字母序号)。
A. b处白磷燃烧,a处白磷不燃烧
B. b处白磷燃烧,c处红磷不燃烧
C. a处白磷不燃烧,c处红磷不燃烧
22. (3分)同学们通过下图实验研究氢氧化钙的性质。
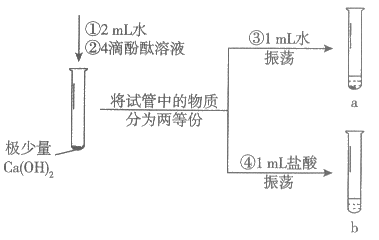
(1)Ca(OH)2属于_________(填”酸”、”碱”或”盐”)。
(2)观察到试管a中有固体剩余,加热后固体_________(填”消失”或”不消失”)。
(3)观察到试管b中固体消失、红色溶液变为无色,发生反应的化学方程式为_________。
23. (3分)某实验小组用足量稀盐酸分别与等浓度的碳酸钠溶液和碳酸氢钠溶液反应,实验装置和测得数据如下图所示。
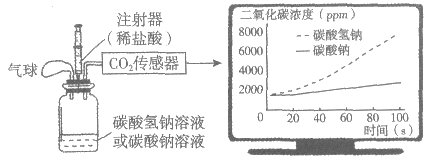
(1)写出碳酸氢钠与稀盐酸反应的化学方程式:__________。
(2)小组同学分析后,得出实验结论:相同条件下,两种碳酸盐和同样的稀盐酸反应时,碳酸氢钠产生气体的速率比碳酸钠要快。通过图像分析,你的理由是_________;除图像证据外,还可以通过比较相同时间内_________(填写1个实验现象)的差异得出结论。
【科学探究】
24. (6分)某小组同学用下图所示装置做氧化铜与稀盐酸反应的兴趣实验,发现有的同学得到蓝色溶液,有的同学得到绿色溶液。老师提示这种现象可能与所得氯化铜溶液有关。于是,同学们对这个现象进行探究。
实验1:探究影响氯化铜溶液颜色的因素
取溶质质量分数不同的氯化铜溶液各20 mL置于同样的烧杯中,分别放入不同温度的水浴箱中加热(忽略溶剂蒸发)。待溶液温度恒定后,观察溶液颜色,记录如下:
烧杯编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
溶质质量分数/% | 5 | 5 | 5 | 10 | 10 | 10 | 20 | 20 | 20 |
水浴箱温度/℃ | 30 | 50 | 70 | 30 | 50 | 70 | 30 | 50 | 70 |
溶液颜色 | 浅蓝 | 浅蓝 | 蓝 | 蓝 | 蓝绿 | 翠绿 | 蓝绿 | 翠绿 | 墨绿 |
实验2:探究室温下氯化铜溶液的变色浓度范围
a. 室温下,称取15.4 g氯化铜固体溶于35.0 g水中,配制成溶质质量分数约为30.6%的氯化铜溶液。
b. 将上述氯化铜溶液依次加入等质量的水稀释,配制成不同溶质质量分数的氯化铜溶液,观察溶液颜色,记录如下:
溶质质量分数/% | 30.6 | 25.5 | 21.9 | 19.2 | 17.0 | 15.3 |
溶液颜色 | 深绿 | 翠绿 | 蓝绿 | 蓝绿 | 蓝 | 浅蓝 |
【结果与讨论】
(1)氧化铜和稀盐酸反应的化学方程式为__________。
(2)实验1中,④⑤⑥的实验目的是__________。
(3)根据实验1的结果可知,③⑥⑨中影响氯化铜溶液颜色的因素是__________。
(4)实验2中,步骤a中用到的玻璃仪器有量筒、滴管、玻璃棒和__________。
【反思与评价】
(5)室温下,小文将20 g氯化铜固体溶于80 g水中,则此溶液的颜色为__________。
(6)小昕配制了一杯质量分数为12%的氯化铜溶液,溶液为浅蓝色,若要使此溶液由蓝向绿色转变,可进行的操作有__________(填字母序号)。
A. 将溶液放在水浴箱中加热到70℃
B. 加入适量的氯化铜固体并使之溶解
C. 加入适量的水稀释
参考答案
第一部分 选择题(共12分)
(每小题只有1个选项符合题意,共12个小题,每小题1分,共12分)
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
答案 | D | A | A | B | A | B | D | D | C | C | D | B |
第二部分 非选择题(共33分)
〖生活现象解释〗
13. (1分)

14.(2分)
(1)A
(2)Fe2O3 + 3CO 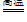
2Fe + 3CO2
15.(2分)
(1)B
(2)NaClO + CO2 + H2O = NaHCO3 + HClO
〖科普阅读理解〗
16. (5分)
(1)食盐
(2)4
(3)C
(4)加入KCl代替部分氯化钠,KCl有咸味;且可达到减钠增钾的效果
(5)深井岩盐
〖生产实际分析〗
17. (2分)
(1)24
(2)TiCl4 + 2Mg 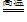
2MgCl2 + Ti
18. (3分)
(1)氢(H)
(2)2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑
(3)除尘(器)
〖基本实验及原理分析〗
19. (2分)
19-A(1)2H2O2  2H2O + O2↑
2H2O + O2↑
(2)木炭剧烈燃烧、发出白光、放热
19-B(1)CaCO3 + 2HCl = CaCl2 + CO2↑+ H2O
(2)紫色石蕊试纸变为红色
20. (2分)
(1)澄清石灰水变浑浊(澄清石灰水先变浑浊,后又变澄清)、瓶子变瘪
(2)氢氧化钠和二氧化碳发生了反应(氢氧化钠吸收了二氧化碳)
或等体积的氢氧化钠溶液比水吸收二氧化碳的量多
21. (2分)
(1)导热性良好
(2)AB
22. (3分)
(1)碱
(2)不消失
(3)Ca(OH)2 + 2HCl = CaCl2 + 2H2O
23. (3分)
(1)NaHCO3 + HCl = NaCl + H2O +CO2↑
(2)相同时间内,产生二氧化碳浓度,碳酸氢钠大于碳酸钠
气球体积、产生气泡多少(快慢)(填写1点即可)
〖科学探究〗
24. (6分)
(1)CuO + 2HCl = CuCl2 + H2O
(2)探究温度是否是影响氯化铜溶液颜色的因素之一
(3)溶液浓度(或溶质质量分数)
(4)烧杯
(5)蓝绿色
(6)AB