本试卷共100分。考试时长90分钟。
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S 32
第一部分 (选择题 共42分)
本部分共14小题,每小题3分,共42分。在每小题列出的4个选项中,选出最符合题目要求的一项。
1. 下列自然现象发生或形成的过程中,指定元素既没有被氧化又没有被还原的是
|
|
|
|
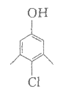
A. 溶洞——钙 | B. 闪电——氮 | C. 火山喷发——硫 | D. 光合作用——碳 |
2. 下列说法不正确的是
A. 乙二醇的沸点比乙醇的沸点高
B. 淀粉和蔗糖水解的最终产物中均含有葡萄糖
C. 植物油通过催化加氢可转变为半固态的脂肪
D. 硫酸铵或氯化钠溶液都能使蛋白质发生变性
3. 下列离子方程式正确的是
A. 溴化亚铁溶液中通入过量氯气:2Fe2++4Br–+3Cl2=2Fe3++2Br2+6Cl–
B. 硫酸中加入少量氢氧化钡溶液:H++SO42-+Ba2++OH–=BaSO4↓+H2O
C. 苯酚钠溶液中通入少量二氧化碳:2C6H5O–+CO2+H2O→2C6H5OH+CO32-
D. 硝酸银溶液中加入过量氨水:Ag++NH3·H2O=AgOH↓+NH4+
4. 除去下列物质中含有的少量杂质(括号内为杂质),所选试剂不正确的是
A. Cl2(HCl):饱和食盐水、浓硫酸
B. AlCl3溶液(Fe3+):氨水、盐酸
C. C2H2(H2S):CuSO4溶液、碱石灰
D. NaCl溶液(SO42-):BaCO3、盐酸
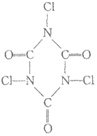
5. 关于下列消毒剂的有效成分的分析错误的是
A. 双氧水 | B. 漂白粉 | C. 滴露 | D. 强氯精 | |
有效成分 | H2O2 | Ca(ClO)2 |
|
|
分析 | 可与NaClO 发生反应 | 可用Cl2与 Ca(OH)2制备 | 分子式为 C8H9OCl | 分子中有2种环境的碳原子 |
6. 短周期中8种元素a~h,其原子半径、最高正化合价或最低负化合价随原子序数递增的变化如图所示。
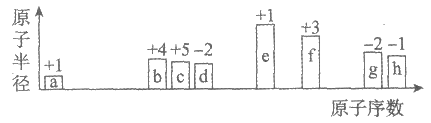
下列判断不正确的是
A. a、d、f组成的化合物能溶于强碱溶液
B. a可分别与b或c组成含10个电子的分子
C. e的阳离子与g的阴离子具有相同的电子层结构
D. 最高价氧化物对应水化物的酸性:h>g>b
7. 下图为用惰性电极电解制备高锰酸钾的装置示意图。下列说法正确的是
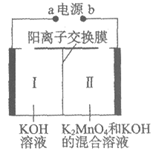
A. a为电源正极
B. I中的K+通过阳离子交换膜移向Ⅱ
C. 若不使用离子交换膜,KMnO4的产率可能会降低
D. 若阴极产生0.2 mol气体,理论上可得到0.2 mol KMnO4
8. 下列指定微粒的个数比不是2:1的是
A. 过氧化钠固体中的阳离子和阴离子
B. 碳酸钠溶液中的阳离子和阴离子
C. 乙烯和丙烯混合气体中的氢原子和碳原子
D. 二氧化氮溶于水时,被氧化的分子和被还原的分子
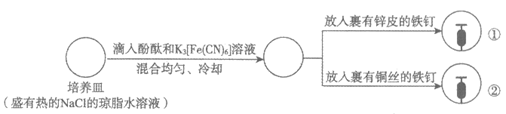
9. 下列根据实验操作及现象进行的分析和推断中,不正确的是
操作 |
|
现象 | 一段时间后:①中,铁钉裸露在外的附近区域变红;
|
A. NaCl的琼脂水溶液为离子迁移的通路
B. ①中变红是因为发生反应2H++2e–=H2↑,促进了水的电离
C. ②中可观察到铁钉裸露在外的附近区域变蓝,铜丝附近区域变红
D. ①和②中发生的氧化反应均可表示为M-2e–=M2+(M代表锌或铁)
10. 25℃时,向10 mL物质的量浓度均为0.1 mol·L-1 的HCl和CH3COOH混合溶液中滴加0.1 mol·L-1 NaOH溶液,下列有关溶液中粒子浓度关系正确的是
A. 未加NaOH溶液时:c(H+)>c(Cl–)=c(CH3COOH)
B. 加入10 mL NaOH溶液时:c(OH–)+c(CH3COO–)=c(H+)
C. 加入NaOH溶液至pH=7时:c(Cl–)=c(Na+)
D. 加入20 mL NaOH溶液时:2c(Na+)=c(Cl–)+c(CH3COO–)+c(CH3COOH)
11. 氨基甲酸铵(H2NCOONH4)是一种氨化剂,易水解,难溶于CCl4。某小组设计下图所示装置制备氨基甲酸铵。已知:2NH3(g)+CO2(g) H2NCOONH4(s) △H<0。
H2NCOONH4(s) △H<0。
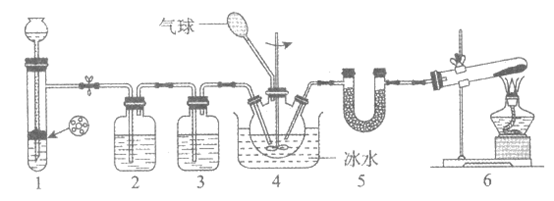
下列分析不正确的是
A. 2中的试剂为饱和NaHCO3溶液
B. 冰水浴能提高H2NCOONH4的产率
C. 1和4中发生的反应均为非氧化还原反应
D. 5中的仪器(含试剂)可用3中仪器(含试剂)代替
12. 图a~c分别为氯化钠在不同状态下的导电实验(X、Y均表示石墨电极)的微观示意图。
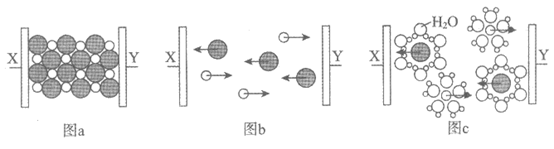
下列说法不正确的是
A. 图示中的●代表的离子的电子式为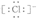
B. 图a中放入的是氯化钠固体,该条件下不导电
C. 能导电的装置中,X上均有气体产生
D. 能导电的装置中,Y的电极产物相同
13. 800℃时,三个恒容密闭容器中发生反应CO(g)+H2O(g) CO2(g)+H2(g)K=1.0,一段时间后,分别达到化学平衡状态。
CO2(g)+H2(g)K=1.0,一段时间后,分别达到化学平衡状态。
容器编号 | 起始浓度/(mol·L-1) | |||
c(CO) | c(H2O) | c(CO2) | c(H2) | |
I | 0.01 | 0.01 | 0 | 0 |
II | 0 | 0 | 0.01 | 0.01 |
III | 0.008 | 0.008 | 0.002 | 0.002 |
下列说法不正确的是
A. Ⅱ中达平衡时,c(H2)=0.005 mol·L-1
B. Ⅲ中达平衡时,CO的体积分数大于25%
C. Ⅲ中达到平衡状态所需的时间比I中的短
D. 若Ⅲ中起始浓度均增加一倍,平衡时c(H2)亦增加一倍
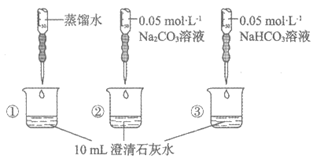
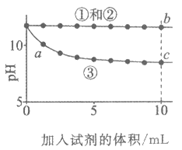
14. 实验小组利用传感器探究Na2CO3和NaHCO3的性质。
实验操作 | 实验数据 |
测量下述实验过程的pH变化
|
|
下列分析不正确的是
A. ①与②的实验数据基本相同,说明②中的OH–未参与该反应
B. 加入试剂体积相同时,②所得沉淀质量等于③所得沉淀质量
C. 从起始到a点过程中反应的离子方程式为:
Ca2++2OH–+2HCO3–=CaCO3↓+2H2O+CO32-
D. b点对应溶液中水的电离程度小于c点对应溶液中水的电离程度
第二部分 (综合题 共58分)
本部分共5小题,共58分。
15. (11分)甲烷水蒸气重整制取的合成气可用于熔融碳酸盐燃料电池。
(1)制取合成气的反应为CH4(g)+H2O(g) CO(g)+3H2(g) △H=+206 kJ/mol。
CO(g)+3H2(g) △H=+206 kJ/mol。
向体积为2 L恒容密闭容器中,按n(H2O)/n(CH4)=1投料:
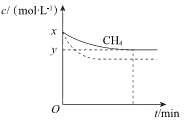
a. 保持温度为T1时,测得CH4(g)的浓度随时间变化曲线如图1所示。
b. 其他条件相同时,在不同催化剂(I、Ⅱ、Ⅲ)作用下,反应相同时间后,CH4的转化率随反应温度的变化如图2所示。
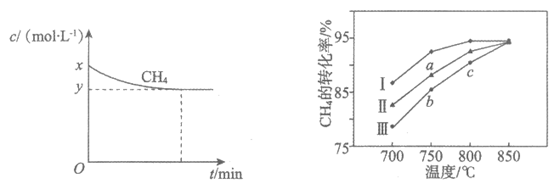
图1 图2
①结合图1,写出反应达平衡的过程中的能量变化:_________kJ。
②在图1中画出:起始条件相同,保持温度为T2(T2>T1)时,c(CH4)随时间的变化曲线。
③根据图2判断:
i. a点所处的状态不是化学平衡状态,理由是_________。
ii. CH4的转化率:c>b,原因是_________。
(2)熔融碳酸盐燃料电池的结构示意图如下。
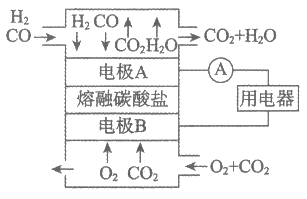
①电池工作时,熔融碳酸盐中CO32-移向_________(填”电极A”或”电极B”)。
②写出正极上的电极反应式:_________。
(3)若不考虑副反应,1 kg甲烷完全转化所得到的合成气全部用于燃料电池中,外电路通过的电子的物质的量最大为_________mol。
16. (10分)氯化亚铜(CuCl)可用于冶金、电镀等行业,其制备的一种工艺流程如下:
I. 溶解:取海绵铜(主要含Cu和CuO),加入稀硫酸和NH4NO3的混合溶液,控制溶液温度在60~70℃,不断搅拌至固体全部溶解,得蓝色溶液(过程中无气体产生);
Ⅱ. 转化:向蓝色溶液中加入(NH4)2SO3和NH4Cl,充分反应后过滤,得到CuCl粗品;
Ⅲ. 洗涤:CuCl粗品依次用pH=2硫酸和乙醇洗涤,烘干后得到CuCl产品。
【资料】CuCl固体难溶于水,与Cl–反应生成可溶于水的络离子[CuCl2]–;
潮湿的CuCl固体露置于空气中容易被氧化。
(1)过程I中:
①本工艺中促进海绵铜溶解的措施有___________。
②氧化铜溶解的离子方程式是___________。
③充分反应后NH4+的浓度约为反应前的2倍,原因是___________。
(2)过程Ⅱ中:
①(NH4)2SO3的作用是___________。
②NH4Cl的用量对铜的沉淀率的影响如下图所示。
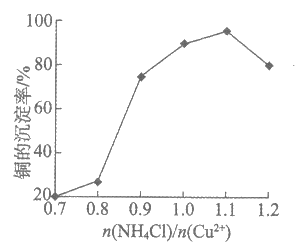
n(NH4Cl)/n(Cu2+)>1.1时,铜的沉淀率下降的原因是___________(用离子方程式表示)。
(3)过程Ⅲ中,用乙醇洗涤的目的是___________。
(4)产品纯度测定:称取CuCl产品a g于锥形瓶中,加入足量的酸性Fe2(SO4)3溶液使其充分溶解,再用0.1000 mol/L KMnO4标准溶液滴定Fe2+,消耗KMnO4溶液b mL。
(本实验中的MnO4–被还原为Mn2+,不与产品中杂质和Cl–反应)。
①CuCl溶于Fe2(SO4)3溶液的离子方程式是___________。
②产品中CuCl(摩尔质量为99 g/mol)的质量分数为___________。
17. (11分)我国是世界上较早冶炼锌的国家。在现代工业中,锌更是在电池制造、合金生产等领域有着广泛的用途。
已知:锌的熔点为420℃,沸点为907℃。
I. 下图是古代以炉甘石(ZnCO3)为原料冶炼锌的示意图。
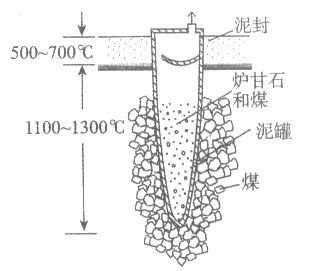
(1)泥罐内的主要反应为:
i. ZnCO3(s)=ZnO(s)+CO2(g) △H1
ii. CO2(g)+C(s)=2CO(g) △H2
……
总反应:ZnCO3(s)+2C(s)=Zn(g)+3CO(g) △H3
利用△H1和△H2计算△H3时,还需要利用________反应的△H。
(2)泥罐内,金属锌的状态变化是__________。
Ⅱ. 现代冶炼锌主要采取湿法工艺。以闪锌矿(主要成分为ZnS,还含Fe等元素)、软锰矿(主要成分为MnO2,还含Fe等元素)为原料联合生产锌和高纯度二氧化锰的一种工艺的主要流程如下:
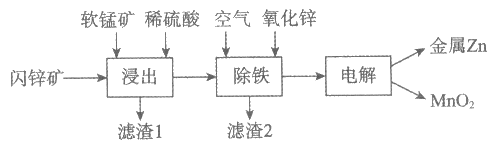
(3)浸出:加入FeSO4能促进ZnS的溶解,提高锌的浸出率,同时生成硫单质。Fe2+的作用类似催化剂,”催化”过程可表示为:
i:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O
ii:……
①写出ii的离子方程式:__________。
②下列实验方案可证实上述”催化”过程。将实验方案补充完整。
a. 向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量MnO2,溶液变红。
b. __________。
(4)除铁:
已知:①进入除铁工艺的溶液的pH约为3;
②控制溶液pH为2.5~3.5,使铁主要以FeOOH沉淀的形式除去。
结合离子方程式说明,通入空气需同时补充适量ZnO的理由是__________。
(5)电解:用惰性电极电解时,阳极的电极反应式是__________。
(6)电解后的溶液中可循环利用的物质是__________。
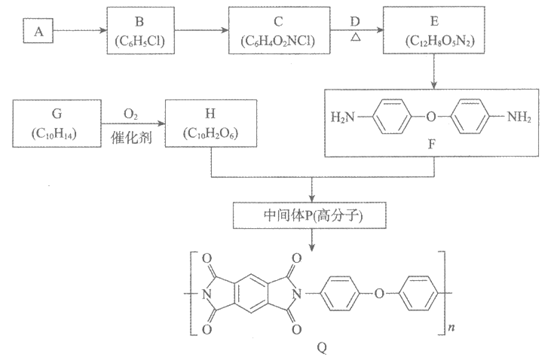
18. (15分)聚酰亚胺是一类非常有前景的可降解膜材料,其中一种膜材料Q的合成路线如下。
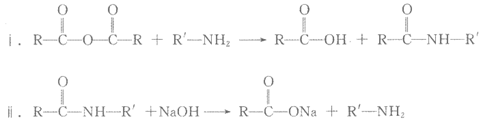
已知:
(1)A是芳香烃,A→B的化学方程式是_________。
(2)B转化为C的试剂和条件是_________。
(3)C中所含的官能团的名称是_________。
(4)D可由C与KOH溶液共热来制备。C与D反应生成E的化学方程式是_________。
(5)E→F的反应类型是_________。
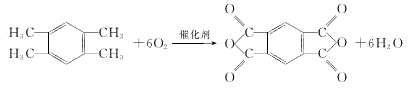
(6)G与A互为同系物,核磁共振氢谱有2组峰。G→H的化学方程式是_________。
(7)H与F生成中间体P的原子利用率为100 %,P的结构简式是_________(写一种)。
(8)废弃的膜材料Q用NaOH溶液处理降解后可回收得到F和_________(填结构简式)。
19. (11分)某小组通过分析镁与酸反应时pH的变化,探究镁与醋酸溶液反应的实质。
【实验】在常温水浴条件下,进行实验I~Ⅲ,记录生成气体体积和溶液pH的变化。
I. 取0.1 g光亮的镁屑(过量)放入10 mL 0.10 mol·L-1 HCl溶液;
Ⅱ. 取0.1 g光亮的镁屑放入10 mL 0.10 mol·L-1 CH3COOH溶液(pH=2.9);
Ⅲ. 取0.1 g光亮的镁屑放入10 mL pH=2.9的HCl溶液。
【数据】
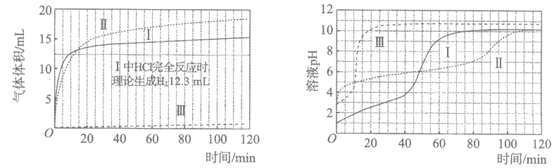
图1 图2
(1)起始阶段,I中主要反应的离子方程式是________。
(2)Ⅱ起始溶液中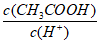 约为________(选填”1″、”10″或”102“)。
约为________(选填”1″、”10″或”102“)。
(3)起始阶段,导致I,III气体产生速率差异的主要因素不是c(H+),实验证据是________。
(4)探究Ⅱ的气体产生速率大于Ⅲ的原因。
提出假设:CH3COOH能直接与Mg反应。
进行实验Ⅳ:________。
得出结论:该假设成立。
(5)探究醋酸溶液中与Mg反应的主要微粒,进行实验V:
与Ⅱ相同的条件和试剂用量,将溶液换成含0.10 mol·L-1 CH3COOH和0.10 mol·L-1 CH3COONa的混合溶液(pH=4.8),气体产生速率与Ⅱ对比如下。
a. 实验V起始速率 | b. 实验Ⅱ起始速率 | c. 实验Ⅱ pH=4.8时速率 |
2.1 mL·min-1 | 2.3 mL·min-1 | 0.8 mL·min-1 |
对比a~c中的微粒浓度,解释a与b、a与c气体产生速率差异的原因:________。
(6)综合以上实验得出结论:
①镁与醋酸溶液反应时,CH3COOH、H+、H2O均能与镁反应产生氢气;
②________。
(7)实验反思:120 min附近,I~Ⅲ中pH均基本不变,pH(I)≈pH(Ⅱ)<pH(Ⅲ),解释其原因:________________。
参考答案
注:学生答案与本答案不符时,合理答案给分。
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
答案 | A | D | A | B | D | C | C |
题号 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
答案 | B | B | B | D | D | B | C |
15. (11分)
(1)①吸收412(x-y)
②
③i .催化剂不能改变物质的平衡转化率;750℃时,反应相同时间,a点对应的CH4的转化率低于使用I时CH4的转化率
ii. 其他条件相同时,温度升高,反应速率增大
(2)①电极A
②O2+4e– +2CO2=2CO32-
(3)500
16. (10分)
(1)①控制温度在60〜70℃、不断搅拌
②CuO+2H+=Cu2+ +H2O
③NO3–几乎全部被还原为NH4+(或写出相应的离子方程式)
(2)①还原剂
② CuCl+Cl–=[CuCl2]–
(3)去除CuCl固体表面的水,防止其被空气氧化
(4)①CuCl+Fe3+=Cu2++Fe2+ +Cl–
②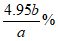 或
或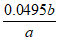
17. (11分)
(1)ZnO(s)+C(s)=Zn(g)+CO(g)
(2)气态变为液态
(3)①ZnS+2Fe3+=Zn2++2Fe2+ +S
②取a中红色溶液,向其中加入ZnS,振荡,红色褪去
(4)通入空气时,发生反应4Fe2++O2+6H2O=4FeOOH↓+8H+使溶液的pH下降,加入的ZnO与H+发生反应ZnO+2H+=Zn2++H2O,可控制溶液pH
(5)Mn2+-2e–+2H2O=MnO2+4H+
(6)硫酸
18. (15分)
(1)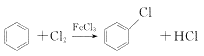
(2)浓硝酸、浓硫酸、加热
(3)氯原子(碳氯键)、硝基
(4)
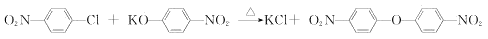
(5)还原反应
(6)
(7)
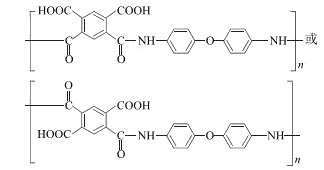
(8)
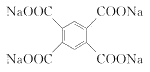
19. (11分)
(1)Mg+2H+=Mg2++H2↑
(2)102
(3)由图1可知起始阶段II的速率远大于III,但图2表明起始阶段II的pH大于III
(4)室温下,将光亮的镁屑投入冰醋酸中,立即产生气体
(5)a与b对比,c(CH3COOH)几乎相同,但b中c(H+)约为a的100倍,使速率b>a;a与c对比,c(H+)几乎相同,但a中c(CH3COOH)约为c的2倍,使速率a>c
(6)CH3COOH是与镁反应产生气体的主要微粒
(7)120 min附近,Mg(OH)2(s) Mg2+(aq)+2OH–(aq)均达到平衡状态,因此pH基本不变;c(Mg2+)I≈II>III,I、II中上述平衡相对III逆移,c(OH–)减小,PH减小
Mg2+(aq)+2OH–(aq)均达到平衡状态,因此pH基本不变;c(Mg2+)I≈II>III,I、II中上述平衡相对III逆移,c(OH–)减小,PH减小