本试卷共两部分,23道小题,满分45分。考试时间:与生物合计为90分钟。
可能用到的相对原子质量:N 14 O 16
第一部分 选择题(共12分)
每小题只有1个选项符合题意。每小题1分,共12分。
1. 下列物质与水混合,能形成溶液的是
A. 植物油 B. 面粉 C. 蔗糖 D. 牛奶
2. 下列属于纯净物的是
A. 氧化铁 B. 石灰水 C. 生理盐水 D. 石灰石
3. 下列不属于化石燃料的是
A. 煤 B. 石油 C. 沼气 D. 天然气
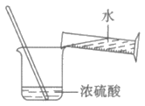
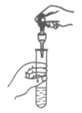
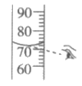
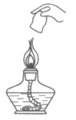
4. 下列实验操作正确的是
|
|
|
|
A. 稀释浓硫酸 | B. 滴加液体 | C. 读液体体积 | D. 熄灭酒精灯 |
5. 考古学家通过测定碳14的含量等方法,将人类生活在黄土高原的历史推前至距今212万年。碳14原子的核电荷数为6,相对原子质量为14,则该原子核外电子数为
A. 6 B. 8 C. 14 D. 20
6. 《本草纲目》中”黄连”条目下记载:”吐血不止,取黄连一两,捣碎,加鼓二十粒,水煎去渣,温服。”该过程中没有涉及的操作是
A. 加热 B. 称量 C. 过滤 D. 蒸发结晶
7. 下列金属中,与稀硫酸反应后所得溶液颜色为浅绿色的是
A. 镁 B. 铝 C. 锌 D. 铁
8. 下列物质俗称与化学式对应正确的是
A. 水银—Ag B. 烧碱—NaOH C. 小苏打—Na2CO3 D. 干冰—H2O
9. 小明点的外卖午餐是:红烧肉、清蒸鱼、米饭和矿泉水。从均衡营养的角度考虑,这份午餐缺少的营养素是
A. 糖类 B. 蛋白质 C. 维生素 D. 无机盐
10. 下列物质的用途与其化学性质相关的是
A. 水作为溶剂 B. 盐酸除去铁锈
C. 大理石用作装饰材料 D. 浓硫酸用作某些气体的干燥剂
11. 下列实验能达到实验目的的是
|
|
|
|
A. 比较同一物质在不同溶剂中的溶解性 | B. 验证分子在不断运动 | C. 比较铁、铜、银的金属活动性 | D. 验证质量守恒定律 |
12. 中国科学院科研团队研究成果表明,在常温、常压和可见光条件下,基于LDH(一种固体催化剂)合成氨气(NH3)的原理如图所示。下列说法不正确的是
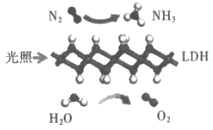
A. 四种物质中有一种属于氧化物
B. 原料气N2可通过分离液态空气获得
C. 参加反应的N2与生成的O2质量比为7:8
D. 参加反应的N2与H2O的分子个数比为1:3
第二部分 非选择题(共33分)
【生活现象解释】
13. (1分)一次性医用口罩的鼻梁夹大多选用金属铝或铁,铝、铁能压成条,说明其具有的性质是___________(填字母序号)。
A. 导热性 B. 延展性 C. 导电性
14. (3分)在新型冠状病毒肺炎疫情期间,公共场所需要经常进行消毒。75%的医用酒精和84消毒液能有效消灭病毒。
(1)酒精属于易燃物,使用酒精消毒应远离火源。酒精(C2H5OH)充分燃烧的化学方程式为___________。
(2)84消毒液属于含氯消毒剂,这里的氯指的是________(填”元素””原子”或”分子”);84消毒液的有效成分为次氯酸钠(NaClO),次氯酸钠中氯元素的化合价为___________。
15. (1分)在做家庭小实验时,将自制酸碱指示剂紫甘蓝汁加入到不同的物质中,会呈现不同的颜色。
物质 | ①水 | ②水垢清除剂 | ③肥皂水 | ④白醋 | ⑤雪碧 |
颜色 | 紫色 | 红色 | 蓝色 | 红色 | 红色 |
判断上述物质中,显酸性的有___________(填序号)。
【科普阅读理解】
16. (5分)阅读下面科普短文。
复印机、激光打印机在办公中使用很普遍。人们在使用复印机、激光打印机时,总能闻到一股刺鼻的气味。这种刺鼻的气体是什么呢?会不会对人体造成危害?
复印机、激光打印机在使用过程中,需要产生高压静电,并通过静电来吸附碳粉。高压静电则会使周围空气中的氧分子转变为原子态氧,原子态氧又与周围的氧分子结合形成臭氧(O3)。这种刺鼻的气体就是臭氧。
臭氧在常温常压下为淡蓝色气体。臭氧本身并不是空气”污染物”,少量臭氧甚至还具有消毒及灭菌的作用。空气中含微量的臭氧能够净化空气,这也是为何我们会觉得雨后的空气更清新的原因之一。此外,臭氧也是重要的高空卫士,因为臭氧层的存在,能有效阻挡紫外线,保护人类和地球上的生物不被强烈的紫外线辐射。
常温常压下,臭氧的密度是空气的1.66倍,容易在办公室的下层空间聚集。浓度较高时,臭氧会刺激人的呼吸道,造成咽喉肿痛、胸闷咳嗽等。长期接触高浓度的臭氧还可能造成人的神经中毒。臭氧还会破坏人体的免疫机能,致使人的皮肤起皱、出现黑斑。
不同品牌的复印机、激光打印机工作每小时臭氧散发率如下图。平均每小时臭氧散发率,复印机为3.3mg/h,激光打印机为0.8mg/h。
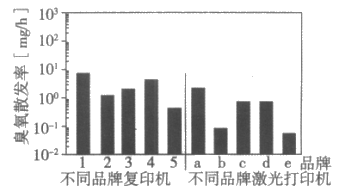
我国颁布的《大气环境标准》中,规定了臭氧最高容许浓度标准:Ⅰ级标准为0.12mg/m3;Ⅱ级标准为0.16mg/m3;Ⅲ级标准为0.2mg/m3。实际上,只有在打印社及复印店这类打印机、复印机数量较多的场所,才会产生超高浓度的臭氧。
复印机、激光打印机要尽可能放在通风良好的地方,以降低室内空间的臭氧浓度,减少对人体的危害。
依据文章内容回答下列问题。
(1)臭氧的物理性质是___________(写出一条)。
(2)人们感觉雨后空气格外清新的原因可能是___________。
(3)写出氧气转化为臭氧的化学方程式___________。
(4)分析上图可以得到的结论是___________(写出一条)。
(5)下列说法正确的是___________(填字母序号)。
A. 臭氧会在办公室上层空间聚集
B. 高空中的臭氧层能使地球上的生物免受紫外线危害
C. 臭氧在少量时能用于消毒,在浓度较高时会使人致病
D. 应尽量将激光打印机、复印机放在通风良好的地方使用
【生产实际分析】
17. (2分)工业上用高温煅烧氢氧化铝制备氧化铝。氢氧化铝在回转窑经高温煅烧,反应过程中产生烟气的主要成分是氧化铝、氮氧化物等。回收氧化铝、降低氮氧化物排放的烟气净化流程如下图所示。
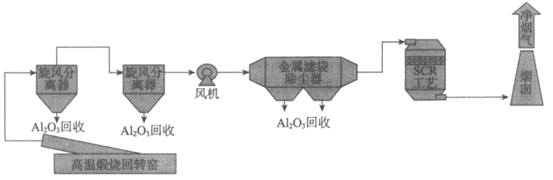
(1)旋风分离器和金属滤袋除尘器的作用是分离并得到烟气中的氧化铝,该过程发生的变化是___________(填”物理”或”化学”)变化。
(2)SCR工艺中反应的化学方程式为6NO2+8NH3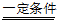 7X+12H2O,其中X是___________(填化学式)。
7X+12H2O,其中X是___________(填化学式)。
18. (3分)以工业CuO(含少量FeO)、工业盐酸(含少量稀硫酸)为原料,生产CuCl2·2H2O的工艺流程如下。
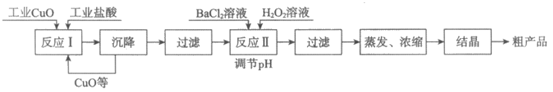
(1)反应Ⅰ中发生了金属氧化物与酸的反应,化学方程式为___________(写一个即可)。
(2)为了加快反应Ⅰ中的反应速度,可以适当加热,但是温度不能过高,原因是___________。
(3)反应Ⅱ中发生的3个反应为:
①FeSO4+BaCl2=BaSO4↓+FeCl2;
②C1aSO4+BaCl2=BaSO4↓+CuCl2;
③2FeCl2+H2O2+4H2O=2Fe(OH)3↓+4HCl,
其中属于复分解反应的是___________(填序号)。
【基本实验及其原理分析】
19. (2分)用下图装置制取氧气并做木炭在氧气中燃烧的实验。
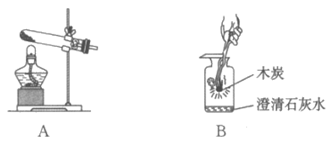
(1)用A装置制取氧气的化学方程式是___________。
(2)B实验中澄清石灰水的作用是___________。
20. (3分)用下图装置进行实验。已知:白磷的着火点为40℃。
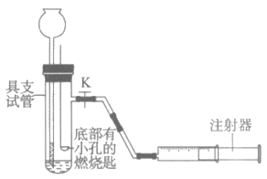
(1)关闭K,向长颈漏斗中注入蒸馏水,至漏斗下端导管有一段水柱时,停止注水(如图所示),若___________,则说明装置气密性良好。取下胶塞,倒出具支试管内的水。
(2)取黄豆粒大的白磷,将其固定在燃烧匙上,白磷不燃烧,原因是___________。
(3)打开K,沿长颈漏斗倒入70℃热水至没过白磷,白磷不燃烧。若使白磷燃烧,可进行的操作是___________。
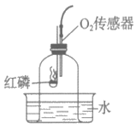
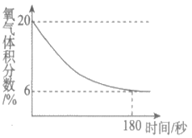
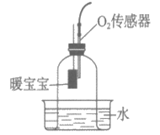
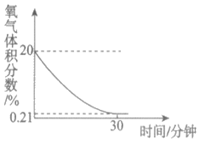
21. (3分)化学小组用下图所示装置完成实验。实验前,实验①和实验②的密闭装置内空气体积相等;所用红磷和暖宝宝均为足量。
实验序号 | 实验装置 | 氧气含量随时间的变化图 |
① |
|
|
② |
|
|
(1)实验①中,红磷燃烧的化学方程式为___________。
(2)依据实验①、②所得图像对比分析:利用红磷燃烧测定空气中氧气含量,该实验的不足之处是___________;课上通常不用暖宝宝代替红磷完成该实验的原因是___________。
22. (4分)用下图所示装置(气密性良好)验证氢氧化钠的性质。已知:碳酸钠溶液显碱性。
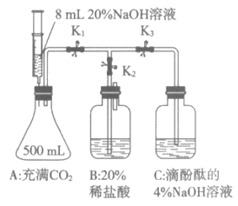
(1)实验时,关闭K1、K2和K3,先将注射器中少量(约2mL)20%的NaOH溶液缓慢推入A中后停止推动活塞,剩余的NaOH溶液能够自动吸入A中,产生该现象的原因是___________。
(2)打开K1、K3,能观察到C中溶液进入A中,C中导管下端露出液面。
(3)再打开K2,B中溶液进入A和C。能证明A中二氧化碳与氢氧化钠反应生成新物质的现象是___________;能证明氢氧化钠与盐酸反应的现象是___________,反应的化学方程式为___________。
【科学探究】
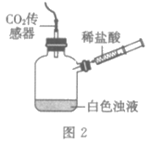
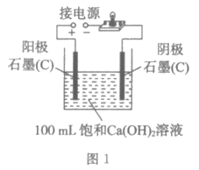
23. (6分)实验小组同学验证Ca(OH)2溶液导电性的实验装置如图1所示。实验观察到灯泡变亮的同时,两个电极上均有气体产生,且阳极附近出现了白色浑浊。小组同学对白色浑浊物的成分进行了如下探究。
【猜想一】甲同学认为:白色浑浊物是Ca(OH)2。
【实验一】为了验证甲同学的猜想,进行如下实验。
取少量白色浊液于试管中,加入足量水,充分振荡,观察到仍有白色浑浊。
【猜想二】乙同学认为:白色浑浊物中含有CaCO3。
【实验二】为了验证乙同学的猜想,进行如下实验。
取少量白色浊液于试管中,滴加稀盐酸,白色浑浊消失,没有观察到有气泡产生。
【实验三】为了进一步验证乙同学的猜想,进行如下实验。
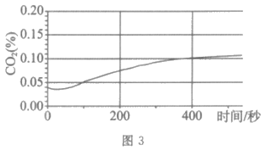
实验装置图 | 实验操作 | 实验现象 |
| 将注射器内稀盐酸推入瓶中,并用二氧化碳传感器测得装置内二氧化碳的体积分数 | Ⅰ. 白色浑浊消失,没有观察到有气泡产生 Ⅱ. 检测到二氧化碳含量随时间的变化如下图所示
|
【解释与结论】
(1)用石墨电极验证Ca(OH)2溶液的导电性实验时,两个电极上产生大量气体,发生的是电解水的反应,写出反应的化学方程式___________。
(2)甲同学提出白色浑浊物是Ca(OH)2的理由是___________。
(3)由实验三能得出的结论是___________,相关反应的化学方程式为___________。
【反思与交流】
(4)实验二中没有观察到明显气泡的可能原因是___________。
(5)丙同学为了进一步探究白色浑浊物产生的原因,用铂(Pt)电极代替石墨(C)电极完成图1所示实验,其目的是______________________。
【试题答案】
第一部分 选择题(共12分)
(每小题只有1个选项符合题意。每小题1分,共12分。)
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
答案 | C | A | C | D | A | D | D | B | C | B | D | C |
第二部分 非选择题(共33分)
说明:以下每空1分。其他合理答案均可给分。
13. (1分)B
14.(3分)(1)C2H5OH+3O2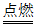 2CO2+3H2O (2)元素 +1
2CO2+3H2O (2)元素 +1
15. (1分)②④⑤
16. (5分)(1)常温常压下,为淡蓝色气体(或有刺鼻的气味;或常温常压下密度是空气的1.66倍)
(2)空气中含微量的臭氧能够净化空气
(3)3O2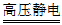 2CO3
2CO3
(4)使用不同品牌的复印机每小时臭氧散发率不同(或使用不同品牌的激光打印机每小时臭氧散发率不同;或复印机平均每小时臭氧散发率高于激光打印机平均每小时臭氧散发率)
(5)BCD
17. (2分)(1)物理 (2)N2
18. (3分)(1)CuO+2HCl=CuCl2+H2O(或FeO+2HCl=FeCl2+H2O)
(2)盐酸易挥发,温度越高,挥发越快
(3)①②
19.(2分)(1)2KMnO4 K2MnO4+MnO2+O2↑ (2)检验木炭燃烧生成的CO2
K2MnO4+MnO2+O2↑ (2)检验木炭燃烧生成的CO2
20. (3分)(1)一段时间内,水柱不下降 (2)温度没有达到白磷的着火点
(3)向上抽拉燃烧匙,使白磷露出水面(或推动注射器将试管内的水压入长颈漏斗中,至白磷露出水面)
21.(3分)(1)4P+5O2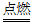 2P2O5 (2)仍有部分氧气残留,导致所测结果不准 耗时较长
2P2O5 (2)仍有部分氧气残留,导致所测结果不准 耗时较长
22. (4分)(1)CO2与NaOH溶液反应而消耗,使A中气压低于外界大气压,NaOH溶液被压入
(2)A中有气泡产生 C中红色溶液褪为无色NaOH+HCl=NaCl+H2O
23.(6分)(1)2H2O 2H2↑+O2↑
2H2↑+O2↑
(2)Ca(OH)2溶液已经饱和,水因反应而被消耗,使体系内水减少,导致Ca(OH)2析出
(3)白色浑浊物中有CaCO3 CaCO3+2HCl=CaCl2+H2O+CO2↑
(4)CaCO3的含量较少,使反应生成的CO2太少,没有逸出
(5)探究白色浑浊物的产生与石墨电极有关