本试卷共两部分,23道小题,满分45分。考试时间:与生物合计90分钟。
可能用到的相对原子质量:H 1 C 12 O 16 Fe 56
第一部分 选择题(共12分)
每小题只有1 个选项符合题意。每小题1分,共12分。
1. 下列中华传统活动中,发生了化学变化的是



A. 剪纸 B. 粮食酿酒 C. 编中国结 D. 捏泥人
2. 下列符号表示2个氧原子的是
A.2O2 B.O2 C.H2O2 D.2O
3. 下列人体必需的元素中,缺乏会引起贫血的是
A.钙 B.铁 C.锌 D.钠
4. 能够闻到茶香的原因是
A.分子之间有间隔 B.分子在不断运动
C.分子的质量和体积都很小 D.分子是由原子构成的
5. 如图所示,将二氧化碳缓慢倒入烧杯中,蜡烛熄灭的主要原因是
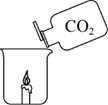
A.隔绝空气
B.移走可燃物
C.降低蜡烛的着火点
D.降低温度到蜡烛的着火点以下
6. 将下列金属投入到硫酸铜溶液中,不能发生置换反应的是
A. 锌 B. 铁 C. 银 D. 镁
7.下列金属中,能够使紫色石蕊溶液变为蓝色的是
A. 石灰水 B. 食盐水 C.稀盐酸 D. 蒸馏水
8. 根据化学方程式:S + O2
 SO2,无法获取的信息是
SO2,无法获取的信息是
A.反应条件是点燃
B. 反应物是硫和氧气
C.二氧化硫有刺激性气味
D. 参加反应的氧气与生成的二氧化硫分子个数比为1:1
9. 下列关于空气的说法不正确的是
A. 空气是由氧气和氮气组成的 B. 空气是混合物
C. 空气是一种宝贵资源 D. 空气中氮气的体积分数约为78%
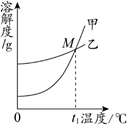
10. K2CO3和KNO3在不同温度时的溶解度及其溶解度曲线如下。下列说法不正确的是
| | | | | | |
| | | | | | |
| | | | | | |
A.碳酸钾溶液中的溶剂是水
B.甲是硝酸钾的溶解度曲线
C.t1℃时,两种物质的溶解度相等
D.t1℃应在50℃~60℃之间
11. 氨气可转化为尿素,其反应前后分子种类变化的微观示意图如下。下列说法不正确的是
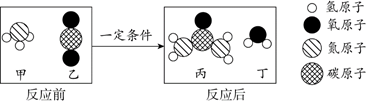
A. 乙是CO2 B.反应前后原子种类和个数都不变
C.甲、丁中都含有氢元素 D.参加反应的甲与生成的丙分子个数比为1:1
 12. 过氧乙酸(CH3CO3H)是一种光谱高效消毒剂,不稳定,常温下易分解。制备过氧乙酸的化学方程式为:CH3COOH + H2O2 ==== CH3CO3H + H2O。取质量相等的乙酸(CH3COOH)和50% H2O2溶液均匀混合,再加入适量浓硫酸。一定条件下,测得溶液中过氧乙酸质量分数的数据如下图。下列说法不正确的是
12. 过氧乙酸(CH3CO3H)是一种光谱高效消毒剂,不稳定,常温下易分解。制备过氧乙酸的化学方程式为:CH3COOH + H2O2 ==== CH3CO3H + H2O。取质量相等的乙酸(CH3COOH)和50% H2O2溶液均匀混合,再加入适量浓硫酸。一定条件下,测得溶液中过氧乙酸质量分数的数据如下图。下列说法不正确的是
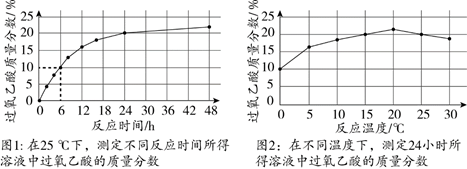
A.过氧乙酸中C、H元素的质量比为6:1
B. 图1中,反应时间为6 h时,若溶液总质量为100 g,其中含有10 g过氧乙酸
C. 图2中,与20℃相比,25℃时溶液中过氧乙酸质量分数下降的可能原因是温度升高,过氧乙酸分解得更多
D.综合图1和图2分析,制备过氧乙酸的最佳反应时间为24 h,最佳反应温度为25℃
第二部分 非选择题(共33分)
【生活现象解释】
13.(2分)汽车能源结构在不断优化。
(1)汽车燃料中的汽油和柴油是由石油炼制而得,石油、天然气和______都属于化石燃料。
(2)一种氢燃料电池汽车利用氢气和氧气在铂(Pt)的催化作用下发生反应,将化学能转化为电能驱动汽车。写出该反应的化学方程式_________。
14. (1分)据记载,我国是最早使用陶器的国家。制陶的原料是黏土,其主要成分是SiO2、MgO、Al2O3 和 CaCO3等,其中不属于氧化物的是_______。

15.(2分)一种自热食品的发热包中主要含有生石灰,纯碱和铝粉。
(1)纯碱是________(填化学式)的俗称。
(2)发热包与水接触后发生反应,写出其中一个反应的化学方程式____________。
【科普阅读理解】
16.(5分)阅读下面科普短文。
芦笋具有很高的营养价值和保健功能,被人们称为”蔬菜之王”。
芦笋中富含维生素C。维生素C(C6H8O6)的含量是植物营养成分的重要指标。科研人员测定不同品种、不同部位的芦笋中维生素C含量及不同贮藏条件下维生素C含量的变化。维生素C易溶于水,易被光、热和氧气等破坏。因此,在测定芦笋中维生素C含量时,应采摘后立即测定,且整个实验过程需要快速。
采摘3个品种的芦笋,立即测定不同部位[同一株芦笋分成上(笋尖)、中、下段]芦笋中维生素C的含量如图1所示。
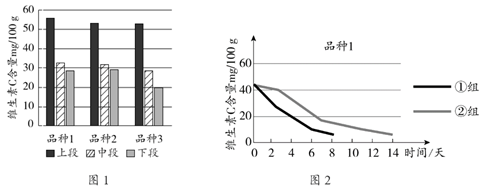
选取品种1,探究贮藏条件对芦笋中维生素C含量的影响。同一天采摘同一试验区的芦笋产品,选取同一部位样品,立即测定其中维生素C含量,并随机分成2组,第①组在室温(25℃左右)自然漫射光下保存;第②组在冰箱(4℃)中避光保存。每2天分别测定每组芦笋样品中的维生素C含量,测定结果如图2所示。芦笋的营养和保健功能使其具有很高的食用价值。每1kg鲜芦笋中含有蛋白质25g,高于普通蔬菜3~8倍。芦笋中碳水化合物和脂肪的含量偏低,富含纤维素、多种维生素和微量元素,尤其含有丰富的抗癌元素-硒,被视为一种保健食品。
依据文章内容回答下列问题。
(1)维生素C是由_______种元素组成。
(2)在测定植物中维生素C含量时,应采摘后立即测定,原因是__________。
(3)分析图2,请给出芦笋保存和食用的建议是__________。
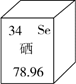
(4)芦笋中所含硒元素在元素周期表中的信息如图,由图可以获得的信息是________(写出一条)。
(5)下列说法正确的是________(填字母序号)。
- 品种2与品种3笋尖中维生素C含量基本相等
- 芦笋中嫩尖部比根部维生素C含量高
- 芦笋中富含碳水化合物和脂肪
【生产实际分析】
17.(2分)煤燃烧的烟气经空气反应器脱硫后,产物硫酸钙进入燃料反应器中与甲烷在一定条件下反应,气体产物分离出水后得到几乎不含杂质的二氧化碳,从而有利于二氧化碳的回收利用,达到减少碳排放的目的。该流程如图所示。
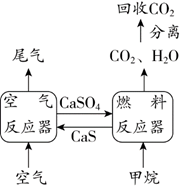
(1)已知空气反应器中发生的一个反应为:
2CaCO3 + 2SO2 + O2
 2CaSO4 + 2CO2,其中化合价发生变化的元素有___________。
2CaSO4 + 2CO2,其中化合价发生变化的元素有___________。(2)燃料反应器中反应的化学方程式为_____________。
18.(3分)还原铁粉是化工生产及实验室中常用的还原剂。工业上以绿矾(FeSO4·7H2O)为原料制备还原铁粉的工艺流程见图1。
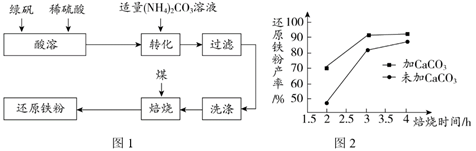
(1)转化时,将(NH4)2CO3溶液加入到FeSO4溶液中,目的是制得FeCO3。
(2)将FeCO3浊液暴露在空气中,反应的化学方程式为:
4FeCO3
+ 6H2O + O2
= 4Fe(OH)3 + 4X,其中X是_____。
(3)焙烧时,发生的反应有:①2Fe(OH)3
 Fe2O3 + 3H2O↑;
Fe2O3 + 3H2O↑;
②CO2
+ C 2CO;
2CO;
③3CO + Fe2O3
 2Fe + 3CO2,其中属于分解反应的是________(填序号)。
2Fe + 3CO2,其中属于分解反应的是________(填序号)。(4)在焙烧过程中需加入CaCO3进行脱硫处理。图2为加CaCO3和不加CaCO3对还原铁粉产率的影响,由图可以得出的结论是_____________。
【基本实验及其原理分析】
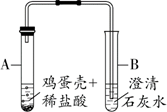
19.(2分)鸡蛋壳中含有碳酸钙。
(1)写出碳酸钙与盐酸反应的化学方程式_________。
(2)利用如图所示实验,能够验证鸡蛋壳中含有碳酸盐的现象是___________。
20.(4分)进行如下实验。
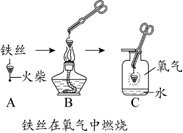
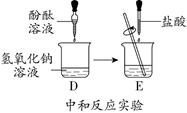
C中反应的化学方程式是_______
C中水的作用是__________
(3)E中反应的化学方程式是__________
(4)加入酚酞溶液的作用是___________
21.(2分)依据实验回答问题。
实验①
实验②
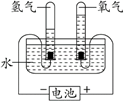
电解水
水蒸发
(1)实验①的目的是探究水的组成,其结论是__________。
(2)从微观角度解释实验①和实验②发生变化的不同点是________。
22.(4分)甲酸(HCOOH)在热的浓硫酸中分解,生成一氧化碳和水。用下图所示装置完成一氧化碳还原四氧化三铁的实验。
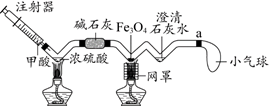
(1)写出甲酸分解的化学方程式____________。
 (2)碱石灰是氧化钙和氢氧化钠的混合物,氢氧化钠能干燥一氧化碳,利用其具有的性质是________。
(2)碱石灰是氧化钙和氢氧化钠的混合物,氢氧化钠能干燥一氧化碳,利用其具有的性质是________。
(3)一氧化碳与四氧化三铁反应的化学方程式为:4CO + Fe3O4
===== 4CO2 + 3Fe。若生成0.21 g铁,至少需要四氧化三铁的质量是______g。
(4)a处导管口绑一小气球的目的是_______。
【科学探究】
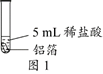
23.(6分)化学小组同学用图1装置探究铝与盐酸的反应。将未去除表面氧化膜的铝箔放入稀盐酸中,刚开始反应现象不明显,一段时间后反应比较剧烈,产生大量气泡,出现灰色沉淀。
【查阅资料】
①铝粉在颗粒较小时为灰黑色;铝既能与酸反应,又能与碱反应,且反应均生成氢气。
②氯化铝固体为白色颗粒或粉末,易溶于水和乙醇。
③氧化铝与盐酸反应的化学方程式为:Al2O3
+ 6HCl == 2AlCl3
+ 3H2O。
【实验一】探究灰色固体的成分
实验序号
1-1
1-2
1-3
1-4
实验操作
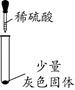
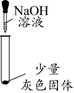
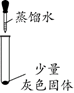
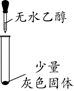
实验现象
有微量气泡产生,固体溶解
有少量气泡产生,固体溶解
____________
固体部分溶解
【实验二】探究盐酸浓度对灰色固体产生量的影响
取0.09 g铝箔和5 mL不同浓度的稀盐酸,用图1装置进行实验。
实验序号
盐酸浓度
实验现象
2-1
4.0%
刚开始反应现象不明显,一段时间后缓慢反应,然后反应比较剧烈,有大量气泡产生,出现灰色沉淀
2-2
2.8%
先是看不到反应现象,一段时间后缓慢反应,然后慢慢地反应比较剧烈,有大量气泡产生,出现少量灰色沉淀
2-3
2.1%
3~4小时后明显有气泡产生,反应慢慢地比较快些,试管底部出现少量灰色沉淀
2-4
1.4%
反应更慢,出现极少量的灰色沉淀
【解释与结论】
(1)铝与盐酸反应的化学方程式为___________。
(2)图1所示实验中,刚开始反应现象不明显,一段时间后才看到有气泡产生的原因是________。
(3)由实验________(填实验序号)可以判断灰色固体中含有铝。
(4)由实验1-4可知,灰色固体中还含有氯化铝。实验1-3的现象是_________。
(5)实验二的结论是__________。
【反思与交流】
(6)为了进一步探究灰色沉淀的出现是否与盐酸中的Cl-有关,可以将稀盐酸换成______进行图1所示实验。
【试题答案】
第一部分 选择题(共 12分)
(每小题只有1个选项符合题意。每小题1分,共12分。)
题号
1
2
3
4
5
6
7
8
9
10
11
12
答案
B
D
B
B
A
C
A
C
A
D
D
D
第二部分 非选择题(共 33分)
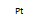 说明:以下每空1分。其他合理答案均可给分。
说明:以下每空1分。其他合理答案均可给分。13.(2分)(1)煤 (2)2H2 + O2 === 2H2O
14.(1分)CaCO3
15.(2分)(1)Na2CO3
(2)CaO + H2O == Ca(OH)2 [Ca(OH)2 + Na2CO3 == CaCO3↓ + 2NaOH]
16.(5分)(1)3 (2)维生素C易被光、热和氧气等破坏 (3)低温避光,尽早食用
(4)硒的元素符号是Se(或硒元素是非金属元素;或硒的相对原子质量为78.96等)
(5)AB
17.(2分)(1)氧和硫 (2)CaSO4 + CH4
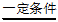 CaS + CO2 + 2H2O
CaS + CO2 + 2H2O
18.(3分)(2)CO2 (3)①
(4)其他条件相同时,在焙烧2~4小时之内,焙烧相同时间,加碳酸钙能够提高还原铁粉的产率
 19.(2分)(1)CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
19.(2分)(1)CaCO3 + 2HCl == CaCl2 + H2O + CO2↑(2)A中有气泡,B中石灰水变浑浊
20.(4分)(1)3Fe + 2O2
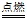 Fe3O4 (2)防止溅落的高温熔融物炸裂瓶底
Fe3O4 (2)防止溅落的高温熔融物炸裂瓶底(3)NaOH + HCl == NaCl + H2O
(4)借助酚酞指示剂的颜色变化,判断氢氧化钠和稀盐酸反应的发生
21.(2分)(1)水是由氢、氧元素组成
(2)①变化前后分子种类改变,②变化前后分子种类没有改变
22.(4分)(1)HCOOH
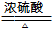 CO↑ + H2O
CO↑ + H2O(2)吸水性
(3)0.29
(4)收集尾气,防止污染
23.(6分)(1)2Al + 6HCl === 2AlCl3 + 3H2↑
(2)盐酸先与表面的氧化铝反应,该反应无明显现象,再与铝反应,出现明显气泡
(3)1-1 和1-2
(4)固体部分溶解
(5)在实验二的条件下,稀盐酸浓度在1.4%~4%之间,随着盐酸浓度的降低,得到灰色沉淀的量依次减少
(6)稀硫酸
