本试卷共24道小题,满分45分。考试时间:与生物合计90分钟。
可能用到的相对原子质量:H 1 C 12 O 16
第一部分
选择题(共12分)
(每小题只有一个选项符合题意。每小题1分)
1.下列变化中,属于化学变化的是
A.干冰升华 B.食物腐败 C.铁丝弯曲 D.汽车爆胎
2. “富硒猕猴桃”中的”硒”是指
A.硒原子 B.硒分子 C.硒元素 D.硒单质
3.下列物质在氧气中燃烧,产生大量白烟的是
A.红磷 B.甲烷 C.铁丝 D.木炭
4.下列物质放入水中,能形成溶液的是
A.食盐 B.牛奶 C.面粉 D.植物油
5.下列不属于新能源的是
A.潮汐能 B.太阳能 C.风能 D.石油
6.下列物质中,属于氧化物的是
A.O2 B.H2O C.KCl D.AgNO3
7.下列有关物质用途的叙述中,不正确的是
A.铜丝用作导线 B.碳酸钙用作补钙剂
C.浓硫酸用作食品干燥剂 D.小苏打用于焙制糕点
8.粗盐中难溶性杂质去除的实验步骤如下图所示。有关该实验的说法中,不正确的是
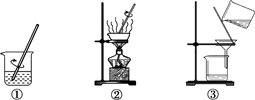
A.实验步骤是①③② B.步骤②出现大量固体时停止加热
C.步骤③漏斗中液面低于滤纸边缘 D.各步操作均需用玻璃棒搅拌
9.高铁轨道焊接时发生的反应为8Al+3Fe3O4 高温 4Al2O3+9Fe,该反应属于
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
10.丙烯是液化石油气的主要成分之一。下列有关叙述正确的是
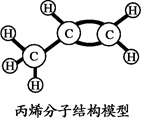
A. 丙烯由碳、氢原子构成
B. 丙烯中碳元素的质量分数最大
C. 丙烯中碳、氢元素质量比为1:2
D. 丙烯分子由碳、氢元素组成
11.下列实验操作不能达到实验目的的是
实验目的 | 实验操作 | |
A | 除去氧气中的二氧化碳 | 通过足量的氢氧化钠溶液 |
B | 检验某固体为碳酸盐 | 取样,滴加稀盐酸,观察是否有气泡产生 |
C | 鉴别空气和氧气 | 分别伸入燃着的木条,观察现象 |
D | 鉴别水和双氧水 | 取样,分别加入二氧化锰,观察是否有气泡产生 |
12.分析下图溶解度曲线,下列说法不正确的是
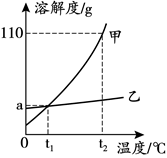
A. t1℃时,甲和乙的溶解度相等
B. t2℃时,甲的溶解度为110 g
C.将t1℃时两种物质的饱和溶液升温至t2℃,溶质质量分数:甲>乙
D. t2℃时,等质量的两种物质的饱和溶液中,所含溶质质量:甲>乙
第二部分 非选择题(共33分)
〖生活现象解释〗
13.(2分)”铁锅炖鱼”的烹饪方法为:将鱼下油锅煎黄后,加水、葱姜蒜、食盐、酱油、白糖等,在火上煨煮数小时。
(1)”铁锅炖鱼”中含有的营养素是____。
A.蛋白质 B.油脂 C.糖类 D.无机盐
(2)制作铁锅的铁是用一氧化碳和赤铁矿炼制的,该反应的化学方程式为______。
14.(2分)化学与生产、生活息息相关。
(1)石灰浆粉刷墙壁,干燥后墙面变硬的原因是____(用化学方程式表示)。
(2)用”捕捉”的CO2生产甲醇,反应的微观示意图如下:
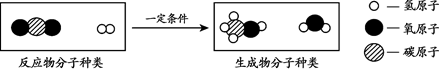
若利用该反应生产64 t甲醇,则参加反应的氢气的质量为________ t。
15.(1分)海水淡化可采用膜分离技术。如图所示,对淡化膜右侧的海水加压,水分子可透过淡化膜进入左侧淡水池,而海水中各种离子不能透过淡化膜,从而得到淡水。加压后,右侧海水中发生变化的量有________。
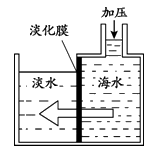
A.溶质质量 B.溶剂质量
C.溶液质量 D.溶质质量分数
〖科普阅读理解〗
16. (5分)阅读下面科普短文。
葡萄的果肉和果皮中都含有丰富的营养物质,可生食、酿酒等。生食葡萄前要清洗干净。下图是一种清洗的方法:
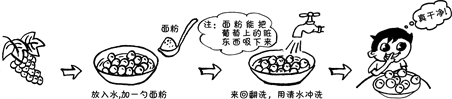
葡萄酒是以鲜葡萄或葡萄汁为原料,经酿酒酵母菌株将葡萄汁中的糖转化为酒精,同时生成了高级醇、酯类、单萜等香气化合物。葡萄酒香气主要受酿造菌种、酿造工艺、发酵条件等因素的影响。研究人员以发酵汁中残糖量为指标,研究不同种类的酿酒酵母的发酵动力(即发酵过程的速率),其测定结果如图1所示。
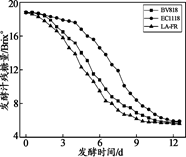
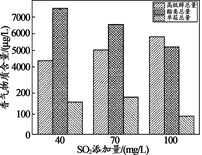
图1 三株酿酒酵母发酵动力学比较 图2 SO2添加量对香气物质总量的影响
为防止葡萄酒在陈酿和贮藏过程中被氧化,抑制葡萄汁中微生物的活动,葡萄酒酿制中还会适量添加SO2,其添加量对主要香气物质总量影响如图2所示。
葡萄在栽种过程中容易产生病虫害,可通过定期施肥、中和酸性土壤、喷洒农药等方法来增强葡萄抗病能力。若发病,可用硫酸铜配制农药波尔多液进行喷洒。
依据文章内容回答下列问题。
(1)配制农药波尔多液时,不宜用铁制容器,其原因是_____(用化学方程式表示)。
(2)葡萄酒酿制过程中SO2的作用是______。
(3)依据图1可获得的结论:在其他条件相同时,发酵动力最好的酿酒酵母菌株是___。
A.BV818 B.EC1118 C.LA-FR
(4)依据图2可知:SO2添加量在40~100 mg/L范围内,下列说法正确的是______。
A.SO2添加量在40 mg/L时,脂类总量最高
B.高级醇总量随着SO2添加量的增大而减小
C.单萜总量随着SO2添加量的增加,先增大后减小
(5)下列说法不正确的是_____。
A.面粉有利于去除葡萄皮上的脏东西
B.清洗干净后,建议吃葡萄不吐葡萄皮
C.葡萄富含糖类物质,糖尿病人不宜多食
D.可通过施加烧碱来中和酸性土壤
〖生产实际分析〗
17.(2分)工业上利用某废渣【含FeSO4、Fe2(SO4)3 及少量CaO和MgO】制备高档颜料铁红(主要成分为Fe2O3),并回收(NH4)2SO4,主要流程如下:
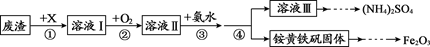
已知:溶液Ⅱ中的溶质有Fe2(SO4)3、MgSO4、CaSO4和X。
(1)加入物质X溶解废渣,X应选用____。
A.稀盐酸 B.稀硫酸 C.氨水 D.氢氧化钠溶液
(2)步骤②通入氧气的目的是____。
18.(3分)二氧化铬(CrO2)可用于生产电子信息记录材料,制备CrO2的主要流程如下:
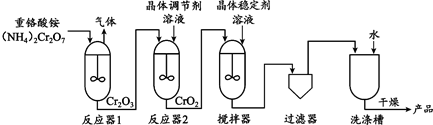
(1)上述流程中,Cr元素的化合价有____种。
(2)推测反应器1放出的气体中含N2,从元素守恒角度说明理由:____。
(3)上述流程中,用于分离提纯的设备有______。
〖基本实验及其原理分析〗
19.(2分)请从A~C中任选两个作答,若均作答,按前两个计分。
序号 | A | B | C |
实验 装置 |
|
|
|
问题 | 该实验的目的是__________。 | 若用此实验成功验证质量守恒定律,改进的方法是____。 | 能说明铜具有导热性的现象是____。 |
20.(3分)用下图装置进行实验。
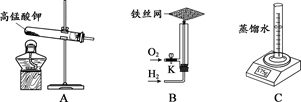
(1)实验A,高锰酸钾分解的化学方程式为____。
(2)实验B,关闭K,通入氢气,点燃,将铁丝网放在火焰上灼烧,铁丝网只发红不熔断;打开K,通入氧气,火焰更明亮、铁丝网熔断,说明物质燃烧的剧烈程度与氧气
的______有关。
(3)实验C,放置一段时间,电子秤示数变小,从微粒的角度解释其原因是_______。
21.(2分)下图是验证CO2性质的实验装置。实验时,持续通入CO2。
步骤Ⅰ:打开K1,关闭K2,观察现象。
步骤Ⅱ:关闭K1,打开K2,加热c,一段时间后,观察现象。
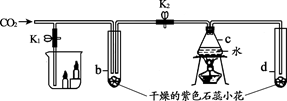
(1)步骤Ⅰ烧杯中蜡烛熄灭的原因是______。
(2)上述实验过程中,能证明CO2与水反应的实验现象是______。
22.(3分)如下图所示,在白色点滴板1~6的孔穴中,分别滴加稀硫酸。
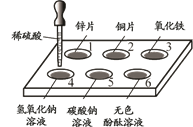
(1)反应后溶液颜色有变化的是____(填序号)。
(2)有一个孔穴中的物质不与稀硫酸反应,原因是____。
(3)若用石灰水替代稀硫酸滴入孔穴5中,发生反应的化学方程式为________。
23.(2分)利用下图完成可燃物燃烧条件和空气中氧气含量测定的相关实验。
已知:白磷的着火点是40℃。
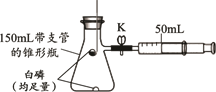
(1)将锥形瓶底部置于80℃热水中,观察到底部白磷先燃烧,一段时间后,燃烧匙中的白磷燃烧,由此可得出可燃物燃烧的条件是______。
(2)锥形瓶冷却到室温后,打开K,观察到的现象是______。
〖科学探究〗
24.(6分)快手美食”自热米饭”中带有一个发热包,遇水后可迅速升温至150℃,保温时间达3小时,能将生米做成熟饭。某化学小组对发热包的固体成分进行了以下探究。
【查阅资料】
①发热包可能由生石灰、铁粉、镁粉、铝粉、炭粉、氯化钠中的若干种物质组成。
②MgCl2溶液、AlCl3溶液均能与NaOH溶液发生复分解反应生成白色沉淀。
③氢氧化镁不溶于NaOH溶液,氢氧化铝可溶于NaOH溶液。
【猜想1】固体中一定存在铁粉及生石灰
【实验1】
步骤 | 实验操作 | 实验现象 | 实验结论 |
1-1 | 取发热包内灰黑色的固体粉末,分成两份 | ||
1-2 | 用磁铁多次重复靠近其中一份粉末 | 有部分黑色固体被磁铁吸引 | ________ |
1-3 | 取另一份粉末于试管中,________ | 放热,溶液变为红色 | 原粉末中一定含有生石灰 |
【猜想2】除上述物质外,还可能存在镁粉、铝粉和炭粉
【实验2】继续进行如下实验:
步骤 | 实验操作 | 实验现象 | 实验结论 |
2-1 | 取实验1-2的剩余固体于试管中,加入足量稀盐酸,充分反应后过滤 | ________,滤液呈无色 | 原粉末中一定含有炭粉,至少含镁粉、铝粉中的一种 |
2-2 | 取实验2-1的滤液于试管中,逐滴加入____溶液至过量 | 先产生白色沉淀,后沉淀消失,变为无色溶液 |
【解释与结论】
(1)实验1-2的结论是______。
(2)补全实验1-3的操作______。
(3)补全实验2-1的现象______。
(4)实验2-2加入的试剂是______。
【反思与评价】
(5)根据上述实验可知,该发热包中一定不含有的物质是______。
(6)氢氧化铝与NaOH反应生成偏铝酸钠(NaAlO2)和一种常见液态物质,该反应的化学方程式为________________。
【试题答案】
说明:1.考生答案如与本答案不同,若答得合理正确给分。
2.化学方程式中的”====”和” → “含义相同。
第一部分 选择题(每小题1分,共12分)
题 号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
答 案 | B | C | A | A | D | B | C | D | C | B | B | C |
第二部分 非选择题(共33分)
〖生活现象解释〗
13.(2分)
(1)ABCD (2)Fe2O3+3CO 高温 2Fe+3CO2
14.(2分)
(1)CO2+Ca(OH)2 ==== CaCO3↓+H2O (2)12
15.(1分)
BCD
〖科普阅读理解〗
16. (5分)
(1)Fe+CuSO4=Cu+FeSO4
(2)防止葡萄酒在陈酿和贮藏过程中被氧化,抑制葡萄汁中微生物的活动
(3)C
(4)AC
(5)D
〖生产实际分析〗
17.(2分)
(1)B (2)将FeSO4转化成Fe2(SO4)3
18.(3分)
(1)3 (2)反应物中含有氮元素 (3)过滤器、洗涤槽
〖基本实验及其原理分析〗
19.(2分)
序号 | 问题 |
A | 探究蜡烛燃烧的产物是否含有二氧化碳(或探究蜡烛中是否含有碳元素) |
B | 用集气瓶扣住燃着的蜡烛 |
C | 蜡烛融化(或火柴燃烧) |
20.(3分)
(1)2KMnO4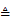 K2MnO4+MnO2+O2↑ (2)浓度 (3)水分子运动到空气中
K2MnO4+MnO2+O2↑ (2)浓度 (3)水分子运动到空气中
21.(2分)
(1)不支持燃烧的二氧化碳进入烧杯,隔绝了氧气
(2)步骤Ⅰb中小花不变红,步骤Ⅱb中小花变红,d中小花不变红
22.(3分)
(1)3 (2)在金属活动性顺序里,铜位于氢后,不与稀硫酸反应
(3)Ca(OH)2+Na2CO3 ==== 2NaOH+ CaCO3↓
23.(2分)
(1)温度达到着火点
(2)注射器的活塞向左移动,最终停在20mL处
〖科学探究〗
24.(6分)
(1)原粉末中一定含有铁粉
(2)加水溶解,过滤后,向滤液中滴加无色酚酞溶液
(3)产生大量气泡,有黑色固体剩余
(4)NaOH
(5)镁粉
(6)Al(OH)3+NaOH ==== NaAlO2+2H2O