友情提示:
本试卷分为Ⅰ卷、Ⅱ卷两部分,共19个小题,满分100分;答题时间为90分钟。
Ⅰ卷 选择题(共42分)
1. 医用外科口罩的结构示意图如下图所示,其中,过滤层所用的材料是熔喷聚丙烯,具有阻隔部分病毒和细菌的作用。下列关于医用外科口罩的说法不正确的是
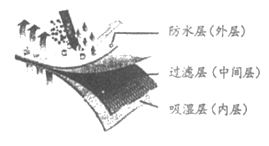
A. 防水层具有阻隔飞沫进入口鼻内的作用
B. 熔喷聚丙烯属于合成高分子材料
C. 熔喷聚丙烯材料难溶于水
D. 用完后应投入有 标志的垃圾箱
标志的垃圾箱
2. 下列物质的分析错误的是
A. 双氧水 | B. 漂白粉 | C. 滴露 | D. 强氯精 | |
有效成分 | H2O2 | Ca(ClO)2 |
|
|
分析 | 可与NaClO发生反应 | 可用Cl2与Ca(OH)2制备 | 分子式为C8H9OCl | 分子中有2种化学环境的碳原子 |
3. 下列解释事实的离子方程式不正确的是
A. 用石墨电极电解饱和食盐水:2Cl-+2H2O 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
B. 向Mg(OH)2浊液中加入FeCl3溶液:3Mg(OH)2(s)+2Fe3+=2Fe(OH)3(s)+3Mg2+
C. 用氨水吸收烟气中少量的SO2:NH3·H2O+SO2=NH4++HSO3-
D. 向Ba(OH)2溶液中逐滴加入NaHSO4溶液至Ba2+恰好沉淀完全:
Ba2++OH-+H++SO42-=BaSO4↓+H2O
4. 在浓盐酸中H3AsO3可与SnCl2反应:
3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M。
下列关于该反应的说法中不正确的是
A. M为H2O B. 每还原1mol氧化剂,就有3mol电子转移
C. 还原性:SnCl2>As D. 氧化产物和还原产物的物质的量之比为2:3
5. 下列各组离子在指定溶液中一定能大量共存的是
①无色溶液中:K+、Na+、Cu2+、Cl-、SO42-
②pH>7的溶液中:CO32-、NO3-、Na+、S2-、AlO2-、SO32-
③水电离出的c(H+)=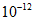 mol·
mol·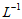 的溶液中:HCO3-、NO3-、NH4+、Fe2+
的溶液中:HCO3-、NO3-、NH4+、Fe2+
④加入Al能放出H2的溶液中:Mg2+、NH4+、Cl-、Na+、CO32-
⑤pH=1的溶液中:MnO4-、NO3-、SO42-、Na+、Fe3+
A. ①③④ B. ①④⑤ C. ②⑤ D. ③⑤
6. 下列实验未涉及氧化还原反应的是
A | B | C | D | |
实验 | FeCl3溶液滴入H2O2溶液中 | Na2O2粉末暴露在空气中 | NH4Cl溶液滴入Mg(OH)2沉淀中 | 乙醇滴入酸性K2Cr2O7溶液中 |
现象 | 产生气泡 | 固体变白 | 沉淀溶解 | 溶液由橙色变绿色 |
7. 图a~c分别为氯化钠在不同状态下的导电实验(X、Y均表示石墨电极)微观示意图。
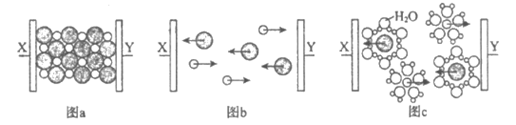
下列说法不正确的是
A. 图示中的○代表的离子的电子式为
B. 图a中放入的是氯化钠固体,该条件下不导电
C. 能导电的装置中,X上均有气体产生
D. 能导电的装置中,Y的电极产物相同
8. 某温度时,ⅥA元素单质A2、B、D与H2反应生成气态H2X的热化学方程式如下:
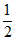 A2(g)+H2(g)=H2A(g)
A2(g)+H2(g)=H2A(g)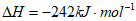
B(g)+H2(g)=H2B(g)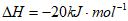
D2(g)+H2(g)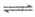 H2D(g)
H2D(g)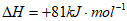
下列说法正确的是
A. 稳定性:H2A<H2B<H2D
B. 降温有利于D与H2反应生成H2D
C. A2(g)+2H2B(g)=2H2A(g)+2B(g)  H=-444kJ·mol-1
H=-444kJ·mol-1
D. 与H2的化合反应由易到难的顺序为:D>B>A2
9. 下列实验中,能达到相应实验目的的是
|
|
|
|
A. 证明乙炔可使溴水褪色 | B. 证明氯化银溶解度大于硫化银 | C. 验证溴乙烷的消去产物是乙烯 | D. 推断S、C、Si的非金属性强弱 |
10. 水煤气变换反应为:CO(g)+H2O(g)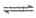 CO2(g)+H2(g)。我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用·标注。下列说法正确的是
CO2(g)+H2(g)。我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用·标注。下列说法正确的是
A. 水煤气变换反应的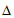 H>0
H>0
B. 步骤③的化学方程式为:CO·+OH·+H2O(g)=COOH·+H2O·
C. 步骤⑤只有非极性键H—H键形成
D. 该历程中最大能垒(活化能)E正=1.70eV
11. 探究草酸(H2C2O4)性质,进行如下实验(已知:室温下,0.1mol·L-1H2C2O4的pH=1.3)
实验 | 装置 | 试剂a | 现象 |
① |
| Ca(OH)2溶液(含酚酞) | 溶液褪色,产生白色沉淀 |
② | 少量NaHCO3溶液 | 产生气泡 | |
③ | 酸性KMnO4溶液 | 紫色溶液褪色 | |
④ | C2H5OH和浓硫酸 | 加热后产生有香味物质 |
由上述实验所得草酸性质所对应的方程式不正确的是
A. H2C2O4有酸性,Ca(OH)2+H2C2O4=CaC2O4↓+2H2O
B. 酸性:H2C2O4>H2CO3,NaHCO3+H2C2O4=NaHC2O4+CO2↑+H2O
C. H2C2O4具有还原性,2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O
D. H2C2O4可发生酯化反应,HOOCCOOH+2C2H5OH C2H5OOCCOOC2H5+2H2O
C2H5OOCCOOC2H5+2H2O
12. 用下图所示装置及试剂进行铁的电化学腐蚀实验探究,测定具支锥形瓶中压强随时间变化关系以及溶解氧随时间变化关系的曲线如下。
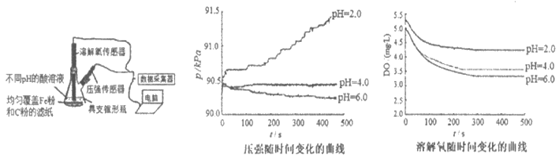
下列说法不正确的是
A. 压强增大主要是因为产生了H2
B. 整个过程中,负极电极反应式为:Fe-2e–=Fe2+
C. pH=4.0时,不发生析氢腐蚀,只发生吸氧腐蚀
D. pH=2.0时,正极电极反应式为:2H++2e-=H2↑和O2+4e-+4H+=2H2O
13. 298K时,0.180mol·L-1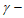 羟基丁酸水溶液发生如下反应,生成
羟基丁酸水溶液发生如下反应,生成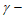 丁内酯:
丁内酯:
不同时刻测得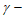 丁内酯的浓度如下表。(注:该条件下副反应、溶液体积变化忽略不计。)
丁内酯的浓度如下表。(注:该条件下副反应、溶液体积变化忽略不计。)
| 20 | 50 | 80 | 100 | 120 | 160 | 220 |
|
| 0.024 | 0.050 | 0.071 | 0.081 | 0.090 | 0.104 | 0.116 | 0.132 |
下列分析正确的是
A. 增大γ-羟基丁酸的浓度可提高γ-丁内酯的产率
B. 298 K时,该反应的平衡常数为2.75
C. 反应至120 min时,γ-羟基丁酸的转化率<50%
D. 80~120min的平均反应速率:v(γ-丁内酯)>1.2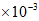 mol·L
mol·L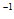 ·min
·min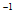
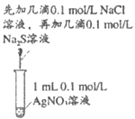
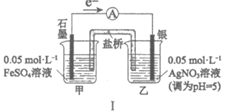
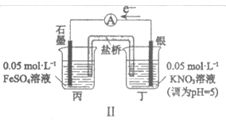
14. 某同学研究FeSO4溶液和AgNO3溶液的反应,设计如下对比实验。
实验 |
|
|
现象 | 连通电路后,电流表指针向右偏转,分别取反应前和反应一段时间后甲烧杯中的溶液,滴加KSCN溶液,前者几乎无色,后者显红色 | 连通电路后,电流表指针向左发生微小的偏转,丙、丁烧杯中均无明显现象 |
下列说法正确的是
A. 仅由Ⅰ中的现象可推知Ag+的氧化性强于Fe3+
B. Ⅱ中电流表指针向左偏转的原因是Fe2+氧化了银电极
C. Ⅱ中若将银电极换成石墨电极,电流表指针可能不再向左偏转
D. 对比Ⅰ、Ⅱ可知,Ⅰ中NO3-氧化了Fe2+
Ⅱ卷 非选择题(共58分)
15. (10分)自来水是自然界中的淡水经过絮凝、沉淀、过滤、消毒等工艺处理后得到的。
常用的自来水消毒剂有二氧化氯(ClO2)和高铁酸钾(K2FeO4)等。
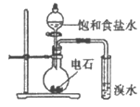
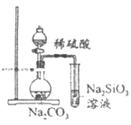
(1)某研究小组用下图装置制备少量ClO2(夹持装置已略去)。
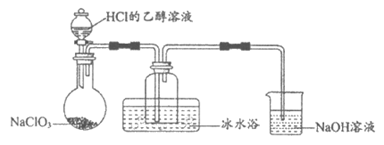
资料:ClO2常温下为易溶于水而不与水反应的气体,水溶液呈深黄绿色,11℃时液化成红棕色液体。以NaClO3和HCl的乙醇溶液为原料制备ClO2的反应为:
2NaClO3+4HCl=2ClO2↑+Cl2↑+NaCl+2H2O。
①冰水浴的作用是__________________。
②NaOH溶液中发生的主要反应的离子方程式为_____________________________。
(2)将ClO2水溶液滴加到KI溶液中,溶液变棕黄;再向其中加入适量CCl4,振荡、静置,观察到______________________________,证明ClO2具有氧化性。
(3)ClO2在杀菌消毒过程中会产生副产物亚氯酸盐(ClO2-),需将其转化为Cl-除去。
下列试剂中,可将ClO2-转化为Cl-的是____________(填字母序号)。
a. FeSO4 b. O3 c. KMnO4 d. SO2
(4)K2FeO4是一种新型、绿色的多功能净水剂,集氧化、吸附、絮凝、沉淀、灭菌、消毒、脱色、除臭等性能为一体。实验室制备K2FeO4的方法如下:在冰水浴中,向KClO和KOH的混合溶液中少量多次加入硝酸铁,并不断搅拌。
①上述制备K2FeO4反应的离子方程式为___________________________。
②净水过程中,K2FeO4起到吸附、絮凝作用的原理是__________________。
16. (14分)维持pH的稳定对生命体的生理活动、化学电源的高效工作等具有重要意义。
(1)常温下,在不同试剂中加入酸或碱后体系pH的变化如下表所示。
试剂 | pH | ||
初始 | 通入0.01molHCl气体 | 加入0.01molNaOH固体 | |
i. 1L H2O | 7 | a | 12 |
ii. 0.10mol CH3COOH+0.10mol CH3COONa配制成1L溶液 | 4.76 | 4.67 | 4.85 |
①a=___________(忽略通入HCl气体前后体系的体积变化)。
②结合化学用语解释试剂ii显酸性的原因:_______________________________。
③试剂ii中微粒浓度关系正确的有______________(填字母序号)。
a. c(CH3COOH)>c(Na+)>c(CH3COO-)
b. 2c(H+)=c(CH3COO-)-c(CH3COOH)+2c(OH-)
c. c(CH3COOH)+c(CH3COO-)=0.2mol/L
④由表中数据可知,试剂ii的pH受一定量的酸和碱的影响不大。溶液的这种能对抗外来少量强酸、强碱或适当稀释,而保持溶液的pH几乎不变的作用称为缓冲作用。下列具有缓冲作用的溶液是_____________(填字母序号)。
a. HCl—NaCl b. Na2CO3—NaHCO3
c. NH3·H2O—NH4Cl d. KOH—KCl
⑤已知:
25℃时CH3COOH(aq)+OH-(aq)=CH3COO-(aq)+H2O(1) 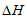 =-a kJ·mol
=-a kJ·mol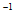
H+(aq)+OH-(aq)=H2O(1) 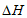 =-b kJ·mol
=-b kJ·mol
醋酸电离的热化学方程式为________________________________________。
(2)缓冲溶液应用在某种液钒电池中能稳定电池的输出电流,该电池装置示意图如下图所示,电池的总反应如下:Zn+2VOSO4+2H2SO4
 ZnSO4+V2(SO4)3+2H2O
ZnSO4+V2(SO4)3+2H2O
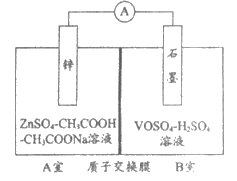
已知:VOSO4和V2(SO4)3的电离方程式分别为:
VOSO4=VO2++SO42-
V2(SO4)3=2V3++3SO42-
①放电时,B室中c(H+)_________(填”增大”、”减小”或”不变”),结合化学用语说明理由_______________________________________________。
②充电时,A室中的c(H+)变化缓慢的原因是_______________________________。
17. (13分)无水氯化锰(MnCl2)在电子技术和精细化工领域有重要应用。一种由粗锰粉(主要杂质为Fe、Ni、Pb等金属单质)制备无水氯化锰的工艺如下(部分操作和条件略)。
Ⅰ. 向粗锰粉中加入盐酸,控制溶液的pH约为5,测定离子的初始浓度。静置一段时间后锰粉仍略有剩余,过滤;
Ⅱ. 向Ⅰ的滤液中加入一定量盐酸,再加入H2O2溶液,充分反应后加入MnCO3固体调节溶液的pH约为5,过滤;
Ⅲ. 向Ⅱ的滤液中通入H2S气体,待充分反应后加热一段时间,冷却后过滤;
Ⅳ. 浓缩、结晶、过滤、洗涤、脱水得到无水MnCl2。
【已知】①金属活动性:Mn>Fe>Ni>Pb
②各步骤中对杂质离子的去除情况
Fe2+ | Ni2+ | Pb2+ | |
初始浓度/mg·L | 21.02 | 4.95 | 5.86 |
步骤Ⅰ后/mg·L | 12.85 | 3.80 | 3.39 |
步骤Ⅱ后/mg·L | 0.25 | 3.76 | 3.38 |
步骤Ⅲ后/mg·L | 0.10(达标) | 3.19(未达标) | 0.12(达标) |
(1)锰和盐酸反应的化学方程式是_____________________________________。
(2)步骤Ⅰ中:
①Fe2+浓度降低,滤渣中存在Fe(OH)3。结合离子方程式解释原因:_________________。
②Pb2+浓度降低,分析步骤Ⅰ中发生的反应为:Pb+2H+=Pb2++H2↑、____________。
(3)步骤Ⅱ中:
①H2O2酸性溶液的作用:____________________________。
②结合化学用语用平衡移动原理解释MnCO3的作用:____________________________。
(4)步骤Ⅲ通入H2S后,Ni2+不达标而Pb2+达标。推测溶解度:PbS___________NiS(填”>”或”<“)。
(5)测定无水MnCl2的含量:将a g样品溶于一定量硫酸和磷酸的混合溶液中,加入稍过量NH4NO3,使Mn2+氧化为Mn3+。待充分反应后持续加热一段时间,冷却后用b mol/L硫酸亚铁铵[(NH4)2Fe(SO4)2]滴定Mn3+,消耗c mL硫酸亚铁铵。
(已知:滴定过程中发生的反应为:Fe2++Mn3+=Fe3++Mn2+)
①样品中MnCl2的质量分数是____________(已知:MnCl2的摩尔质量是126g·mol )。
)。
②”持续加热”的目的是使过量的NH4NO3分解。若不加热,测定结果会___________(填”偏高”、”偏低”或”无影响”)。
18. (10分)液相催化还原法去除水体中NO3-是一项很有前景的技术。某科研小组研究该方法中使用的固体催化剂Pd-Cu/TiO2的制备和催化条件,结果如下。
Ⅰ. 制备Pd-Cu/TiO2的反应过程如下图所示,光照使TiO2发生电荷分离,将金属Pd沉积在TiO2表面。再用类似方法沉积Cu,得到在TiO2纳米颗粒表面紧密接触的Pd-Cu纳米簇。
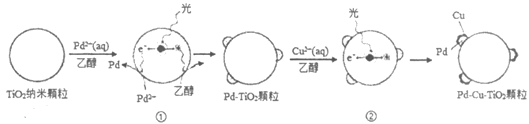
(1)该过程中,乙醇发生__________(填”氧化”或”还原”)反应。
(2)请在②中补全光照条件下形成Pd-Cu纳米簇的反应过程示意图。
Ⅱ. Pd-Cu/TiO2分步催化还原机理如图a所示。其他条件相同,pH不同时,反应1小时后NO3-转化率和不同产物在总还原产物中所占的物质的量的百分比如图b所示。
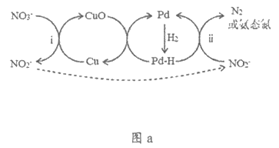
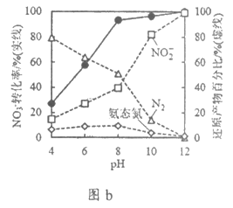
注:Pd-H表示Pd吸附的氢原子:氨态氮代表NH3、NH4+和NH3·H2O的总和
(3)该液相催化还原法中所用的还原剂是___________________。
(4)i的离子方程式是________________________________________。
(5)研究表明,OH-在Pd表面与NO2-竞争吸附,会降低Pd吸附NO2-的能力,但对Pd吸附H的能力影响不大。
①随pH增大,N2和氨态氮在还原产物中的百分比均减小,原因是__________________,导致反应ii的化学反应速率降低。
②随pH减小,还原产物中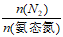 的变化趋势是______________,说明Pd表面吸附的NO2-和H的个数比变大,对反应_____________________________(用离子方程式表示)更有利。
的变化趋势是______________,说明Pd表面吸附的NO2-和H的个数比变大,对反应_____________________________(用离子方程式表示)更有利。
(6)使用Pd-Cu/TiO2,通过调节溶液pH,可将NO3-尽可能多地转化为N2,具体方法是_________________________________________________。
19. (11分)化学小组实验探究SO2与AgNO3溶液的反应。
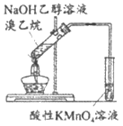
(1)【实验一】用如下装置(夹持、加热仪器略)制备SO2,将足量SO2通入AgNO3溶液中,迅速反应,得到无色溶液A和白色沉淀B。
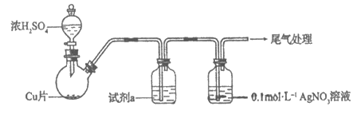
①浓H2SO4与Cu反应的化学方程式是_____________________________________。
②试剂a是____________________。
(2)对体系中有关物质性质分析得出:沉淀B可能为Ag2SO3、Ag2SO4或二者混合物。
(资料:Ag2SO4微溶于水;Ag2SO3难溶于水)
【实验二】验证B的成分

①写出Ag2SO3溶于氨水的离子方程式:_________________________________。
②加入盐酸后沉淀D大部分溶解,剩余少量沉淀F。推断D中主要是BaSO3,进而推断B中含有Ag2SO3。向滤液E中加入一种试剂,可进一步证实B中含有Ag2SO3。所用试剂及现象是_____________________________________。
(3)根据沉淀F的存在,推测SO42-的产生有两个途径:
途径1:实验一中,SO2在AgNO3溶液中被氧化生成Ag2SO4,随沉淀B进入D。
途径2:实验二中,SO32-被氧化为SO42-进入D。
【实验三】探究SO42-的产生途径
①向溶液A中滴入过量盐酸,产生白色沉淀,证明溶液中含有________________;取上层清液继续滴加BaCl2溶液,未出现白色沉淀,可判断B中不含Ag2SO4。做出判断的理由:_____________________________________________。
②实验三的结论:_____________________________________________。
(4)实验一中SO2与AgNO3溶液反应的离子方程式是____________________________。
(5)根据物质性质分析,SO2与AgNO3溶液应该可以发生氧化还原反应。将实验一所得混合物放置一段时间,有Ag和SO42-生成。
(6)根据上述实验所得结论:______________________________________________。
【试题答案】
Ⅰ卷:选择题(共42分)
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
D | D | C | D | C | C | D | C | D | B | C | C | B | C |
Ⅱ卷 非选择题(共58分)
15. (10分)
(1)①分离Cl2和ClO2
②Cl2+2OH-=Cl-+ClO-+H2O
(2)溶液分层,下层为紫色 (3)ad
(4)①3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O
②净水过程中,FeO42-发挥氧化作用,被还原成Fe3+,Fe3+水解生成Fe(OH)3胶体,起到吸附、絮凝作用
16. (14分)
(1)①2
②试剂ii中同时存在醋酸的电离平衡CH3COOH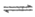 CH3COO-+H+和醋酸根的水解平衡CH3COO-+H2O
CH3COO-+H+和醋酸根的水解平衡CH3COO-+H2O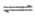 CH3COOH+OH-,相同条件下,醋酸的电离平衡的限度大于醋酸根的水解平衡限度,当CH3COOH与CH3COO-的初始浓度相等时,溶液中c(H+)>c(OH-)
CH3COOH+OH-,相同条件下,醋酸的电离平衡的限度大于醋酸根的水解平衡限度,当CH3COOH与CH3COO-的初始浓度相等时,溶液中c(H+)>c(OH-)
③bc ④bc
⑤CH3COOH(aq)=CH3COO-(aq)+H+(aq) 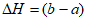 kJ·mol
kJ·mol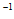
(2)①减小
放电时,B室发生正极反应:VO2++e-+2H+=V3++H2O;由电极反应可知,转移1mole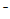 消耗2molH+,同时有1molH+通过质子交换膜进入B室,因此总体c(H+)降低
消耗2molH+,同时有1molH+通过质子交换膜进入B室,因此总体c(H+)降低
②充电时,H+通过质子膜从B室进入A室,A室溶液中的CH3COO-与H+结合成CH3COOH(或”CH3COOH-CH3COONa溶液有缓冲作用”),从而使c(H+)的变化减缓
17. (12分)
(1)Mn+2HCl=MnCl2+H2↑
(2)①4Fe2++O2+10H2O=4Fe(OH)3↓+8H+,空气中的O2将部分Fe2+氧化为Fe(OH)3沉淀
②Pb2++Mn=Pb+Mn2+
(3)①将剩余Fe2+氧化为Fe3+
②MnCO3+2H+=Mn2++H2O+CO2↑,pH增大,Fe3++3H2O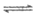 Fe(OH)3+3H+正向移动,使Fe3+转化为Fe(OH)3沉淀除去
Fe(OH)3+3H+正向移动,使Fe3+转化为Fe(OH)3沉淀除去
(4)<
(5)①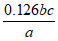 ②偏高
②偏高
18. (10分)
(1)氧化 (2)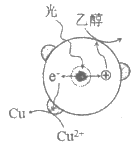 (3)H2
(3)H2
(4)Cu+NO3-=NO2-+CuO
(5)①Pd表面单位面积吸附的NO 数目减小
数目减小
②增大 2NO2-+6H=N2+2H2O+2OH-
(或2NO2-+6Pd-H=N2+2H2O+2OH-+6Pd)
(6)先调节溶液的pH到12,待NO3-几乎完全转化为NO2-后,调节pH到4
19. (12分)
(1)①Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
②饱和NaHSO3溶液
(2)①Ag2SO3+4NH3·H2O=2Ag(NH3)2++SO32-+4H2O
②H2O2溶液,产生白色沉淀(或品红、硝酸、溴水)
(3)①Ag+;Ag2SO4溶解度大于BaSO4,没有BaSO4沉淀时必定没有Ag2SO4
②途径1不产生SO42-,途径2产生SO42-
(4)2Ag++SO2+H2O=Ag2SO3↓+2H+
(6)实验条件下:SO2与AgNO3溶液生成Ag2SO3的速率大于生成Ag和SO42-的速率,且碱性溶液中SO32-更易被氧化为SO42-