本试卷分为第一部分(选择题)和第二部分(非选择题)两部分,共34个小题。满分100分;答题时间为90分钟。
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 Cl 35.5
第一部分 选择题(共40分)
每小题2分。在每小题列出的四个选项中,选出符合题目要求的一项。
1. 下列关于二氧化碳用途说法不正确的是
A. 光合作用 B. 供给呼吸 C. 制碳酸饮料 D. 灭火
2. 下列物质中,含有金属元素的是
A. SiO2 B. CO2 C. Ca(OH)2 D. CH4
3. 下列物质在空气中燃烧时,产生大量白烟的是
A. 甲烷 B. 硫粉 C. 木炭 D. 红磷
4. 下列物质不属于可燃物的是
A. O2 B. CO C. H2 D. 酒精
5. 下列符号能表示2个H原子的是
A. 2H B. H2 C. H2O D. 2H2
6. 氧气能压缩在钢瓶中保存,主要体现了
A. 分子的质量很小 B. 分子间有间隔
C. 分子在不断运动 D. 分子由原子构成
7. 下列地点附近,可以使用明火的是
A. 加油站 B. 面粉厂 C. 烟花销售点 D. 空旷的露营区
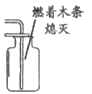
8. 下列方法不能区分氧气和二氧化碳的是
A. 观察颜色 B. 滴加紫色石蕊溶液
C. 滴加澄清石灰水 D. 伸入燃着的木条
9. 下列物质不属于碳单质的是
A. 石墨 B. 金刚石 C. C60 D. 二氧化碳
10. 根据如图所示元素信息,下列说法不正确的是
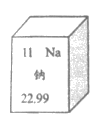
A. 钠的相对原子质量为22.99 B. 1个钠原子中有11个质子
C. Na可以表示1个钠原子 D. Na是非金属元素
11. 碳元素与氧元素的本质区别是
A. 中子数不同 B. 电子数不同
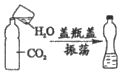
C. 质子数不同 D. 最外层电子数不同
12. 某种碳原子可用于检测人体中的幽门螺旋杆菌。该原子的原子核内含有6个质子和8个中子,则该原子的核外电子数为
A. 2 B. 6 C. 8 D. 14
13. 下列物质属于氧化物的是
A. 空气 B. CaCO3 C. MnO2 D. O2
14. 卫星运载火箭的动力由高氯酸铵(NH4ClO4)发生反应提供,化学方程式为:
2NH4ClO4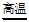 N2↑+Cl2↑+2O2↑+4X。则X的化学式是
N2↑+Cl2↑+2O2↑+4X。则X的化学式是
A. H2 B. H2O C. H2O2 D. HCl
15. 下列图标中,表示”禁止燃放鞭炮”的是
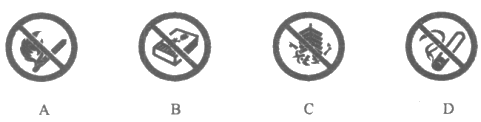
16. 下列安全措施不正确的是
A. 天然气泄漏,立即打开排风扇
B. 家用电器着火,迅速切断电源
C. 炒菜时油锅着火,可放入较多的蔬菜
D. 燃着的酒精灯被碰倒,立即用湿布盖灭
结合微观示意图回答17—19题。
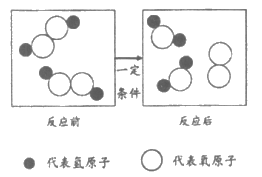
17. 下列说法中,不正确的是
A. MnO2可作为该反应的催化剂
B. 用该反应可以制备氧气
C. 物质不同,其元素组成一定不同
D. 该反应属于分解反应
18. 下列关于物质构成微粒的说法中,正确的是
A. 反应物中含有氧分子
B. 1个反应物分子中含有2个氢原子
C. 反应物分子中,氢原子与氧原子质量之比为1:8
D. 两种生成物分子的相对分子质量相同
19. 下列关于物质变化的说法中,正确的是
A. 该反应的化学方程式为H2O2=H2O+O2↑
B. 反应前后,分子的种类一定发生改变
C. 当34份质量的H2O2参加反应时,生成32份质量的O2
D. 反应物中的氧元素,在反应后完全转移到O2中
20. 下列实验方案能达到实验目的的是
选项 | A | B | C | D |
实验 目的 | 证明CO2可与H2O反应生成H2CO3 | 除去CO2中的少量CO | 证明可燃物燃烧需要与O2接触 | 证明集气瓶中已充满CO2 |
实验 方案 |
|
|
|
|
第二部分 非选择题(每空1分,共60分)
【生活现象解释】
21. (5分)能源问题一直是人们关注的热点。
(1)目前人们使用的燃料大多来自化石燃料,如煤、__________和天然气。天然气的主要成分完全燃烧的化学方程式是_________________________。
(2)节约化石能源、减少对环境的影响是能源进一步利用和开发的重点。
①H2是理想的清洁燃料。H2燃烧的化学方程式是____________________________。
②下列利用了新能源的是_____________(填序号)。

(3)倡导”低碳”生活,应从生活中的点滴做起。下列做法符合”低碳”理念的是_______________。
A. 外出随手关灯 B. 双面使用纸张
C. 骑自行车出行 D. 丢弃未喝完的矿泉水瓶
22. (3分)2017年9月新闻报道:我国成功提纯了”超级金属”铼。铼及其合金被广泛应用到航空航天领域。金属铼硬度大,熔点很高,在高温下能与硫化合形成二硫化铼。
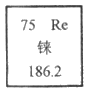
(1)铼的相对原子质量是_____________。
(2)上述信息中,属于金属铼的物理性质的是____________________。
(3)七氧化二铼(Re2O7)是常见的氧化物,其中铼元素的化合价为____________。
23. (5分)”温控保鲜”和”气调保鲜”是两类食品保鲜技术。它们通过降低温度和改变气体成分,达到抑制储藏物细胞呼吸的目的。
(1)干冰可用于”温控保鲜”,利用干冰的性质是_____________________。
(2)”气调保鲜”中会使用CO2来抑制细菌。CO2进入细菌细胞液后能产生酸性物质,抑制细菌生长。请用化学方程式解释酸性物质产生的原因:___________________________。
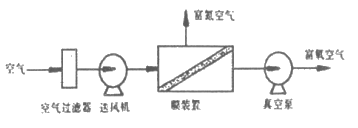
(3)冰箱中常用下图所示的膜分离技术实现”气调保鲜”。分离后,通入冰箱保鲜室内的气体是___________(填”富氮空气”或”富氧空气”)。
(4)石墨烯是由碳原子构成的单层石墨片,可制成石墨烯电池。石墨烯属于_____________(填”单质”或”化合物”),依据上述用途推测石墨烯具有_____________性。
【科普阅读理解】
24. (5分)阅读下列科普文章。
我国是世界上少数几个以煤(主要含碳、氢、氧、氮、硫等元素)为主要能源的国家。相对单一的能源消费模式,导致了能源供需结构的失衡,同时带来了严重的环境影响。2016年,我国石油产量为1.997亿吨,消费量却达到5.787亿吨。因此,把煤制成油,一直是我国调整能源结构的重要战略决策。
煤制油被称为煤的液化。一种工艺是先将煤送入汽化炉内,转化成粗煤气,再进一步处理后得到仅含CO和H2的合成气,然后以合成气为原料,在一定的温度、压强和催化剂条件下合成甲醇(CH3OH),再利用甲醇合成燃料油。
我国在煤制油工业生产上的优势之一是用非常廉价的原材料做成催化剂,这一技术为我国能源结构的可持续发展做出了重要贡献。
依据文章内容,回答下列问题。
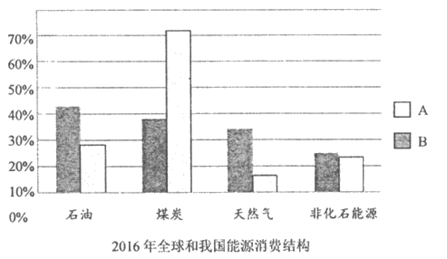
(1)我国以煤炭为主的能源消费模式的弊端是_______________。
(2)在2016年能源消费结构图中,能代表我国能源消费结构的是____________(填”A”或”B”)
(3)甲醇(CH3OH)中碳、氢元素的质量比为_____________。
(4)将煤转化成煤气的反应为C+H2O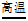 CO+H2,该反应中属于氧化物的是___________。
CO+H2,该反应中属于氧化物的是___________。
(5)下列说法正确的是_____________。
A. 我国的能源消费主要是化石燃料
B. 我国在2016年的石油消费量远大于产量
C. “煤制油”技术有助于解决煤多油少的结构性缺点
D. “煤的液化”过程为物理变化
【生产实际分析】
25. (3分)超细碳酸钙可用于生产钙片、牙膏等产品。利用碳化法生产超细碳酸钙的主要流程示意图如下:
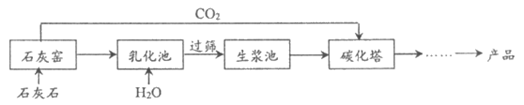
(1)石灰石主要成分的化学式为_______________。
(2)乳化池中,生石灰与水发生反应,其化学方程式为____________________________。
(3)过筛的目的是拦截______________(填”大于”或”小于”)筛孔直径的颗粒。
26. (4分)合成氨是人类科学技术上的一项重大突破,对社会发展与科技进步做出了巨大贡献。
合成氨工艺的主要流程如下:
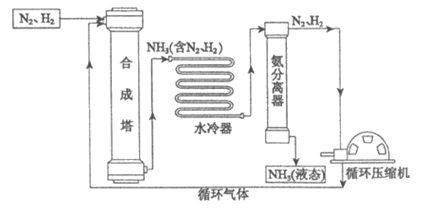
(1)合成塔中的反应在高温、高压、催化剂条件下进行,其化学方程式是______________。
(2)从合成塔出来的物质是______________(填”纯净物”或”混合物”)
(3)生产过程中可循环使用的物质是______________。
(4)根据表中的数据回答问题。
物质 | H2 | N2 | O2 | NH3 |
沸点/℃( | -252 | -195.8 | -183 | -33.35 |
在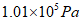 时,欲将NH3与N2,H2分离,适宜的温度范围是___________。
时,欲将NH3与N2,H2分离,适宜的温度范围是___________。
【基本实验及其原理分析】
27. (7分)根据下图回答问题。
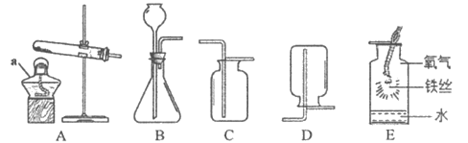
(1)实验室用高锰酸钾制取氧气的化学方程式是______________,选用的收集装置是______________(填序号,下同)。如图E所示,铁丝在氧气中燃烧的化学方程式是______________。
(2)实验室制取二氧化碳的化学方程式是______________,选用的发生装置是______________,选用如图C方法收集二氧化碳的原因是______________,检验二氧化碳是否收集满的方法是____________________________。
28. (2分)用如图装置进行实验。将挂在天平两侧的两个薄纸袋调节平衡,然后向B中倾倒二氧化碳气体。
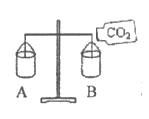
(1)天平的______________(填”A”或”B”)端会向下倾斜。
(2)放置一段时间后,天平两端恢复平衡。由此可知分子的性质是______________。
29. (5分)实验小组同学做了如下实验,验证质量守恒定律。
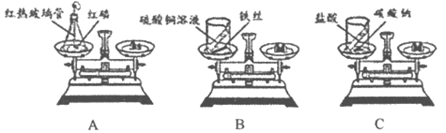
(1)实验A中,气球所起的作用是______________。
(2) 实验B中发生反应的化学方程式____________________________。
(3)实验C中发生反应的化学方程式____________________________。
(4)上述实验中,最终天平指针不平衡的是______________(填实验序号),其原因是____________________________。
30. (3分)取四朵用石蕊溶液染成紫色的干燥纸花完成如下实验。
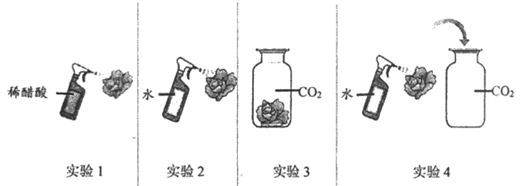
(1)纸花变为红色的实验有______________(填实验序号)。
(2)实验1的作用是____________________________。
(3)能证明水和二氧化碳发生了化学反应的现象是____________________________。
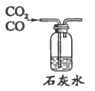
31. (3分)依据下图进行实验(夹持仪器略去)。实验过程:①通入N2,点燃酒精灯,一段时间后,a、b中均无明显现象;②熄灭酒精灯,立即改通O2,a中无明显现象,b中红磷燃烧。
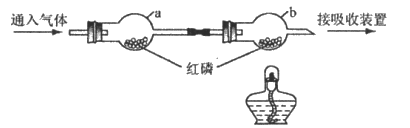
(1)实验过程②中,红磷燃烧的化学方程式为____________________________。
(2)实验过程中,能说明可燃物燃烧需要氧气的实验现象是_______________________。
(3)实验过程②中,对比a、b中的实验现象,可知可燃物燃烧的条件之一是__________________________________________。
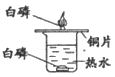
32. (5分)研究燃烧现象,小明进行了下列活动。
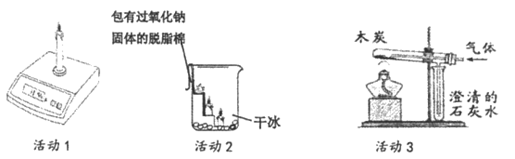
(1)活动1:点燃蜡烛后,电子秤示数逐渐减小。蜡烛燃烧后生成二氧化碳和水的总质量______________(填”大于””等于”或”小于”)燃烧掉的蜡烛的质量。该反应______________(填”遵守”或”不遵守”)质量守恒定律。
(2)活动2:蜡烛熄灭,说明二氧化碳所具有的性质的是______________;上层脱脂棉燃烧,说明二氧化碳与过氧化钠(Na2O2)发生了放热反应,并产生了一种气体,该气体是______________。
(3)活动3:小明采取以下实验操作步骤验证可燃物燃烧的两个条件,则实验操作顺序应为______________(每步仅可选用一次)。
A. 通入氮气 B. 点燃酒精灯 C. 通入氧气
33. (7分)在日常生活中,制作馒头时常加入泡打粉,在制作过程中由于产生二氧化碳气体,使馒头变得松软可口。某小组同学对泡打粉的发面原理产生兴趣,进行了以下实验探究。

【查阅资料】泡打粉是一种复合膨松剂,又称为发泡粉,可作为快速发面剂用于制作面食。某种泡打粉的主要成分是小苏打粉和酒石酸氢钾。
【提出问题】泡打粉为什么会产生二氧化碳气体?
【猜想与假设】 猜想1:小苏打受热分解产生二氧化碳气体
猜想2:酒石酸氢钾受热分解产生二氧化碳气体
猜想3:小苏打和酒石酸氢钾在溶液中发生反应,产生二氧化碳气体
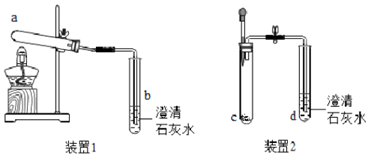
【进行实验】利用以下实验装置进行探究(空气的成分不参与反应)
实验 | 实验操作 | 实验现象 |
1 | 在装置1的a试管中放入小苏打,加热 | a试管口内壁有无色液滴, b试管中石灰水变浑浊。 |
2 | 在装置1的a试管中放入酒石酸氢钾,加热 | a试管口内壁有无色液滴, b试管中石灰水不变浑浊 |
3 | 在装置2的c试管中放入小苏打和酒石酸氢钾的混合物,滴加___________。 | _________________,d试管中石灰水变浑浊 |
【解释与结论】
(1)由实验1可得小苏打中含有的元素是_____________。
(2)实验1中,b试管中发生反应的化学方程式为__________________________。
(3)实验2的现象表明,猜想2_____________(填”成立”或”不成立”)。
(4)实验3的操作:在装置2的c试管中放入小苏打和酒石酸氢钾的混合物,滴加_____________,实验现象为_____________,石灰水变浑浊。猜想3成立。
【反思与评价】
(5)通过以上实验探究,小组同学又查阅到碳酸氢钠俗称小苏打,碳酸氢钠分解的反应为:2NaHCO3 Na2CO3+H2O+CO2↑,根据以上实验结论,小组同学想探究一下碳酸钠是否能代替小苏打和酒石酸氢钾在溶液中发生反应,因此提出第4个猜想,利用本实验中的药品和装置完成实验并证明了猜想的成立,其实验操作为__________________________。
Na2CO3+H2O+CO2↑,根据以上实验结论,小组同学想探究一下碳酸钠是否能代替小苏打和酒石酸氢钾在溶液中发生反应,因此提出第4个猜想,利用本实验中的药品和装置完成实验并证明了猜想的成立,其实验操作为__________________________。
(6)通过以上实验探究,下列关于泡打粉的说法中,正确的是_____________。
A. 泡打粉保存时要注意防潮。
B. 蒸馒头时,先将泡打粉溶于水,再用此溶液与面粉和成面团。
C. 用碳酸钠替代小苏打制成的泡打粉蒸馒头时,也能起到膨松的效果。
D. 在用泡打粉蒸馒头时,在加水揉面过程与蒸的过程中均能起到蓬松作用。
【生产实际定量分析】
34. (3分)某氯碱工厂排放的尾气里含有毒的氯气(Cl2),为防止其污染空气,工厂用氢氧化钠溶液吸收氯气并得到消毒液[主要成分是次氯酸钠(NaClO)],此反应的化学方程式为:Cl2+2NaOH=NaClO+NaCl+H2O。若溶液中含有8kg的氢氧化钠。
计算:
(1)NaClO的相对分子质量为_____________。
(2)可得到次氯酸钠的质量_____________kg。
(3)写出求算氢氧化钠中氧元素质量分数的计算式:__________________________。
【试题答案】
1. B 2. C 3. D 4. A 5. A 6. B 7. D 8. A 9. D 10. D
11. C 12. B 13. C 14. B 15. C 16. A 17. C 18. B 19. B 20. C
21. (5分)(1)石油 CH4+2O2 CO2+2H2O;
CO2+2H2O;
(2)①2H2+O2 2H2O ②ABC
2H2O ②ABC
(3)ABC
22.(3分)(1)186.2 (2)硬度大、熔点高 (3)+7
23.(5分)(1)升华吸热
(2)CO2+H2O=H2CO3
(3)富氮空气
(4)单质 导电
24.(5分)(1)导致能源供需结构失衡,并带来严重的环境影响
(2)A (3)3:1
(4)H2O和CO (5)ABC
25.(3分)(1)CaCO3 (2)CaO+H2O=Ca(OH)2 (3)大于
26.(4分)(1)N2+3H2 2NH3 (2)混合物
2NH3 (2)混合物
(3)N2、H2 (4)-33.35℃~-195.8℃
27.(7分)(1)2KMnO4 K2MnO4+MnO2+O2↑ D
K2MnO4+MnO2+O2↑ D
3Fe+2O2 Fe3O4
Fe3O4
(2)CaCO3+2HCl=CaCl2+H2O+CO2↑,B,二氧化碳密度比空气大
将燃着的木条放在集气瓶口,若木条熄灭,则已集满。
28.(2分)(1)B (2)不断运动
29.(5分)(1)调节装置内外压强,形成装置封闭或防止胶塞被顶起
(2)Fe+CuSO4=FeSO4+Cu
(3)Na2CO3+2HCl=2NaCl+H2O+CO2↑
(4)C,装置不封闭,有二氧化碳气体逸出,称量的产物质量减少
30.(3分)(1)实验1和实验4 (2)证明酸性物质会使紫色石蕊变红
(3)实验4中紫色纸花变为红色,实验2和实验3中纸花不变红
31.(3分)(1)4P+5O2 2P2O5
2P2O5
(2)点燃酒精灯,b处红磷通氧气前不燃烧,通氧气后燃烧(或:点燃酒精灯时b处红磷通氮气时不燃烧,通氧气后燃烧)
(3)温度达到可燃物的着火点
32.(5分)(1)大于 遵守
(2)二氧化碳不燃烧,也不支持燃烧(注:出现密度大于空气不得分) 氧气
(3)CBA
33.(7分)
(1)H C O (2)CO2+Ca(OH)2=CaCO3↓+H2O
(3)不成立 (4)水 c试管中固体溶解,有气泡产生
(5)待实验1充分反应后,取试管a中剩余固体和酒石酸氢钾,放入装置2的试管c中,滴加一定量水后,观察
(6)ACD
34.(3分)(1)74.5 (2)7.45 (3)
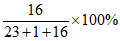

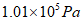 )
)