1. 本试卷分为I卷、II卷,共26个小题,满分100分;答题时间为90分钟
2. 可能用到的相对原子质量:
H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 Cu 64
I卷 选择题(共44分)
(共22道小题,每小题只有一个选项符合题意,每小题2分。)
1. 我国科学家为世界科技发展作出了重要贡献,下列属于我国科学家科研成果的是
①新一代抗疟药——双氢青蒿素的合成
②首次蛋白质的人工合成——结晶牛胰岛素
③提出原子论——为近代化学的发展奠定基础
④发现元素周期律——把元素化合物纳入统一的理论体系
A. ①② B. ③④ C. ①③ D. ②④
2. 垃圾分类有利于资源回收利用。下列垃圾的归类不合理的是
选项 | A | B | C | D |
垃圾 |
|
|
|
|
归类 |
|
|
|
|
3. 胶体区分于溶液和浊液的根本区别是
A. 是否是大量分子或离子的集合体 B. 是否能通过滤纸
C. 是否分散质粒子直径在1-100nm D. 是否均一、透明、稳定
4. 下列能导电且属于电解质的是
A. 铜 B. 稀硫酸
C. NaCl固体 D. 熔融KCl
5. 下列物质属于碱的是
A. C2H5OH B. Na2CO3
C. Ca(OH)2 D. Cu2(OH)2CO3
6. 酸溶液中都含有H+,因此不同的酸表现出一些共同的性质。下列关于H2SO4性质的描述中不属于酸的共同性质的是
A. 能使紫色石蕊溶液变红色 B. 能与烧碱反应生成水
C. 能与Na2CO3溶液反应生成气体 D. 能与Ba(OH)2溶液反应生成沉淀
7. 下列说法中,正确的是
A. 物质的量就是物质的质量
B. 摩尔既是物质的数量单位又是物质的质量单位
C. 摩尔质量等于物质的相对分子质量
D. 阿伏伽德罗常数可以近似表示为6.02×1023 mol-1
8. 下列叙述中,正确的是
A. 标准状况下,22.4 L水所含的水分子数目为NA
B. 常温常压下,等物质的量的CH4和CO所含的分子数相等
C. 1 LCO气体一定比1 LO2的质量小
D. 常温常压下,17 g氨气的体积约为22.4 L
9. 1 mol·L-1 硫酸溶液的含义是
A. 1 L水中含有1 mol硫酸
B. 1 L溶液中含1 mol H+
C. 将98 g硫酸溶于1 L水所配成的溶液
D. 1 L硫酸溶液中含有98 g H2SO4
10. 从1 L 1 mol·L-1 HCl溶液中取出200 mL,下列叙述不正确的是
A. 物质的量浓度为0.2 mol·L-1 B. 含溶质的物质的量为0.2 mol
C. 含溶质7.3 g D. 与1 L 0.2mol·L-1 NaOH溶液恰好中和
11. 下列关于钠及其化合物的叙述不正确的是
A. 钠与水反应放出热量
B. Na2O与Na2O2均能与水反应生成NaOH
C. 钠切开后,光亮的表面迅速变暗,是因为生成了Na2O
D. 除去NaHCO3溶液中含有的少量Na2CO3,可加入适量NaOH
12. 氯气通入紫色石蕊试液中,溶液由紫色→红色→无色。导致变色的微粒依次是
A. H+、Cl– B. H+、HClO
C. HCl、Cl2 D. HClO、ClO–
13. 下列实验现象的描述正确的是
A. 钠在空气中燃烧,发出黄色火焰,生成白色固体
B. 氢气在氯气中燃烧,发出苍白色火焰,瓶口上方有白雾
C. 钠在氯气中燃烧,发出黄色火焰,产生淡黄色固体
D. 铁丝在氯气中燃烧,产生红棕色烟,产物溶于水,溶液呈浅绿色
14. 下列反应不能发生的是
A. KHCO3+HCl=KCl+CO2↑+H2O
B. AgNO3+NaCl=AgCl↓+NaNO3
C. Cu+2AgNO3=Cu(NO3)2+2Ag
D. 2HCl+Na2SO4=2NaCl+H2SO4
15. 下列盐酸参与的反应中,HCl被氧化的是
A. NaOH+HCl=NaCl+H2O
B. Fe+2HCl=FeCl2+H2↑
C. CuO+2HCl=CuCl2+H2O
D. MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
16. 下列反应过程需要加入氧化剂才能实现的是
A. Ca(ClO)2→Cl2 B. H2O2→O2
C. SO3→H2SO4 D. Na→NaOH
17. 下列反应的离子方程式书写正确的是
A. 稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑
B. 稀盐酸与澄清石灰水混合:2H++Ca(OH)2=Ca2++2H2O
C. 醋酸滴在大理石上:CO32-+2H+=H2O+CO2↑
D. 氧化铁与稀盐酸混合:Fe2O3+6H+=2Fe3++3H2O
18. 在某酸性溶液中,能共存的离子组是
A. Na+、K+、SO42-、CO32- B. Na+、K+、Cl–、NO3–
C. Na+、K+、OH–、NO3– D. Ag+、K+、SO42-、Cl–
19. 已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2的氧化性依次减弱,下列反应在水溶液中不可能发生的是
A. 3Cl2+6Fel2=2FeCl3+4FeI3
B. Co2O3+6HCl=2CoCl2+Cl2↑+3H2O
C. Cl2+2KI=2KCl+I2
D. 2FeCl2+Cl2=2FeCl3
20. 已知反应:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。下列说法不正确的是
A. Cu被氧化,NO是还原产物 B. 氧化剂和还原剂的物质的量比为8:3
C. HNO3体现氧化性和酸性 D. 若反应掉32gCu,转移电子数为6.02×1023
21. 铋(Bi)原子最外层有5个电子,其价态为+3价时较稳定,Bi2(SO4)3和铋酸钠(NaBiO3)溶液均为无色。现取一定量的硫酸锰(MnSO4)溶液,向其中依次滴加下列溶液,对应实验现象如下表所示:
加入溶液 | ①适量铋酸钠溶液 | ②过量的双氧水 | ③适量淀粉-KI溶液 |
实验现象 | 溶液呈紫红色 | 溶液紫红色消失,产生气泡 | 溶液变成蓝色 |
则NaBiO3、KMnO4、I2、H2O2的氧化性由强到弱的顺序为
A. I2、H2O2、KMnO4、NaBiO3 B. H2O2、I2、NaBiO3、KMnO4
C. NaBiO3、KMnO4、H2O2、I2 D. KMnO4、NaBiO3、I2、H2O2
22. 探究Na2O2与水的反应,实验如下:
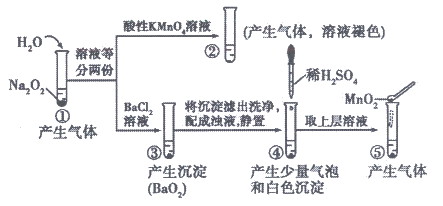
(已知:H2O2 H++HO2–、HO2–
H++HO2–、HO2– H++O22-)
H++O22-)
下列分析不正确的是
A. ①、⑤中产生的气体能使带火星的木条复燃
B. ①、④中均发生了氧化还原反应和复分解反应
C. ②、⑤中KMnO4与MnO2的作用不同,产生气体的量也不同
D. 沉淀经过滤、洗涤、干燥后称量:④中反应后的沉淀质量小于③中所得沉淀质量
II卷 非选择题(共56分)
23. (10分)标况下11.2 L CH4的质量是________g,其中含有H数目为________个。
实验室需要配制0.2 mol·L-1 NaOH溶液500 mL。
(1)实验中用到的玻璃仪器有________
A. 500 mL容量瓶 B. 烧杯
C. 胶头滴管 D. 酒精灯
(2)计算。配制该溶液需要NaOH固体________g。
(3)称量。下侧的称量装置有两处错误,分别是________。

(4)溶解、冷却。该步实验中需要使用玻璃棒,目的是________。
(5)转移、洗涤。在转移时应使用________引流;需要洗涤烧杯、玻璃棒2~3次是为了________________。
(6)定容、摇匀。
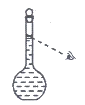
(7)将配好的溶液静置一段时间后,倒入指定的试剂瓶,并贴好标签,注明配制的溶液名称及浓度。
(8)在配制过程中,某同学观察定容时液面情况如上图所示,所配溶液的浓度会________(填”偏高””偏低”或”无影响”)。
24. (18分)钠及其化合物在人类生产生活中有着重大的作用。金属钠要隔绝空气,密封保存,请用化学方程式表示原因(Na参与的反应)________,________。
I:加热条件下,Na可以在氧气中燃烧,反应的化学方程式为________;现象是________。
某课外活动小组设计了下列装置,证实二氧化碳跟过氧化钠反应时需要与水接触。
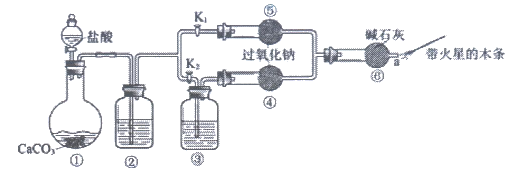
【装置分析】
(1)装置①中反应的离子方程式是________________。
(2)装置②中的试剂是为了除去CO2中混有的HCl,则可选用的试剂为________。
a. 饱和NaOH溶液 b. 饱和Na2CO3溶液 c. 饱和NaHCO3溶液
(3)装置③中的试剂是________。
【进行实验】
步骤1:打开弹簧夹K2,关闭K1,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
步骤2:打开弹簧夹K1,关闭K2,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
(4)步骤1和步骤2中,a处带火星的木条产生的实验现象分别是________、________。
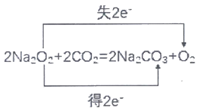
(5)过氧化钠跟二氧化碳反应的化学方程式并用双线桥标出电子转移:
________________。
(6)若要证明CO2和Na2O2发生了反应,需要取出少量反应后的固体,________(请补全实验方案)。
II:(7)面粉发酵时会产生有机酸(用HA表示其化学式,HA酸性强于碳酸),影响口感。我们可以加入膨松剂(主要含NaHCO3),那么蒸出来的馒头蓬松柔软,且口感好。若加入过量的膨松剂,请写出蒸馒头时反应的化学方程式________,________。该过程能体现出Na2CO3和NaHCO3的热稳定性________>_________。
25.(10分)Cl2是一种重要的化工原料,在生产、生活和工业上均有很多用途。
(1)可与氢气化合制得盐酸,化学方程式为___________。
(2)可与NaOH溶液反应制得漂白液(84消毒液),离子方程式为___________。
(3)可用于工业上制得高锰酸钾(KMnO4),KMnO4中Mn的化合价为___________。
其工业制备的部分工艺如下:
I. 将软锰矿(主要成分为MnO2)粉碎后,与KOH固体混合,通入氯气充分焙烧,生成暗绿色熔融态物质。
II. 冷却,将固体研细,用稀KOH溶液浸取,过滤,得暗绿色溶液。
III. 向暗绿色溶液中通入CO2,溶液变为紫红色,同时生成黑色固体。
IV. 过滤,将紫红色溶液蒸发浓缩,冷却结晶,过滤,洗涤,干燥,得KMnO4固体。
资料:K2MnO4为暗绿色固体,在强碱性溶液中稳定,在近中性或酸性溶液中易发生歧化反应(Mn的化合价既升高又降低)。
①I中,粉碎软锰矿的目的是______________________。
②I中,生成K2MnO4的化学方程式是______________________。
③II中,浸取时用稀KOH溶液的原因是_________________________________
④III中,CO2和K2MnO4在溶液中反应的离子方程式是
MnO42-+CO2+H2O→MnO4–+MnO2↓+HCO3–(未配平),
氧化产物和还原产物的物质的量之比为___________。
26. (18分)SO2是一种有毒气体,是大气污染物,但它也有很多用途。
I:SO2易溶于水,能部分与水化合生成一种二元酸,写出该反应的化学方程式___________。
根据硫元素化合价预测,SO2应具有的化学性质是____________________。
已知:SO2不能与盐酸和硫酸反应,但可以与硝酸反应,配平该反应:
________SO2+________NO3–+________H2O=________SO42-+________NO+________H+
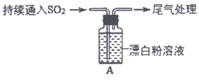
II:现在小新和小冠同学对SO2与漂白粉的反应进行实验探究:
操作 | 现象 |
取4 g漂白粉固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
过滤,测漂白粉溶液的pH | pH试纸先变蓝(约为12),后褪色 |
| i. 液面上方出现白雾; ii. 稍后,出现浑浊,溶液变为黄绿色; iii. 稍后,产生大量白色沉淀,黄绿色褪去 |
(1)Cl2和Ca(OH)2制取漂白粉的化学方程式_____________。
(2)pH试纸颜色的变化说明漂白粉溶液具有的性质是_____________。
(3)小新推测现象i的白雾是盐酸小液滴,并进行如下实验,请写出相应的现象:
a. 用湿润的紫色石蕊试纸检验白雾,_____________;
b. 用硝酸酸化的AgNO3溶液检验白雾,_____________。
小新同学认为可以得出结论:白雾是盐酸小液滴。
但是小冠同学查阅资料,发现Ag2SO4为白色固体,微溶于水,不溶于硝酸。小冠结合SO2的性质,分析小新的实验,他认为小新的结论不可靠。小冠的理由是:白雾中可能也含有SO2,____________________________________________________。
(4)现象ii中溶液变为黄绿色的可能原因:随溶液酸性增强,漂白粉的主要成分发生反应。
请写出离子方程式___________。
(5)将反应后A瓶中混合物过滤、洗涤,得到沉淀X和滤液Y。
①取滤液Y,加入稀HCl,无明显变化,再加入BaCl2溶液,产生白色沉淀。则说明滤液Y中含有的离子是____________,沉淀X为_____________。
②用离子方程式解释现象iii中黄绿色褪去的原因:_________________________。
参考答案
选择题:
1-10:ABCDC DDBDA
11-22:DBBDD DDBAB CD
23. (10分)8, 1.204×1024
(1)ABC (2)4.0(4也得分)
(3)应该左物右码:在小烧杯中称量(2分)
(4)搅拌,加速NaOH溶解
(5)玻璃棒 保证溶质全部转移到容量瓶中
(8)偏低
24. (18分)4Na+O2=2Na2O 2Na+2H2O=2NaOH+H2↑
I. 钠熔成小球,燃烧,发出黄色火焰,生成淡黄色固体(2分);
2Na+O2=Na2O2(加热或点燃)
(1)CaCO3+2H+=Ca2++H2O+CO2↑(2分)
(2)c
(3)浓硫酸
(4)无明显现象(不复燃)、带火星木条复燃
(5)
 (2分)
(2分)
(6)溶于水,加入过量稀硫酸(或盐酸),将生成的气体导入澄清石灰水,若变浑浊,则说明两者反应了(2分)
II. (7)HA+NaHCO3=NaA+H2O+CO2↑
2NaHCO3=Na2CO3+H2O+CO2↑(加热),
Na2CO3>NaHCO3
25.(10分)(1)H2+Cl2=2HCl(点燃)
(2)Cl2+2OH–=ClO–+Cl–+H2O(2分)
(3)+7
①增大反应物接触面积,加快反应速率,充分反应(2分)
②MnO2+4KOH+Cl2 K2MnO4+2KCl+2H2O(2分)
K2MnO4+2KCl+2H2O(2分)
③保持溶液呈强碱性,防止K2MnO4发生歧化反应
④2:1
26. (18分)I. SO2+H2O H2SO3;
H2SO3;
氧化性和还原性;
3 2 2 3 2 4 (2分)
II. (1)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2 2H2O(2分)
(2)碱性、漂白性(2分)
(3)a试纸变红:b产生白色沉淀。
与水反应生成H2SO3,也能使石蕊变红,与硝酸酸化的AgNO3溶液反应也生成白色沉淀。(2分)
(4)ClO–+Cl–+2H+=Cl2+H2O(2分)
(5)①SO42-(1分) CaSO4(1分)
②Cl2+SO2+2H2O=4H++2Cl–+SO42-(2分)