本试卷分为I卷、II卷两部分,共19个小题,满分100分;答题时间为90分钟
I卷 选择题(共42分)
每题一个正确选项,3分/题,共14题,共42分
1. 下列电池工作时,O2在正极放电的是
A. 锌锰电池 B. 氢燃料电池 C. 铅蓄电池 D. 镍镉电池
2. 下列装置中,都伴随有能量变化,其中是由电能转变为化学能的是

A. 电解水 B. 水力发电 C. 太阳能热水器 D. 干电池
3. 关于铜板上铁铆钉处的吸氧腐蚀的下列说法中,不正确的是
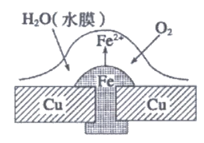
A. 正极电极反应式为2H++2e–=H2↑
B. 此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
C. 此过程中铜并不被腐蚀
D. 此过程中电子从Fe移向Cu
4. 依据图示关系,下列说法不正确的是
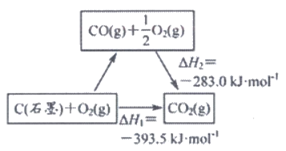
A. 石墨燃烧是放热反应
B. 1 mol C(石墨)和1 mol CO分别在足量O2中燃烧,全部转化为CO2,前者放热多
C. C(石墨)+CO2(g)=2CO(g) △H=△H1-△H2
D. 化学反应的△H,只与反应体系的始态和终态有关,与反应途径无关
5. 将如图所示实验装置的K闭合(已知:盐桥中装有琼脂凝胶,内含KCl),下列判断正确的是
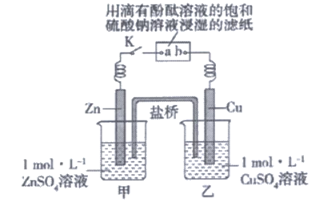
A. Cu电极上发生氧化反应
B. 电子沿Zn→a→b→Cu路径移动
C. 片刻后甲池中c(Cl–)增大
D. 片刻后可观察到滤纸b处变红色
6. 下列反应在任何温度下都无法自发进行的是
A. 2SO2(g)+O2(g)=2SO3(g) △H=-197.78 kJ·mol-1
B. C(s)+CO2(g)=2CO(g) △H=+172.47 kJ·mol-1
C. AgCl(s)+Br–(aq)=AgBr(s)+Cl–(aq) △H=-18.9 kJ·mol-1
D. 3O2(g) 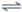 2O3(g) △H=+285.4 kJ·mol-1
2O3(g) △H=+285.4 kJ·mol-1
7. 电石(主要成分为CaC2)是重要的基本化工原料。已知2000℃时,电石生产原理如下:
①CaO(s)+C(s)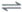 Ca(g)+CO(g) △H1=a kJ·mol-1 平衡常数K1
Ca(g)+CO(g) △H1=a kJ·mol-1 平衡常数K1
②Ca(g)+2C(s)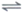 CaC2(s) △H2=b kJ·mol-1 平衡常数K2
CaC2(s) △H2=b kJ·mol-1 平衡常数K2
下列说法不正确的是
A. 反应①K1=c平(Ca)·c平(CO)
B. 反应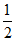 Ca(g)+C(s)
Ca(g)+C(s) CaC2(s)平衡常数K=
CaC2(s)平衡常数K=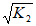
C. 2000℃时增大压强,K1减小,K2增大
D. 反应2CaO(s)+CaC2(s) 3Ca(g)+2CO(g) △H=(2a-b) kJ·mol-1
3Ca(g)+2CO(g) △H=(2a-b) kJ·mol-1
8. 在一密闭容器中,CO和H2O混合加热到800℃达到下列平衡:
CO(g)+H2O(g) CO2(g)+H2(g),K=1.0,若反应开始时CO和H2O的浓度分别为0.20 mol/L和1.00 mol/L,则CO的平衡转化率为
CO2(g)+H2(g),K=1.0,若反应开始时CO和H2O的浓度分别为0.20 mol/L和1.00 mol/L,则CO的平衡转化率为
A. 80% B. 83% C. 75% D. 91%
9. 把1 mol CO2和3 mol H2通入1 L的密闭容器中,在某温度下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) (△H<0)。测得CO2和CH3OH的浓度随时间的变化如图所示,下列说法正确的是
CH3OH(g)+H2O(g) (△H<0)。测得CO2和CH3OH的浓度随时间的变化如图所示,下列说法正确的是
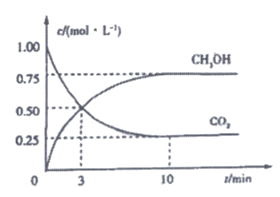
A. 3 min时,v正=v逆
B. 0-10 min内,用H2表示的反应速率为 2.25 mol·L-1 ·min-1
C. 该温度下,反应达到平衡时,H2的转化率为75%
D. 若升高温度,则CO2的转化率增大
10. 下列实验方案不能达到相应目的的是
A | B | C | D | |
目的 | 研究温度对化学 平衡的影响 | 研究浓度对化学 平衡的影响 | 实现铜棒镀银 | 证明化学反应存 在一定的限度 |
实验方案 |
|
|
|
|
11. 如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。下列分析正确的是
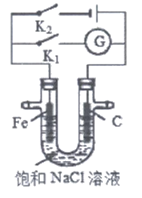
A. K1闭合,铁棒上发生的反应为2H++2e–=H2↑
B. K1闭合,石墨棒周围溶液pH逐渐降低
C. K2闭合,铁棒不会被腐蚀,属于外加电流阴极保护法
D. K2闭合,电路中通过0.4 NA个电子时,两极共产生4.48L气体
12. 控制合适的条件,将反应2Fe3++2I–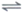 2Fe2++I2设计成如图所示原电池。下列判断不正确的是
2Fe2++I2设计成如图所示原电池。下列判断不正确的是
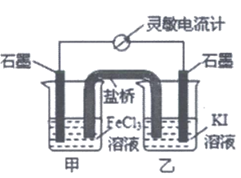
A. 反应开始时,电流方向是从甲池石墨棒流向乙池石墨棒
B. 反应开始时,甲中石墨电极上Fe3+被还原
C. 电流计读数为零时,反应达到化学平衡状态
D. 电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极
13. 用下图所示装置及试剂进行铁的电化学腐蚀实验探究,测定具支锥形瓶中压强随时间变化关系以及溶解氧随时间变化关系的曲线如下。
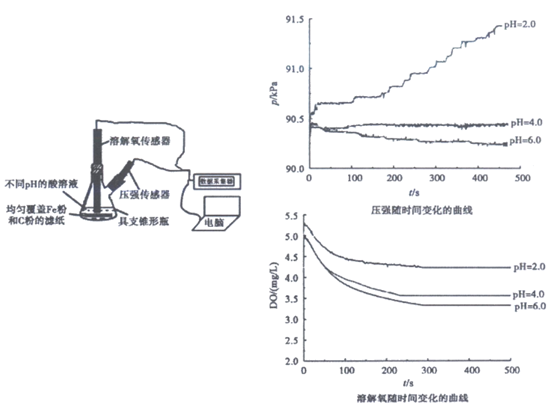
下列说法不正确的是
A. 压强增大主要是因为产生了H2
B. 整个过程中,负极电极反应式为:Fe-2e–=Fe2+
C. pH=4.0时,不发生析氢腐蚀,只发生吸氧腐蚀
D. pH=2.0时,正极电极反应式为:2H++2e–=H2↑和O2+4e–+4H+=2H2O
14. 一定温度下,反应I2(g)+H2(g) 2Hl(g)在密闭容器中达到平衡时,测得c(I2)=0.11 mmol·L-1,c(HI)=0.78mmol·L-1。相同温度下,按下列4组初始浓度进行实验,反应最有可能逆向进行的是(注:1 mmol·L-1=10-3 mol·L-1)
2Hl(g)在密闭容器中达到平衡时,测得c(I2)=0.11 mmol·L-1,c(HI)=0.78mmol·L-1。相同温度下,按下列4组初始浓度进行实验,反应最有可能逆向进行的是(注:1 mmol·L-1=10-3 mol·L-1)
A | B | C | D | |
c(I2)/mmol·L-1 | 1.00 | 0.22 | 0.44 | 0.11 |
c(H2)/mmol·L-1 | 1.00 | 0.22 | 0.44 | 0.44 |
c(HI)/mmol·L-1 | 1.00 | 1.56 | 4.00 | 1.56 |
II卷 非选择题 (共58分)
15. (8分)某同学设计用碱性甲烷—空气燃料电池,研究电解饱和NaCl溶液和粗铜的精炼原理。
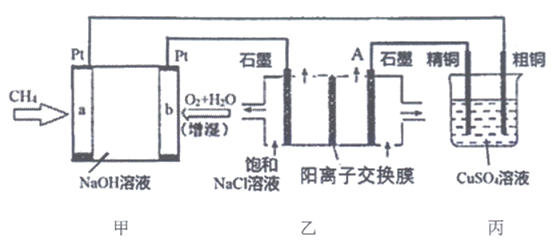
(1)甲池中b电极的电极反应式_________。
(2)乙装置中物质A是_________(填化学式),乙池的总化学反应方程式_________。
(3)请判断丙装置的连接是正确还是错误_________(填写”正确”或”错误),如果错误,请指出错误之处_________(如果正确,此空不填)。
16. (14分)一定温度下,向一容积为5 L的恒容密闭容器中充入0.4 mol SO2和0.2 mol O2,发生反应:2SO2(g)+O2(g) 2SO3(g) △H=-196 kJ·mol-1。当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
2SO3(g) △H=-196 kJ·mol-1。当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
(1)判断该反应达到平衡状态的标志是_________(填字母)。
a. SO2、O2、SO3三者的浓度之比为2:1:2
b. 容器内气体的压强不再变化
c. 容器内混合气体的密度保持不变
d. SO3的物质的量不再变化
e. SO2的生成速率和SO3的生成速率相等
(2)①有利于提高SO2的平衡转化率的措施有:__________。
a. 使用催化剂 b. 降低温度 c. 及时分离出SO3
②其他条件不变时,减小压强(拉升容器使容积为原来的两倍),平衡将向逆反应方向移动,请利用K、Q的关系说明理由:__________。
(3)①SO2的平衡转化率为___________。
②此温度下该反应的平衡常数K=__________。
(4)如图表示平衡时SO2的体积分数随压强和温度变化的曲线,则:
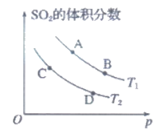
①温度关系:T1_________T2(填”>””<“或”=”,下同)。
②平衡常数关系:KA_________KB,KA_________KD。
17. (14分)随着人类社会的发展,氮氧化物的排放导致一系列环境问题。
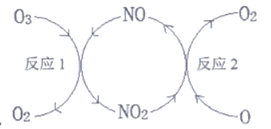
(1)NO加速臭氧层被破坏,其反应过程如上图所示:
①NO的作用是_________。
②已知:O3(g)+O(g)=2O2(g) △H=-143 kJ/mol
反应1:O3(g)+NO(g)=NO2(g)+O2(g) △H1=-200.2 kJ/mol
反应2:热化学方程式为__________。
(2)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
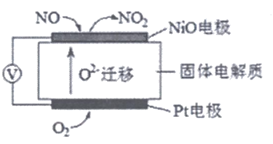
①Pt电极上发生的是___________反应(填”氧化”或”还原”)。
②写出NiO电极的电极反应式:___________。
(3)电解NO制备NH4NO3是处理氮氧化物的排放的方法之一,其工作原理如下图所示:
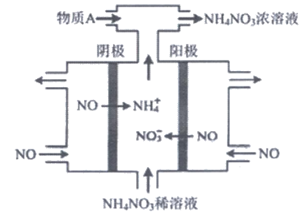
①阴极的电极反应式:_________。
②为使电解产物全部转化为NH4NO3需补充物质A,
A是_________,说明理由:_________。
18. (8分)碘及其化合物在生产中应用广泛。
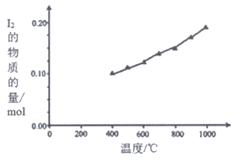
(1)在2HI(g) H2(g)+I2(g)反应中,三种分子化学键断裂时能量变化如图1所示。其他条件相同,1 mol HI在不同温度分解达平衡时,测得体系中I2的物质的量随温度变化的曲线如图2所示。
H2(g)+I2(g)反应中,三种分子化学键断裂时能量变化如图1所示。其他条件相同,1 mol HI在不同温度分解达平衡时,测得体系中I2的物质的量随温度变化的曲线如图2所示。
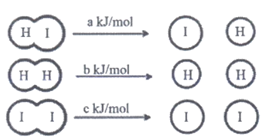
(a、b、c均大于零)
图1 图2
分析图1和图2,比较2a________ b+c(填”<“、”>”或”=”),理由是__________。
(2)碱性条件下I2可以转化为IO3–。电解KI溶液制备KIO3的工作原理如下图所示。电解过程中观察到阳极液变蓝,一段时间后又逐渐变浅。
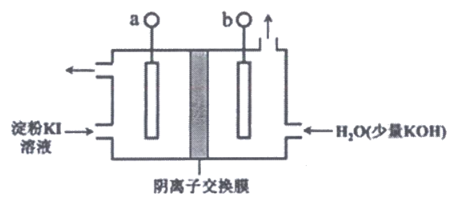
①a连接电源的__________极。
②结合实验现象和电极反应式说明制备KIO3的原理:__________。
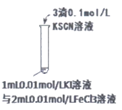
19. (14分)用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生。某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1mol/L的FeCl2溶液,研究废液再生机理。
记录如下(a、b、c代表电压数值):
序号 | 电压/V | 阳极现象 | 检验阳极产物 |
I | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
II | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
III | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
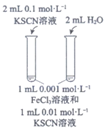
(1)用KSCN检验出Fe3+的现象是__________。
(2)I中,Fe3+产生的原因可能是Cl–在阳极放电,生成的Cl2将Fe2+氧化。写出有关反应__________。
(3)由II推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有__________性。
(4)II中虽未检验出Cl2,但Cl–在阳极是否放电仍需进一步验证。电解pH=1的NaCl溶液做对照实验,记录如下:
序号 | 电压/V | 阳极现象 | 检验阳极产物 |
IV | a>x≥c | 无明显变化 | 有Cl2 |
V | c>x≥b | 无明显变化 | 无Cl2 |
①NaCl的浓度是________mol/L。
②IV中检测Cl2的实验方法___________。
③与II对比,得出的结论(写出两点):__________。
参考答案
一、选择题(共14题,3分/题,共42分)
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
答案 | B | A | A | C | C | D | C |
题号 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
答案 | B | C | D | C | D | C | C |
二、非选择题(共58分)
15. (8分)
(1)O2+4e–+2H2O=4 OH–
(2)H2 2NaCl+2H2O 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
(3)错误(1分) 粗铜做阳极,精铜做阴极。(1分)
16. (14分)
(1)bde
(2)①bc
②减小压强,各物质浓度变为原来的一半,根据浓度商表达式可知,减小压强后Q>K,平衡向逆反应方向移动。
(3)①90%
②20 250 mol-1·L或(mol·L-1)-1
(4)①>
②=(1分) <(1分)
17. (14分)
(1)①催化剂
②NO2(g)+O(g)=NO(g)+O2(g) △H=+57.2 kJ/mol
(2)①还原
②NO+O2--2e–=NO2
(3)①NO+5e–+6H+=NH4++H2O
②NH3或NH3·H2O 根据反应8NO+7H2O 3NH4NO3+2HNO3,电解产生的HNO3多
3NH4NO3+2HNO3,电解产生的HNO3多
18. (8分)
(1)① > 理由是:温度升高,I2的物质的量增大,2HI(g)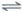 H2(g)+I2(g) △H>0
H2(g)+I2(g) △H>0
又△H=2a-(b+c)>0,故2a>b+c
(2)①正极 (1分)
②阳极:2I–-2e–=I2,阴极:2H2O+2e–=H2+2OH–,OH–透过阴离子交换膜向阳极区移动,I2与阳极室的KOH反应转化成KIO3,导致蓝色消失 (3分)
19. (14分)
(1)溶液变红
(2)2Cl–-2e–=Cl2 Cl2+2Fe2+=2Cl–+2Fe3+
(3)还原
(4)①0.2
②取少量阳极附近的溶液,滴在淀粉KI试纸上,试纸变蓝
③通过控制电压,证实了产生Fe3+的两种原因都成立(1分)
通过控制电压,验证了Fe2+先于Cl–放电 (1分)