1. 本试卷分为Ⅰ卷、Ⅱ卷,共26个小题,满分100分;答题时间为90分钟;全部答案在答题卡上完成,答在本试题上无效。
2. 可能用到的相对原子质量:H 1 O 16 Na 23
Ⅰ卷 选择题(共42分)
(共21道小题,每小题只有一个选项符合题意,每小题2分)
1. 我国科学家屠呦呦因发现抗疟新药青蒿素(分子式为C15H22O5)荣获2015年诺贝尔生理学或医学奖。青蒿素属于(
)
A. 单质 B. 氧化物
C. 混合物 D. 有机物
2. 下列有关化学用语使用不正确的是( )
A. 乙烯的结构简式: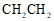
 B. 丙烯的键线式:
B. 丙烯的键线式: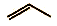
C. 丙烷分子的球棍模型: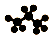 D. 乙醇的分子式
D. 乙醇的分子式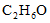
3. 下列有机化合物中属于同分异构体的正确组合是(
)
①CH3CH2CH2CH2CH3
②CH3CH2CH2CH2CH2CH3
③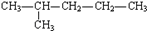
④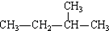
⑤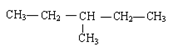
A. ①和③ B. ②③⑤ C. ①和② D. ③和④
4. 可以鉴别乙烷和乙烯气体的试剂是( )
A. 水 B. H2 C. 酸性KMnO4溶液 D. NaOH溶液
5. 下列说法不正确的是( )
A. 石油的分馏是物理变化,而裂化和裂解属于化学变化
B. 煤的干馏是将煤隔绝空气加强热,获取多种化工原料的过程
C. 淀粉和蛋白质都能发生水解反应,且均属于天然高分子化合物
D. CH3CH CH2是乙烯的同系物,是生产聚丙烯塑料(
CH2是乙烯的同系物,是生产聚丙烯塑料(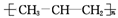 )的原料
)的原料
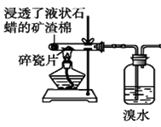
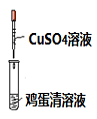
6. 实验是化学研究的基础。下列对实验现象、结论或分析错误的是( )
|
|
|
|
① | ② | ③ | ④ |
A. 实验①中溴水褪色,说明石蜡分解产生烯烃
B. 实验②试管中出现白色沉淀,发生的是蛋白质的盐析过程
C. 实验③试管内现象说明苯分子中不含碳碳双键,且苯密度比水轻
D. 实验④中试管内蓝色沉淀转化成砖红色沉淀,该实验可以用于检验葡萄糖
7. 下列由实验得出的结论正确的是( )
实验 | 结论 | |
A. | 将乙烯通入溴的四氯化碳溶液,溶液最终变为无色透明 | 生成的1,2-二溴乙烷无色、可溶于四氯化碳 |
B. | 乙醇和水都可与金属钠反应产生可燃性气体 | 乙醇分子中的氢与水分子中的氢具有相同的活性 |
C. | 用乙酸浸泡水壶中的水垢,可将其清除 | 乙酸的酸性小于碳酸的酸性 |
D. | 甲烷与氯气在光照下反应后的混合气体能使湿润的石蕊试纸变红 | 生成的氯甲烷具有酸性 |
8. 我国在CO2催化加氢制取汽油方面取得突破性进展,CO2转化过程示意图如下:

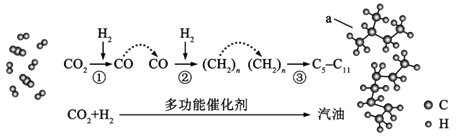
下列说法不正确的是( )
A. 反应①的产物中含有水 B. 反应②中只有碳碳键形成
C. 汽油主要是C5~C11的烃类混合物 D. 图中a的名称是2-甲基丁烷
9. 苹果酸的结构简式为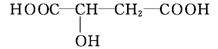 ,下列说法正确的是( )
,下列说法正确的是( )
A. 苹果酸中能发生酯化反应的官能团有2种
B. 1 mol苹果酸可与3 mol NaOH发生中和反应
C. 1 mol苹果酸与足量金属Na反应生成1 mol H2
D. HOOC—CH2—CHOHCOOH与苹果酸互为同分异构体
10. 钛(Ti)常被称为未来钢铁,已探明中国钛储量居世界首位。下列关于 4822 Ti 的说法中,不正确的是( )
A. 质子数为22 B. 质量数为70
C. 中子数为26 D. 核外电子数为22
11. 下列关系正确的是( )
A. 碱性:Al(OH)3>Mg(OH)2 B. 与H2O反应的剧烈程度:Na>Mg
C. 酸性:H3PO4>H2SO4 D. 与H2化合的容易程度:S>Cl2
12. 下列关于碱金属元素的说法,不正确的是( )
A. 碱金属单质与氧气反应越来越剧烈
B. Cs与水反应发生爆炸
C. 碱金属元素的氧化物的水化物碱性从上至下逐渐增强
D. Li、Na、K的还原性渐弱
13. 下列实验事实,不能用元素周期律解释的是( )
A. Al(OH)3与NaOH溶液反应,Mg(OH)2不与NaOH溶液反应
B. F2在暗处遇H2爆炸,I2在暗处遇H2几乎不反应
C. 表面积相同的镁条和铝条分别与等量相同的稀HCl反应,镁条反应更剧烈
D. 向Na2S溶液中加入稀HCl,产生臭鸡蛋气味的H2S
14. 从海带中提取碘单质,成熟的工艺流程如下,下列关于海水制碘的说法不正确的是(
)
干海带海带灰悬浊液滤液碘水I2的CCl4溶液I2
A. 在蒸发皿中灼烧干海带,并用玻璃棒搅拌
B. 往含I-的滤液中加入稀硫酸和双氧水后,I-发生氧化反应
C. 在碘水中加入几滴淀粉溶液,溶液变蓝色
D. 将碘水加入CCl4中,通过萃取、分液得到I2的CCl4溶液
15. 四种短周期元素X、Y、Z、W的最外层电子数之和为16,其中X、Y、Z的电子层数相同,W原子的核外电子层数与其他三种不同,X元素的焰色反应呈黄色,Y元素的原子得到2个电子所得到的微粒具有与氩原子相同的电子层结构,Z元素的原子其M层电子数比K层多1个电子。下列推断正确的是( )
A. 原子半径:Y<W
B. 简单离子半径:W>X>Y
C. Z的最高价氧化物对应水化物和某些强酸、强碱均能发生反应
D. Y、W分别和氢元素形成的化合物的水溶液都呈酸性
16. 下列物质中,既含有离子键又含有共价键的是( )
A. CaO B. CH4 C. KOH D. MgCl2
17. 如图是Zn和Cu组成的原电池示意图,某小组做完该实验后,在读书卡片上作了如下记录,其中合理的是( )
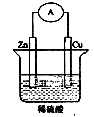
实验记录:①导线中电流方向:锌→铜;②铜极上有气泡产生;③锌片变薄
实验结论:④Zn为正极,Cu为负极;⑤铜比锌活泼⑥H+向铜片移动
A. ①②③ B. ④⑤⑥ C. ③④⑤ D. ②③⑥
18. 在25 ℃和101 kPa的条件下:
化学键 | H—H | Cl—Cl | H—Cl |
键能/(kJ·mol-1) | 436 | 243 | 431 |
对于反应H2(g)+Cl2(g)===2HCl(g)的能量变化描述正确的是(
)
A. 断开1 mol H2中的H—H键需要放出436 kJ的能量
B. 生成2 mol HCl中的H—Cl键需要放出431 kJ的能量
C. 由键能数据分析,该反应属于吸热反应
D. 2 mol HCl(g)的能量比1 mol H2(g)和1 mol Cl2(g)的总能量低
19. 下列做法利用了温度对化学反应速率的影响的是( )
A. 在淀粉水溶液中加入唾液进行淀粉水解实验
B. 做粉尘爆炸实验中选用很细的面粉
C. 将食物保存在冰箱里
D. 铁与稀盐酸反应太慢时加入较浓的盐酸
20. 一定温度下,在容积为2 L的密闭容器中进行某一反应,容器内M、N两种气体的物质的量随时间的变化曲线如图所示。据图可知(
)
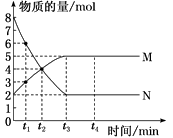
A. 该反应的化学方程式为N(g)
 2M(g)
2M(g)
B. t1~t2时间内,v(M)= mol·L-1·min-1
C. t2时,正逆反应速率相等,反应达到平衡状态
D. 平衡时,物质N的转化率为75%
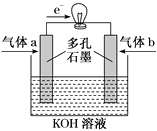
21. 油库中为强化安全管理,设置了空气中汽油含量测量仪,其工作原理如图所示(用强酸性溶液作电解质溶液。下列说法不正确的是(
)
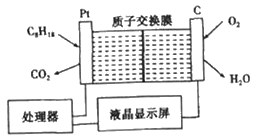
资料:质子交换膜是仅让H+通过的膜。
A. 石墨电极做正极,发生还原反应
B. Pt电极的电极反应式为:C8H18+16H2O-50e–=8CO2↑+50H+
C. H+由质子交换膜右侧向左侧迁移
D. 每消耗1mol O2,电路中通过4 mol电子
II卷 非选择题(共58分)
22.(8分)为探究乙醇的性质,某化学课外小组设计了如下实验方案。
方案Ⅰ:在盛有少量无水乙醇的试管中,加入一粒除去煤油的金属钠,在试管口迅速塞上配有尖嘴导管的单孔塞,点燃放出的气体,并把一干燥的小烧杯罩在火焰上,在烧杯壁上出现液滴后,迅速倒转烧杯,向烧杯中加入少量的澄清石灰水,观察有无浑浊产生。
(1)请写出乙醇与钠反应的化学方程式:____________________。
(2)以上实验设计因缺少必要的步骤而存在安全隐患,请你指出所缺少的必要步骤是__。
(3)若向烧杯中加入少量澄清石灰水后发现有浑浊,则燃烧产生CO2的物质最可能是___________(写名称)。
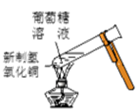
方案Ⅱ:(1)取一根铜丝,把其中一端绕成螺旋状(增大接触面积)。点燃一盏酒精灯,把绕成螺旋状一端的铜丝移到酒精灯外焰上灼烧(如图),观察到的实验现象是______。
(2)把螺旋状铜丝往酒精灯内焰移动,观察到的实验现象是__________,用化学方程式表示该现象产生的原理:______________。
23.(17分)如图所示,已知有机物A的相对分子质量是28,它的产量是衡量一个国家石油化工水平的标志,B和D都是日常生活食品中常见的有机物,E是具有浓郁香味、不易溶于水的油状液体,F是一种高聚物,生活中用于制造食物保鲜膜。
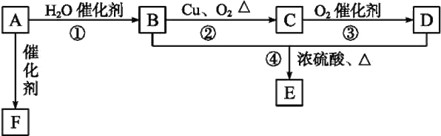
(1)请写出B中官能团的电子式:____,C和D中官能团的名称分别是:____、____;
(2)请写出下列反应的类型:①________,②______,④________。
(3)请写出下列物质转化的化学方程式:
A→F____________;
B→C____________;
B+D→E__________。
Ⅱ. 在实验室可以用如图所示的装置进行B与D的反应,请回答下列问题:
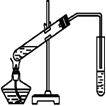
(1)装置中通蒸气的导管要插在______溶液的液面上方,而不能插入溶液中的原因是为了____________,该溶液的作用是____。
(2)若要把制得的乙酸乙酯分离出来,应采用的实验操作是______。
24.(12分)元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表列出了a
~
h 8种元素在周期表中的位置。
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 |
| a | ||||||
3 | b | c | d | e | f | |||
4 | g | h |
(1)请用电子式表示c与f形成化合物的过程________。
(2)a
~
h 8种元素中金属性最强的元素,其单质与水反应的化学反应方程式是______;
d的氧化物的水化物溶于氢氧化钠溶液的离子反应方程式是__________。
(3)①a、f、h气态氢化物的化学式相似是因为_____。
②a、f、h三种元素的非金属性有其递变规律。请用原子结构解释其原因:____,得电子能力f大于h。③设计实验通过比较f与h单质的氧化性证明你的结论____。
25.(12分)从能量的变化和反应的快慢和限度等角度研究反应具有重要意义。
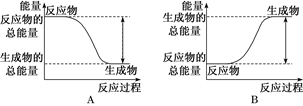
(1)如图能正确表示2H2+O2===2H2O的反应中能量变化的是________。
(2)原电池可将化学能转化为电能。将(1)中反应设计成碱性氢氧燃料电池,其工作原理如图所示,回答下列问题:
①该装置工作过程中,两种主要的能量转化形式为_________、______。
②该电池负极上的电极反应式为________________________。
③当电路中通过0. 2 mol电子时,消耗标准状况下的气体b的体积为 ____L。
(3)2019年3月6日,北京大学张亚文、严纯华课题组在常温常压水相电催化合成氨领域获得突破。该水相电催化合成法原理可表示为2N2(g)+6H2O(l)===4NH3(g)+3O2(g)。(其中g表示气体,l表示液体)
①在恒容密闭容器中进行该反应,能说明反应已经达到平衡状态的是__________
A. 3v正(N2)=2v逆(O2)
B. 各组分物质的量n(N2)∶n(H2O)∶n(NH3)∶n(O2)=2∶6∶4∶3
C. 容器内气体的压强不再改变
D. 混合气体的密度不再改变
②在恒容密闭容器中进行该反应,能加快反应速率的措施是______
A. 通入N2
B. 通入氦气(He)使容器压强增大
C. 加入更多的液态水
D. 添加催化剂
26.(13分)某酸性工业废水中含有K2Cr2O7(重铬酸钾)。光照下草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25 ℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表(表中不要留空格)。
实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
① | 4 | 60 | 10 | 30 |
② | 5 | 60 | 10 | 30 |
③ | 5 | 60 | _______ | _______ |
测得实验①和②溶液中的Cr2O72-浓度随时间变化关系如图所示。
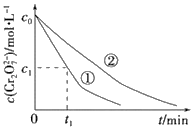
(2)上述反应中酸性K2Cr2O7(重铬酸钾)溶液与草酸(H2C2O4)反应时,草酸被氧化为________(填化学式)。
(3)实验①和②的结果表明________;实验①中0~t1时间段反应速率v(Cr3+)=___________mol·L-1·min-1(用代数式表示)。
(4)该课题组对铁明矾[Al2Fe(SO4)4·24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用:
假设二:________;
假设三:________;
……
(5)请你设计实验验证上述假设一,完成下表中内容。
(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4·Al2(SO4)3·24H2O、Al2(SO4)3等。溶液中Cr2O72-的浓度可用仪器测定)
实验方案(不要求写具体操作过程) ________________ | 预期实验结果和结论 |
参考答案
Ⅰ卷 选择题(共42分)
(共21道小题,每小题只有一个选项符合题意,每小题2分)
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
答案 | D | A | B | C | D | B | B | C | A | B | B |
题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | |
答案 | D | D | A | D | B | C | C | A | C | C |
II卷 非选择题(共58分)
22.(8分)
方案Ⅰ:
(1)2Na+2CH3CH2OH 2CH3CH2ONa+H2↑(2分)
2CH3CH2ONa+H2↑(2分)
(2)点燃放出的气体之前没有检验纯度
(3)乙醇(蒸汽)
方案Ⅱ:
(1)铜丝由红色变黑
(2)铜丝由黑色变成紫红色 CH3CH2OH+CuO CH3CHO+Cu+H2O(2分)
CH3CHO+Cu+H2O(2分)
23.(17分)
Ⅰ.(1)·H 羟基 羧基
(2)加成反应 氧化反应 酯化反应(或取代反应)
(3)nCH2 CH2
CH2
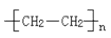 (2分)
(2分)
2CH3CH2OH+O2 
2CH3CHO+2H2O (2分)
CH3COOH+CH3CH2OH 
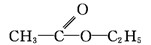 +H2O(2分)
+H2O(2分)
Ⅱ.(1)饱和Na2CO3 防止倒吸
降低乙酸乙酯的溶解量、除去粗产品中的乙酸和乙醇(2分)
(2)分液
24.(11分)
(1)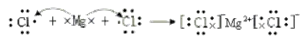
(2)2K+2H2O=2KOH+H2↑ Al(OH)3+OH— = [Al(OH)4] —
(3)①最外层电子数相同(写位于同一主族也算对)
②最外层电子数Cl与Br相同,电子层数Cl小于Br,原子半径Cl小于Br
③向溴化钠溶液中加入氯水(1分)并与氯水颜色进行比较或答出颜色变化(溶液由无色变成棕黄色)(1分)
25.(11分)
(1)A
(2)①化学能→电能
电能→光能
②H2-2e-+2OH-===2H2O(2分)
③2. 24(2分)
(3)①ACD(2分) ②AD(2分)
26.(11分)
(1)20 40(两个体积之和为60,且草酸溶液体积不是10即可)
(2)CO2
(3)其他条件相同时,pH越小,反应速率越快
(4)Al3+起催化作用
SO42-起催化作用
(5)
用等物质的量的K2SO4•Al2(SO4)3•24H2O代替实验①中的铁明矾,控制其他条件与实验①相同,进行对比实验。 | 反应进行相同时间后,若溶液中c(MnO4–)大于实验①中的c(MnO4–)则假设二成立,若两溶液中的c(MnO4–)相同,则假设二不成立。 |