友情提示:
本试卷分为第一部分(选择题)和第二部分(非选择题)两部分,共36个小题,满分100分;答题时间为90分钟。
可能用到的相对原子质量:H1 C 12 N14 O16 S32 Cu64
第一部分
选择题(共40分)
(每小题只有1个选项符合题意。每小题2分,共20小题)
1. 下图为空气成分示意图(按体积计算),其中“a”代表的是
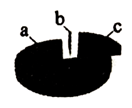
A. 氧气 B. 氮气 C. 二氧化碳 D. 稀有气体
2. 下列物质属于纯净物的是
A. 山泉水 B. 洁净的空气 C. 石油 D. 二氧化锰
3. 硝酸铜[Cu(NO3)2]受热分解会产生一种污染空气的有毒气体,该气体可能是
A. N2 B. NO2 C. O2 D. SO2
4. 马铃薯是非常好的高钾低钠食品,很适合肥胖者食用。这里的“钠、钾“是指
A. 元素 B. 分子 C. 原子 D. 离子
5. 下列物质含有氢分子的是
A. H2CO3 B. H2O2 C. H2 D. H2O
6. 下列物质的用途中,利用其物理性质的是
A. 氧气用于气焊 B. 一氧化碳用于炼铁
C. 天然气用作燃料 D. 铜用于制作导线
7. 我国稀土产量居于世界第一位。元素铕是一种稀土元素,在激光材料及原子能工业中有重要的应用。下列说法中错误的是
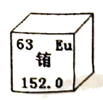
A. 铕属于非金属元素 B. 铕的原子序数是63
C. 铕的元素符号是Eu D. 铕的相对原子质量为152.0
8. 氯气(Cl2)可用于自来水的杀菌消毒,发生反应的化学方程式为
Cl2+H2O=X+HClO,则X的化学式为
A. H2 B. ClO C. HCl D. ClO2
9. 下列操作不正确的是


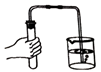
A. 取用固体药品 B. 称量固体质量 C. 滴加液体 D. 检查装置气密性
10. 明代用“烧坊遍地,满城飘香“来形容酿酒业的发达。香飘满城的原因是
A. 分子的质量很小 B. 分子间有间隔
C. 分子在不断运动 D. 分子由原子构成
11. 下列对于灭火原理的分析中,正确的是
A. 砍掉大火蔓延路线前的树木——隔离可燃物
B. 用水扑灭燃着的木材——降低木材的着火点
C. 用锅盖盖灭油锅内的火——降低油温
D. 用扇子扇灭烛火——隔绝空气
12. 某同学制作的试剂标签如下,其中化学式书写不正确的是
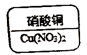
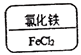

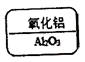
A B C D
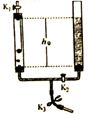
13. 电解水实验装置如下图所示。下列说法不正确的是
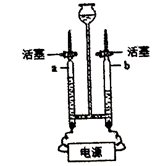
A. a中收集到的气体是氢气
B. b中收集到的气体可以燃烧
C. 水不是由一种元素组成的
D. 水在通电条件下可以分解成氢气和氧气
依据实验和溶解度曲线回答14~17题。
25℃时,向下列4只盛有100g水的烧杯中,分别加入不同质量的KCl固体,充分溶解。
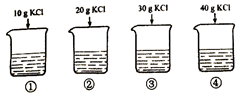
14. ①中溶液的质量为
A. 10g B. 90g C. 100g D. 110g
15. 上述溶液为饱和溶液的是
A. ②③④ B. ②④ C. ③④ D. ④
16. 能将不饱和KCl溶液变为饱和KCl溶液的方法是
A. 升高温度 B. 加水 C. 加KC1固体 D. 倒出部分溶液
17. ④中溶液的溶质质量分数约为
A. 26% B. 29% C. 35% D. 40%
18. 我国科研人员提出了由CO2和CH4转化为CH3COOH的催化反应,该反应的微观示意图如下。下列说法不正确的是
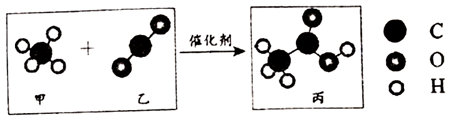
A. 甲中碳、氢元素的质量比为1:4
B. 16g甲完全反应至少需要乙44g
C. 丙含有三种元素
D. 反应中,甲、乙、丙的分子个数比为1:1:1
19. 天然水净化的主要步骤如下图所示。下列说法不正确的是
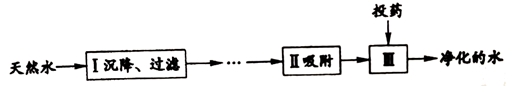
A. 步骤I可除去难溶性固体杂质
B. 步骤Ⅱ中使用的物质可能是活性炭
C. 步骤Ⅲ可杀菌、消毒
D. 净化后的水一定是纯水
20. 下列实验操作能达到实验目的的是
选项 | 实验目的 | 实验操作 |
A | 除去CO2中少量的CO | 点燃 |
B | 除去CuSO4溶液中的少量FeSO4 | 加入足量的锌粉 |
C | 鉴别碳酸钙粉末和氯化钙粉末 | 加入蒸馏水 |
D | 鉴别硬水和软水 | 加入活性炭 |
第二部分
非选择题(共60分)
【生活现象解释】
21.(4分)金属在生产生活中应用广泛。
(1)下列展品所用材料中,属于金属材料的是_______________(填字母序号)。


A. “蛟龙号“钛合金船体 B. “中国天眼“钢铁圈梁 C. “复兴号“铝合金车体
(2)铜是人类认识并应用最早的金属之一。“湿法炼铜“是利用铁与硫酸铜溶液反应制取铜,该反应的化学方程式是__________________________。
(3)工业上用赤铁矿(主要成分为Fe2O3)和一氧化碳炼铁,该反应的化学方程式是___________________________________。
(4)铁锅清洗后如未擦干,容易产生红色铁锈,铁生锈的条件为__________________。
22.(3分)生产、生活中蕴含着丰富的化学知识。
(1)氢氧化钙常用作建筑材料,因为其吸收二氧化碳会转化为坚固的碳酸钙。该反应的化学方程式为_________。
(2)酒店提供的“液氮冰淇淋“,是用液氮使奶油等原料快速冻结而制成的无冰渣感的冰淇淋。利用液氮制作冰淇淋,涉及到氮气的性质有_________。
A. 沸点低,易汽化吸热 B. 无毒,化学性质稳定 C. 密度比空气略小
(3)碳酸饮料需“避免阳光直晒及高温“贮存的原因之一是__________________(用化学方程式解释)。
23.(4分)生活中有众多含有碳元素的物质。
(1)CO2与CO的组成元素相同,但化学性质不同,从微观角度解释其原因_________。
(2)目前,人类以化石燃料为主要能源。常见的化石燃料包括煤、_________和天然气。
(3)鸡蛋皮的主要成分是碳酸钙,能与盐酸反应产生无色无味气体,原因是_________(用化学反应方程式解释)。
(4)“低碳生活“是指生活中耗用少的能量,从而降低碳特别是二氧化碳的排放。下列生活方式符合“低碳生活“并可行的是_________(填字母序号)
A. 将呼吸产生的二氧化碳用石灰水吸收
B. 广泛使用一次性筷子、一次性塑料袋
C. 少开私家车,多乘坐公共交通工具出行
D. 用电子邮件、QQ等即时通讯工具,少用传真打印机
24.(2分)氧气在生产、生活中有重要的用途。
(1)氧气常用于医疗急救,这利用的氧气的性质是_________。
(2)氧气是良好的助燃剂,通过支持燃烧为化工生产和生活提供热量。
木炭在氧气中燃烧的现象是:剧烈燃烧,___________________________。
【科普阅读理解】
25.(5分)阅读下面科普文,回答问题:
谈到氨气(NH3),首先让我们想到的是它的刺激性气味,其实NH3在生活生产中的应用十分广泛。
NH3与食品工业
黄曲霉毒素具有很强的致癌性,广泛存在于霉变的花生、玉米等粮油及其制品中。在食品工业生产中,常利用氨气熏蒸法降低食物中滋生的黄曲霉毒素。该方法是利用NH3与食物中的水反应生成一水合氨,一水合氨再与黄曲霉毒素反应,从而有效的降低黄曲霉的毒性。
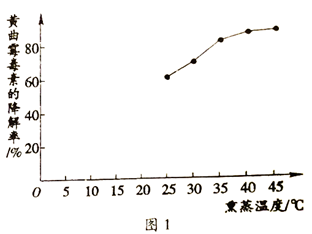
实验人员通过实验寻找氨气熏蒸法的最佳条件。将50g花生破碎成粉末,包裹密封并注入NH3,置于恒温箱进行熏蒸。图1是在相同熏蒸时间、NH3浓度和花生含水量的条件下,熏蒸温度对降解某种黄曲霉毒素的影响。
NH3与无机化工
近年来,CO2捕集与封存被认为是减少CO2排放的有效途径。NH3溶于水后形成的氨水可作为吸收CO2的新型吸收剂。
图2为工业吸收CO2的装置示意图。实验研究表明,CO2的脱除率受到反应温度、氨水流量、氨水浓度等多种因素影响。当喷雾塔内的反应温度低于40℃时,CO2的脱除率随着氨水流量和氨水浓度的增加而明显升高,最高可达到85%,大大减少了CO2的排放,降低其对环境的影响。
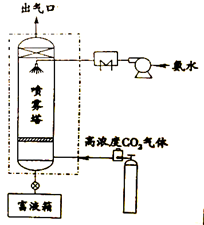
图2
至此,你对NH3是不是又有了新的认识呢?希望在今后的化学学习中你还会对NH3有更全面的认识!
依据文章内容回答下列问题。
(1)请列举出NH3的物理性质_______(答1条即可)。
(2)依据图1回答:
①当温度为40℃和45℃时,降解率分别为84.34%和84.35%,考虑到经济性原则,应选取的最佳熏蒸温度为________。
②在25℃~45℃的范围内,随着熏蒸温度的升高,黄曲霉毒素的降解率逐渐_______(填”增大“或“减小“)。
(3)喷雾塔中利用氨水吸收CO2。氨水以雾状喷洒的目的是________。
(4)下列关于氨水吸收CO2的说法中,正确的是________(填序号)。
A. 从喷雾塔出气口排放出的气体中不含CO2
B. 吸收过程中,喷雾塔内的反应温度对CO2脱除率没有影响
C. 反应温度低于40℃时,喷洒浓度较高的氨水,有助于提升CO2的脱除率
【生产实际分析】
26.(2分)氢能源是最具应用前景的能源之一。甲烷水蒸气催化重整是制高纯氢的方法之一,主要流程如下:
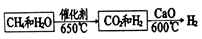
(1)甲烷和水蒸气反应的化学方程式是__________。
(2)用CaO可以将CO2转化为一种产物CaCO3,该反应属于基本反应类型中的__________。
27.(6分)二氧化碳不仅能产生温室效应,还能作化工原料。
(1)化石燃料燃烧会产生大量的CO2。天然气充分燃烧的化学方程式为__________。
(2)膜分离是一种常用的分离技术。二氧化硅(SiO2)能用于制造CO2分离膜。CO2通过此膜后被氨水吸收(如下图所示),转化为可作氮肥的NH4HCO3。
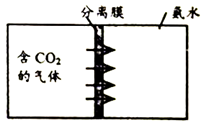
①SiO2中硅元素的化合价为________。
②NH4HCO3固体中氮元素的质量分数为________%(计算结果精确到0.1%)。
(3)CO2形成的超临界CO2流体可用于从香兰草豆荚粉中提取香兰素(C8H8O3)。
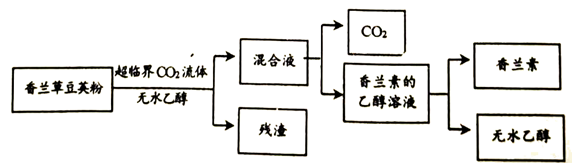
①香兰素由_______(填元素名称)3种元素组成。
②由香兰素的乙醇溶液得到香兰素的过程中,发生的变化是_______(填“化学变化“或“物理变化“)。
③以上提取香兰素的过程中,可循环使用的物质有_______。
【基本实验及其原理分析】
28.(5分)根据下图回答问题。
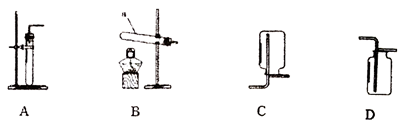
(1)仪器a的名称是________。
(2)实验室用高锰酸钾制取氧气的化学方程式是_______,选用的发生装置是_______(填序号)。
(3)实验室制取二氧化碳,选用的收集装置是_______(填序号),选用该装置收集二氧化碳,验满的方法为____________________________。
29.(3分)根据如下图所示的实验回答问题。
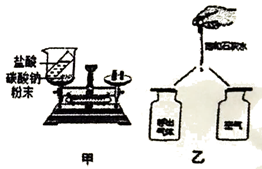
(1)甲实验中,反应后天平的指针_______偏转(填“向左“或“向右“或“不“),请解释原因_______。
(2)乙实验验证人体呼出气体中二氧化碳含量比空气中多时,除了要检验两种气体样品的体积相同外,还要控制______________相同,实验现象是______________。
30. (2分)实验室配制50g 10%的氯化钠溶液,其操作如下图所示。(水的密度约为1g/cm3)选择A或B作答。若两题均作答,按照选A的答题情况计分。
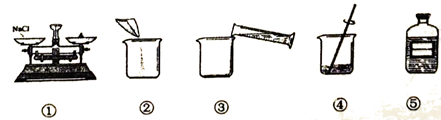
A | B |
(1)①中称量氯化钠的质量为_______g。 (2)④中玻璃棒的作用是________。 | (1)③中量取水的体积是_______mL。 (2)填写⑤中标签 |
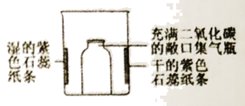
31.(3分)用如图装置进行实验,实验现象为______,产生该现象的原因为_____________。
32.(3分)小组同学用下图所示实验探究铁、铜、银的金属活动性顺序。
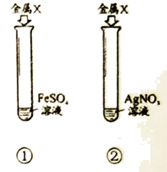
(1)由试管①的现象能得出的金属活动性顺序是________。
A. Fe>Cu>Ag B. Fe>Cu C. Cu>Ag
(2)试管②中反应的化学方程式是_____________,反应的现象是___________________。
33.(3分)用下图装置进行实验。升温至60℃的过程中,仅①燃烧;继续升温至260℃的过程中,仅③燃烧。
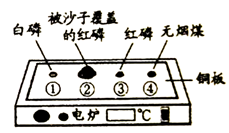
(1)红磷燃烧的化学方程式为_____________。
(2)实验过程中,能说明可燃物燃烧需要温度达到着火点的现象是_____________。
(3)升温至260℃,对比_______(填实验序号)的实验现象,能证明可燃物燃烧的另一个条件。
34.(4分)利用下图装置进行实验(两支玻璃管内径相同)。实验前K1、K2、K3均已关闭。
实验装置 | 【实验1】制备气体 | 【实验2】测定空气中氧气含量 |
| 左管中带孔的燃烧匙盛有足量锌粒,右管盛有稀硫酸 I. 打开K1和K2,使反应发生 Ⅱ. 在K1的导管口处收集气体 Ⅲ. …… | 左管中燃烧匙盛有足量白磷,右管盛有水 I. 凸透镜聚光引燃白磷 II. 待白磷熄灭,冷却,打开K2,至液面不再变化,右管中液体的高度为h1 |
(1)实验1:锌与稀硫酸反应的化学方程式为________;为使反应停止,Ⅲ中的操作是________。
(2)实验2:打开K2,右管中液面下降,原因是________;计算空气中氧气体积分数的表达式为________(用h0、h1表示)。
【科学探究】
35. (6分)柠檬烯是橙皮、橘子皮和许多柑橘类水果皮里含有的一种物质,可溶解许多不易溶于水的物质如橡胶和塑料。将橙皮汁液涂在泡沫饭盒上,泡沫饭盒会溶解破损。
【提出问题】橙皮的形状、温度以及酸碱性是否影响橙皮汁溶解泡沫饭盒的速率?
【查阅资料】碳酸钠溶液呈碱性,稀醋酸溶液呈酸性。
【进行实验】
每次取1/4块橙皮,1/4个泡沫饭盒进行实验,所用溶液浓度均为5%,记录10分钟时的泡沫饭盒现象如下表所示。
实验1
序号 | 实验操作 | 饭盒表面的实验现象 |
1-1 | 将一块表面挤出汁的橙皮放在泡沫饭盒上 | 明显凹凸不平以及很多小洞 |
1-2 | 将一块橙皮切成丝,均匀地放在泡沫饭盒上 | 一点凹凸不平 |
1-3 | 将一块橙皮切成粒,均匀地放在泡沫饭盒上 | 一点凹凸不平 |
1-4 | 将一块橙皮研磨成酱,均匀放在泡沫饭盒上 | 较多凹凸不平 |
1-5 | 将一块橙皮研磨成酱,加热后均匀放在泡沫饭盒上 | 仍然光滑 |
实验2
序号 | 实验操作 | 饭盒表面的实验现象 |
2-1 | 将一块橙皮研磨成酱再滴入10mL醋后均匀放在泡沫饭盒上 | 较多凹凸不平 |
2-2 | 将一块橙皮研磨成酱再滴入10mL碳酸钠溶液后均匀放在泡沫饭盒上 | 较多凹凸不平 |
2-3 | 将amL醋均匀滴在泡沫饭盒上 | 仍然光滑 |
2-4 | 将bmL碳酸钠溶液均匀滴在泡沫饭盒上 | 仍然光滑 |
【解释与结论】
(1)由实验1-2~1-4可以得出的实验结论是________。
(2)实验1-5的目的是________。
(3)实验2-3、2-4中a和b的值分别为________。
(4)证明碱性环境对橙子汁溶解泡沫饭盒速率无影响,依据的实验是________。
【反思与评价】
(5)实验1-1的效果最明显的原因是________。
(6)根据实验1-5,可以猜测柠檬烯具有的性质是________。
【实际应用定量分析】
36.(4分)硫酸铜是制备其他含铜化合物的重要原料。工业上用废铜屑、氧气和稀硫酸反应制取硫酸铜。
(1)请将工业制取硫酸铜的化学方程式补充完整:
2Cu+O2+2H2SO4=2CuSO4+__________。
(2)某化工厂现有含铜量80%的废铜屑(假设废铜屑中杂质不参加反应)和稀硫酸。试计算制取160kg硫酸铜需要废铜屑的质量(写出计算过程及结果)。
参考答案
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
B | D | B | A | C | D | A | C | C | C |
11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
A | B | A | D | D | C | A | A | D | C |
21.(4分)
(1)ABC (2)Fe+CuSO4=FeSO4+Cu
(3)3CO+Fe2O3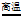 3CO2+2Fe
3CO2+2Fe
(4)与氧气、水同时接触
22.(3分)
(1)CO2+Ca(OH)2=CaCO3↓+H2O
(2)AB
(3)H2CO3=H2O+CO2↑(反应条件写“加热“,得分)
23.(4分)
(1)分子种类不同
(2)石油
(3)CaCO3+2HCl=CaCl2+H2O+CO2↑
(4)CD
24.(2分)
(1)氧气可以供给呼吸
(2)发出白光,放出热量
25.(5分)
(1)有刺激性气味
(2)①40℃ ②增大
(3)增大氨水与CO2的接触面积,使CO2被充分吸收
(4)C
26.(2分)
(1)CH4+2H2O CO2+4H2
CO2+4H2
(2)化合反应
27.(6分)
(1)CH4+2O2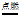 CO2+2H2O (2)①+4 ②17.7
CO2+2H2O (2)①+4 ②17.7
(3)①碳、氢、氧(或C、H、O)
②物理变化
③二氧化碳和无水乙醇
28.(5分)
(1)试管
(2)2KMnO4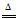 K2MnO4+MnO2+O2↑ B
K2MnO4+MnO2+O2↑ B
(3)D 将燃着的木条放在瓶口,若观察到木条熄灭,说明瓶中已充满二氧化碳。
29.(4分)
(1)向右
装置不密闭,碳酸钠与盐酸反应生成的二氧化碳气体的质量无法称量
(2)滴加石灰水的滴数
呼出气体中石灰水变浑浊,空气中不变浑浊
30.(2分)
A:(1)5 (2)搅拌,加速溶解
B:(1)45 (2)10% NaCl溶液
31.(3分)
湿的紫色石蕊纸条变红,干的紫色石蕊纸条无明显变化(1分)
CO2运动到烧杯中,CO2与H2O反应生成碳酸(H2CO3),碳酸使紫色石蕊变红(2分)
32.(3分)
(1)B
(2)Cu+2AgNO3=2Ag+Cu(NO3)2
铜表面有银白色(或黑色)固体析出,溶液由无色变成蓝色
33.(3分)
(1)4P+5O2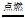 2P2O5
2P2O5
(2)升温至60℃,①燃烧,③不燃烧(合理给分)
(3)②③
34.(4分)
(1)Zn+H2SO4=ZnSO4+H2↑ 关闭K1(或关闭K2,打开K3)
(2)白磷燃烧消耗氧气,使管1中压强变小,小于外界大气压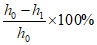
35.(6分)
(1)其他条件不变时,橙皮的形状会影响泡沫饭盒的溶解速率
(2)与实验1-4对比,探究温度是否影响泡沫饭盒的溶解速率
(3)10、10
(4)实验1-4和2-2或1-4,2-2,2-4
(5)因为实验1-1中柠檬烯浓度最高
(6)具有挥发性或受热易分解等(合理给分)
36.(4分)(1)2H2O
(2)解:设需要的Cu质量为x。
2Cu+O2+2H2SO4=2CuSO4+2H2O
2×64 2×160
x 160kg
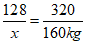 1分
1分
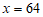 kg 1分
kg 1分
废铜屑的质量=64kg÷80%=80kg 1分
答:需要废铜屑的质量为80kg。

 上的内容。
上的内容。