本试卷分为I卷、Ⅱ卷,共26个小题,满分100分;答题时间为90分钟。
可能用到的相对原子质量:H 1 C 12 N 14 Cl 35. 5
I卷
选择题(共42分)
(共21道小题,每小题只有一个选项符合题意,每小题2分。)
1. 著名化学家、诺贝尔奖获得者西博格博士1979年在美国化学会成立100周年大会上的讲话中指出“化学是人类进步的关键“。下列对化学的认识不正确的是
A. 英国科学家道尔顿在1869年发现元素周期律
B. 化学家可以制造出自然界不存在的物质
C. 化学既是一门具有创造性的科学,也是一门具有实用性的科学
D. 现代化学将在能源与资源、材料科学、环境科学、医药与健康等领域产生广泛影响
2. 下列技术应用中,其工作原理不涉及化学反应的是
A. 火炬燃烧 | B. 风力发电 | C. 粮食酿醋 | D. 高炉炼铁 |
|
|
|
|
3. 下列反应中,属于氧化还原反应的是
A. 2CuO+C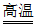 2Cu+CO2↑
2Cu+CO2↑
B. Fe(OH)2+2HCl=FeCl2+2H2O
C. SO2+2NaOH=Na2SO3+H2O
D. NH4Cl+NaOH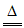 NaCl+NH3↑+H2O
NaCl+NH3↑+H2O
4. 水与下列物质反应时,水表现出氧化性的是
A. Na B. Cl2 C. NO2 D. Na2O
5. 下列物质分类的正确组合是
酸 | 碱 | 碱性氧化物 | 盐 | |
A | H2CO3 | 纯碱 | CaO | 亚硫酸钠 |
B | H2SO4 | 烧碱 | Na2O | 氯化钠 |
C | HNO3 | 氨水 | Na2O2 | 碳酸钙 |
D | NaHSO4 | 熟石灰 | N2O5 | 硝酸铵 |
6.
下列说法正确的是
A. 一种分散系里只能有一种分散质
B. 分散系中分散质粒子直径由大到小的顺序是:浊液、溶液、胶体
C. 可以用丁达尔效应来区分溶液和胶体
D. 氯化钠溶于水得到胶体
7. 下列有关物质保存的说法不正确的是
A. 少量钠保存在煤油中
B. 氯水可长期保存在无色瓶中
C. 过氧化钠应密封保存
D. 漂白粉不应露置在空气中
8. 将金属钠分别投入下列物质的溶液中,有气体放出,且有红褐色沉淀生成的是
A. MgCl2 B. K2SO4 C. CuCl2 D. FeCl3
9. 对于Na2CO3和NaHCO3这两种化合物,下列叙述错误的是
A. 可采用加热的方法除去Na2CO3固体中混有的NaHCO3
B. 可向NaHCO3溶液中通入足量CO2气体除去其中混有的Na2CO3
C. 可用澄清的石灰水鉴别Na2CO3和NaHCO3两种溶液
D. 物质的量相同的Na2CO3和NaHCO3分别与足量盐酸反应,二者产生的CO2一样多
10. NA代表阿伏伽德罗常数的值,下列叙述中正确的是
A. 标准状况下,22. 4L水所含的水分子数目为NA
B. 常温常压下,16gCH4所占体积约为22. 4L
C. 0. 5mol/L的NaCl溶液中含有Na+数目为0. 5NA
D. 常温常压下,17g氨气中含有H数目为3NA
11. 下列各项的两组物质在溶液中的反应,可用同一离子方程式表示的是
A. 氢氧化钠与盐酸;氢氧化钠与碳酸
B. BaCl2溶液与Na2SO4溶液;Ba(OH)2溶液与稀H2SO4
C. Na2CO3溶液与硝酸;CaCO3与硝酸
D. 石灰石与硝酸;石灰石与盐酸
12. 在无色透明的强酸性溶液中,能大量共存的离子组是
A. K+、Ba2+、NO3–、SO42- B. K+、Na+、SO32-、ClO–
C. Ca2+、NH4+、NO3–、Cl– D. K+、Na+、MnO4–、SO42-
13. 下列反应的离子方程式书写正确的是
A. 稀硫酸滴在铁片上:2Fe+6H+=2Fe3++3H2↑
B. FeCl3溶液腐蚀铜板:2Fe3++3Cu=3Cu2++2Fe
C. 盐酸除水垢(主要成分为CaCO3):CO32-+2H+=H2O+CO2↑
D. 小苏打治疗胃酸(主要成分为盐酸)过多:HCO3–+H+=CO2↑+H2O
14. 有NaNO3、Na2SO4、NH4Cl、(NH4)2SO4四种无色溶液,请选择一种能鉴别它们的试剂是(必要时可加热)
A. 稀硝酸 B. 稀硫酸 C. NaOH溶液 D. Ba(OH)2溶液
15. 将铜粉放入稀硫酸中,加热后无明显变化,但加入某盐一段时间后,发现铜粉质量减小,则该盐不可能是
A. FeCl3 B. NaCl C. KNO3 D. Cu(NO3)2
16. 下列溶液能够区别SO2和CO2气体的是
①澄清的石灰水
②H2S溶液
③酸性KMnO4溶液
④氯水
⑤品红溶液
⑥BaCl2溶液
A. ①②③ B. ②③④ C. 除①⑥以外 D. 全部
17. 检验铵根离子的一般方法是取少许待测物置于试管中,然后
A. 直接加热,用湿润的红色石蕊试纸在试管口检验
B. 向溶液中滴加紫色石蕊试液
C. 加入强酸溶液加热后,再滴入酚酞试液
D. 加入强碱溶液加热后,再用湿润的红色石蕊试纸靠近试管口检验
18. 下列关于离子检验的说法中,正确的是
A. 向某溶液中加入澄清石灰水,溶液变浑浊,则该溶液中一定含有CO32-
B. 向某溶液中加入AgNO3溶液,生成白色沉淀,该溶液中一定含有Cl–
C. 向某溶液中加入盐酸酸化的BaCl2溶液,有白色沉淀生成,该溶液中一定含有SO42-
D. 向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中加入几滴新制的氯水,溶液变为红色,则原溶液中一定含有Fe2+
19. ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4===2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法正确的是
A. H2C2O4在反应中被还原
B. ClO2是氧化产物
C. H2SO4是氧化剂
D. 由该反应可得还原性:H2C2O4>ClO2
20. 下列有关离子组的评价及相关离子方程式不正确的是
选项 | 离子组 | 评价及相关离子方程式 |
A | H+、Fe2+、NO3–、Cl– | 不能大量共存于同一溶液中,因为发生反应: 3Fe2++NO3–+4H+===3Fe3++NO↑+2H2O |
B | Na+、OH–、Cl–、NH4+ | 能大量共存于同一溶液中 |
C | Ca2+、NH4+、CO32-、Cl– | 不能大量共存于同一溶液中,因为发生反应: Ca2++CO32-=CaCO3↓ |
D | Na+、NH4+、SO42-、Cl– | 能大量共存于同一溶液中 |
21. 今有三个氧化还原反应:①2FeCl3+2KI=2FeCl2+2KCl+I2,②2FeCl2+Cl2=2FeCl3,③K2Cr2O7+14HCl(浓)=2KCl+2CrCl3+3Cl2↑+7H2O。若某溶液中有Fe2+、I–、Cl–共存,要除去I–而不影响Fe2+和Cl–,则可加入的试剂是
A. Cl2 B. K2Cr2O7 C. FeCl3 D. HCl
Ⅱ卷
非选择题(共58分)
22. (10分)化学不仅能创造新物质,还能分离提纯物质。
I. 用一种试剂除去下列各物质中的杂质(括号内为杂质),并写出离子方程式。
(1)Na2CO3溶液(NaHCO3),试剂_______:离子方程式:______________。
(2)FeSO4溶液(Fe2(SO4)3),试剂_______:离子方程式:______________。
II. 现有含有少量NaCl、Na2SO4、Na2CO3等杂质的NaNO3溶液,选择适当的试剂除去杂质,得到纯净的NaNO3固体,实验流程如图所示。
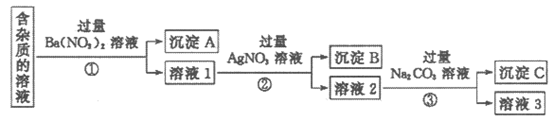
(3)沉淀A的主要成分是_______、_______(填化学式)。
(4)③中反应的离子方程式是______________。
(5)溶液3经过处理可以得到NaNO3固体,溶液3中肯定含有的杂质是_______,为了除去杂质,可向溶液3中加入适量的______________。
23. (13分)Cl2是一种强氧化性的非金属单质,能和很多还原剂发生反应。
(1)Fe能在Cl2中燃烧,化学方程式为______________;将Cl2通入淀粉KI溶液中,溶液由无色变为蓝色,写出离子方程式______________。
(2)下表是甲同学研究氯水性质实验片断的活动记录。
实验内容 | 实验现象 | 解释及结论 |
观察氯水的颜色、状态 | 呈黄绿色 | ①_________ |
向氯水中滴入NaHCO3溶液 | 有无色气体生成 | ②_________ |
用玻璃棒蘸取氯水,点在品红试纸上 | 红色褪去 | ③_________ |
根据上述实验内容和现象,选择合理解释填到上表中(填序号)。
A. 氯水中存在酸性物质
B. 氯水中有漂白性物质
C. 氯水中存在氯气分子
(3)乙同学在甲同学的实验基础上设计了下图实验装置进一步研究氯气的性质。
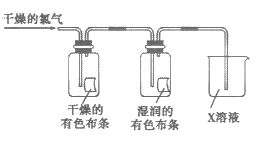
回答下列问题:
①实验中,乙同学观察到干燥的有色布条不褪色,湿润的有色布条褪色,得出的实验结论是____________________________。
②为了防止多余的氯气污染空气,实验室常用NaOH溶液来吸收尾气,写出离子方程式____________________________。
(4)甲同学在(2)、(3)实验活动中运用了______________进行探究(填序号)。
A. 观察法 B. 比较法 C. 分类法 D. 实验法
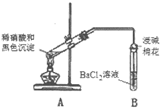
24. (14分)某实验小组欲探究SO2和Cl2能否发生反应,设计如下图所示的实验装置进行实验。注:已检验装置气密性,且实验前已经用氮气排净装置内的空气。
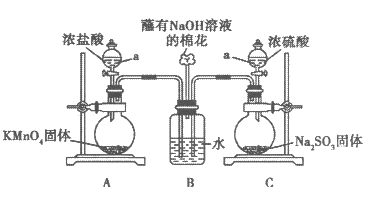
(1)图中仪器a的名称:____________。
(2)装置A中的反应为__KMnO4+__HCl(浓)===__KCl+__MnCl2+__Cl2↑+__H2O,
①配平该反应并用单线桥或双线桥表示电子转移。
②反应中的氧化剂和还原剂的物质的量之比是__________,生成71gCl2转移的电子是________mol。
(3)装置C中反应的化学方程式是________________________。
(4)打开装置A、C中仪器a的活塞,一段时间后关闭活塞。待反应完全后,又继续如下实验。①甲同学取适量B中溶液于试管中,向其中滴加一滴AgNO3稀溶液,即有白色沉淀生成。甲同学由此认为SO2和Cl2发生了反应,理由是该反应中生成了_________离子(写离子符号)。
②乙同学认为甲同学的结论不合理,认为A中生成的Cl2中混有杂质,应该在装置A、B间增加一个洗气瓶,然后再按甲同学的方法即可得到正确结论。
乙同学认为Cl2中混有的杂质是____________。
③丙同学则认为,该白色沉淀不能证明SO2和Cl2发生反应,结合离子方程式解释原因________________________;丙同学取适量B中溶液于试管中,向其中滴加少量溶液X,有白色沉淀生成,则可得出结论,即SO2与Cl2同时通入水中,可以发生反应。溶液X是____________(填选项序号)。
a. BaCl2溶液 b. Ba(OH)2溶液 c. Ba(NO3)2溶液 d. 品红溶液
(5)SO2与Cl2同时通入水中反应的化学方程式________________________。
25. (12分)SO2和NOx都是大气污染物。
(1)空气中的NO2可形成硝酸型酸雨,该反应的化学方程式是____________。
(2)汽车发动机工作时产生的NO和CO可通过催化转化器转化为两种无污染的气体,该反应的化学方程式是____________。
(3)利用氨水可以将SO2和NO2吸收,原理如下图所示:
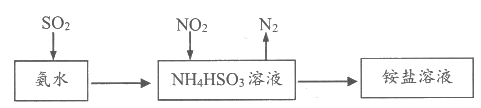
SO2和NO2被吸收的离子方程式分别是________、________。
工、农业废水以及生活污水中浓度较高的NO3–会造成氮污染。工业上处理水体中NO3–的一种方法是零价铁化学还原法。某小组用废铁屑和硝酸盐溶液模拟此过程,实验如下。
(4)先用稀硫酸洗去废铁屑表面的铁锈,然后用蒸馏水将铁屑洗净。
除锈反应的离子方程式是________________________________________。
(5)将KNO3溶液的pH调至2.5。从氧化还原的角度分析调低溶液pH的原因是
已知:pH越小表示溶液中c(H+)越大。
________________________________________________________________________。
(6)将上述处理过的足量铁屑投入(5)的溶液中。下图表示该反应过程中,体系内相关离子浓度、pH随时间变化的关系。
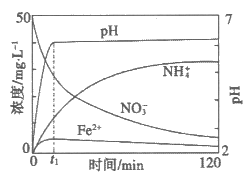
请根据图中信息回答:
t1时刻前该反应的离子方程式是__________________。
26. (9分)某小组在做铜与浓硫酸反应时发现产生黑色固体。于是他们对黑色固体进行探究,实验步骤如下:
I. 将光亮铜丝插入浓硫酸,加热;
Ⅱ. 待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ. 冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用。
(1)步骤Ⅱ产生的气体是_________。
(2)该同学假设黑色沉淀是CuO。检验过程如下:
查阅文献:检验微量Cu2+的方法是:向试液中滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+。
①将CuO放入稀硫酸中,一段时间后,未见明显现象,再滴加K4[Fe(CN)6]溶液,产生红褐色沉淀。
②将黑色沉淀放入稀硫酸中,一段时间后,滴加K4[Fe(CN)6]溶液,未见红褐色沉淀。由该检验过程所得结论是________。
(3)再次假设,黑色沉淀是铜的硫化物。实验如下:
实验装置 | 现象 |
| 1. A试管中黑色沉淀逐渐溶解 2. A试管内上方出现红棕色气体 3. B试管中出现白色沉淀 |
①现象2说明黑色沉淀具有________性。
②产生红棕色气体的化学方程式是________________。
③能确认黑色沉淀中含有S元素的现象是________________。
④为确认黑色沉淀是“铜的硫化物“,还需进行的实验是________________________。
(4)以上实验说明,黑色沉淀中存在铜的硫化物。进一步实验后证明黑色沉淀是CuS与Cu2S的混合物。将黑色沉淀放入足量浓硫酸中加热一段时间后,黑色沉淀完全溶解,得到澄清溶液,其中CuS溶解的化学方程式是________。
参考答案
选择:ABAAB CBDCD DCDDB CDDDB C
22. (10分)
(1)NaOH溶液;HCO3–+OH–=H2O+CO32-
(2)铁粉;Fe+2Fe3+=3Fe2+
(3)BaSO4、BaCO3
(4)Ba2++CO32-=BaCO3↓ 2Ag++CO32-=Ag2CO3↓(此空2分)
(5)Na2CO3,HNO3
23.(13分)
(1)2Fe+3Cl2 2FeCl3(2分) Cl2+2I–=I2+2Cl–(2分)
2FeCl3(2分) Cl2+2I–=I2+2Cl–(2分)
(2)①C ②A ③B
(3)①Cl2无漂白性,Cl2与水反应的产物(或HClO)有漂白性(2分)
②2OH–+Cl2=ClO–+Cl–+H2O (2分)
(4)ABD(2分)
24. (14分)
(1)分液漏斗
(2)①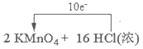 =2KCl+2MnCl2+5Cl2↑+8H2O(2分)
=2KCl+2MnCl2+5Cl2↑+8H2O(2分)
②1:5 2
(3)H2SO4(浓)+Na2SO3=Na2SO4+H2O+SO2↑
(4)①Cl– ②HCl
③Cl2+H2O=H++Cl–+HClO,Ag++Cl–=AgCl↓也有白色沉淀生成。(2分)a(2分)
(5)SO2+Cl2+2H2O=H2SO4+2HCl(2分)
25. (共12分)
(1)3NO2+H2O=2HNO3+NO(1分)
(2)2CO+2NO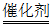 2CO2+N2(2分)
2CO2+N2(2分)
(3)SO2+NH3 H2O=NH4++HSO3–(2分)
H2O=NH4++HSO3–(2分)
2NO2+4HSO3–=N2+4SO42-+4H+(2分)
(4)Fe2O3+6H+=2Fe3++3H2O(2分)
(5)NO3–在酸性条件下的氧化性强,易被铁屑还原(1分)
(6)4Fe+NO3–+10H+=4Fe2++NH4++3H2O(2分)
26. (9分)
(1)SO2(1分)
(2)黑色沉淀中不含有CuO(1分)
(3)①还原性(1分)
②2NO+O2=2NO2(1分)
③B试管中出现白色沉淀(1分)
④取冷却后A装置试管中的溶液,滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+,说明黑色沉淀是铜的硫化物(2分)
(4)CuS+4H2SO4(浓)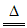 CuSO4+4SO2↑+4H2O(2分)
CuSO4+4SO2↑+4H2O(2分)