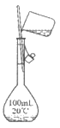本试卷满分共100分,作答时长90分钟。
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 Mg 24 S 32 Cl 35.5 Mn 55 Fe 56
第一部分
本部分共14题,每题3分,共42分。在每题列出的四个选项中,选出最符合题目要求的一项。
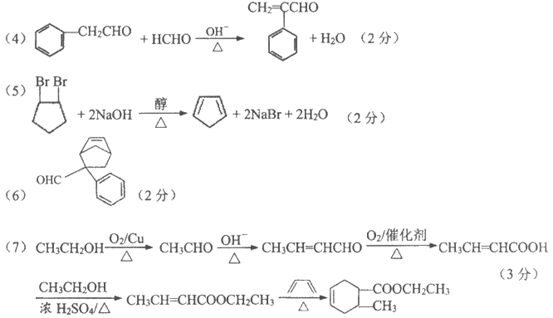
1. 中华民族有着光辉灿烂的历史和文化。下列说法不正确的是
A. 战国·曾侯乙编钟属于青铜制品,青铜是一种合金
B. 秦朝·兵马俑用陶土烧制而成,属于合成高分子材料
C. 宋·王希孟《千里江山图》所用纸张为宣纸,其主要成分是纤维素
D. 宋·沈子藩《梅鹊图》所用缂丝中含有的桑蚕丝,其主要成分为蛋白质
2. 下列化工生产过程中,未涉及氧化还原反应的是
A. 海带提碘 B. 氯碱工业 C. 海水提溴 D. 候氏制碱
3. 下列方程式与所给事实不相符的是
A. 用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O
B. 用FeCl3溶液腐蚀印刷电路板:2Fe3++Cu=2Fe2++Cu2+
C. 铝粉和氧化铁组成的铝热剂用于焊接钢轨:2Al+Fe2O3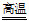 Al2O3+2Fe
Al2O3+2Fe
D. 向沸水中滴加FeCl3溶液制Fe(OH)3胶体:Fe3++3H2O=Fe(OH)3↓+3H+
4. 下列说法不正确的是
A. 淀粉和纤维素水解的最终产物均为葡萄糖
B. 植物油中含不饱和脂肪酸酯,能使Br2的CCl4溶液褪色
C. α-氨基丙酸与α-氨基苯丙酸混合物脱水可生成2种二肽
D. 在鸡蛋清溶液中加入饱和Na2SO4溶液时,会使蛋白质析出
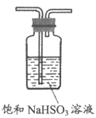
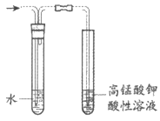
5. 用下列仪器或装置进行相应实验,不能达到实验目的的是
|
|
|
|
A. 除去SO2中的少量HCl | B. 配制一定物质的量浓度的氯化钠溶液 | C. 检验溴乙烷消去产物中的乙烯 | D. 制取氨气 |
6. 短周期元素W、X、Y和Z在元素周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。下列关系正确的是
W | X | |||
Y | Z |
A.
氢化物沸点:W>X B. 简单离子的半径:Y<X
C. 化合物熔点:Y2X3<YZ3 D. 氧化物对应水化物的酸性:Y>W
7. 能证明乙酸是弱酸的实验事实是
A. CH3COOH溶液与Zn反应放出H2
B. CH3COOH溶液与Na2CO3溶液反应生成CO2
C. 0.1mol/L CH3COONa溶液的pH大于7
D. 0.1mol/L CH3COOH溶液可使紫色石蕊试液变红
8. 下列有关物质的性质与用途具有对应关系的是
A. SO2具有氧化性,可用于漂白纸浆
B. 碱金属元素发生焰色反应,可用于制造烟花
C. NH4HCO3受热易分解,可用作氮肥
D. Fe2(SO4)3易溶于水,可用作净水剂
9. 设NA为阿伏加德罗常数。下列有关叙述正确的是
A. 14 g乙烯和丙烯混合气体中的氢原子数为2 NA
B. 2.4 g镁在足量的氧气中燃烧,转移电子数为0.1 NA
C. 1molN2与4 mol H2反应生成的NH3分子数为2NA
D. 0.1L 0.5mol/L CH3COOH溶液中含有的H+个数为0.05NA
10. 用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是
①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag++e-=Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A. ①② B. ②④ C. ③④ D. ②③
11. A、B、C、D、E是中学化学中的常见物质,A、B是短周期元素组成的单质。其转化关系如下:
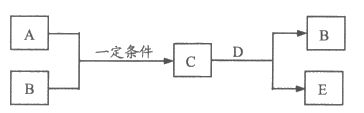
若C是能使湿润的红色石蕊试纸变蓝的气体,D是黄绿色气体。下列说法正确的是
A. E物质可能是氯化铵
B. C、D均极易溶于水
C. 组成A的元素在周期表中位于第2周期第VA族
D. 反应中D得到1.2mol电子时,在标准状况下生成B气体2.24 L
12. 甲醇可用于合成重要的有机合成中间体3,5-二甲氧基苯酚。

反应结束后,先分离出甲醇,再加入乙醚,将获得的有机层(含少量氯化氢)进行洗涤,然后分离提纯得到产物。有关物质的部分物理性质如下:
物质 | 沸点/℃ | 熔点/℃ | 溶解性 |
甲醇 | 64.7 | -97.8 | 易溶于水 |
3,5-二甲氧基苯酚 | 172~175 | 33~36 | 易溶于甲醇、乙醚,微溶于水 |
下列说法不正确的是
A. 该反应属于取代反应
B. 分离出甲醇的操作是蒸馏
C. 间苯三酚与3,5-二甲氧基苯酚互为同系物
D. 洗涤时,可用NaHCO3溶液除去有机层中的氯化氢
13. 在一固定容积的密闭容器中,充入2mol CO2和1mol H2发生如下化学反应:
CO2(g)+H2(g)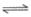 CO(g)+H2O(g),其化学平衡常数(K)与温度(T)的关系如下表:
CO(g)+H2O(g),其化学平衡常数(K)与温度(T)的关系如下表:
T/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
关于该反应的说法不正确的是
A.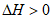
B. 830℃时反应达到平衡,CO2气体的转化率为33.3%
C. 1000℃,当c(CO2)·c(H2)=c(CO)·c(H2O)时,该反应向正反应方向进行
D. 其他条件不变,降低温度,反应达到新平衡前: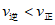
14. 某小组在验证反应”Fe+2Ag+=Fe2++2Ag“的实验中检测到Fe3+,实验过程如下:
向硝酸酸化的0.05mol/L硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。取上层清液,滴加KSCN溶液,溶液变红,同时发现有白色沉淀产生,且溶液颜色深浅、沉淀量多少与取样时间有关,对比实验记录如下:
序号 | 取样时间/min | 现象 |
i | 3 | 产生大量白色沉淀;溶液呈红色 |
ii | 30 | 产生白色沉淀;较3min时量少;溶液红色较3min时加深 |
iii | 120 | 产生白色沉淀;较30min时量少;溶液红色较30min时变浅 |
(资料:Ag+与SCN-生成白色沉淀AgSCN)
依据上述实验现象,不能得出的结论是
A. 上层清液中滴加KSCN溶液,溶液变红,说明溶液中含有Fe3+
B. 上层清液中滴加KSCN溶液,产生白色沉淀,说明溶液中含有Ag+
C. Fe3+产生的原因是由于酸性溶液中的NO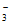 具有氧化性
具有氧化性
D. 30 min时”白色沉淀量减少,溶液红色加深”的原因可能是:Fe2++Ag+=Fe3++Ag
第二部分
本部分共5题,共58分。
15. 碘酸钾是一种重要的无机物,可用作食盐中的加碘剂。其制备方法如下:
Ⅰ. 过氧化氢氧化法
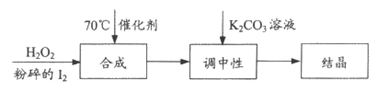
(1)合成步骤中加快化学反应速率的措施是_______________。
(2)合成步骤中的化学方程式为_______________。
(3)当合成温度高于70℃,碘酸钾产率会降低,请写出可能的两种原因_______________。
Ⅱ. 氯酸钾氧化法
(4)在稀硝酸介质中,用氯酸钾氧化碘单质,然后用氢氧化钾中和碘酸氢钾[KH(IO3)2],补全反应的化学方程式:
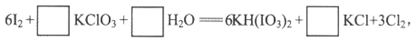
KH(IO3)2+KOH=2KIO3+H2O。
(5)相对于氯酸钾氧化法,过氧化氢氧化法的优点是_______________。
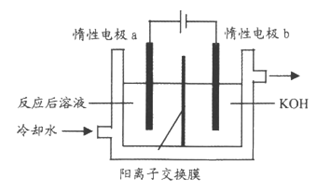
Ⅲ. 电解法
(6)先将一定量的I2溶于过量的KOH溶液,发生反应:
3I2+6KOH=5KI+KIO3+3H2O
将反应后溶液加入阳极区,制备纯度较高的碘酸钾。写出阳极的电极反应式_______________。
16. 零价纳米铁在环境修复中具有广泛应用,可用来处理地下水中的铼酸根离子(ReO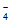 )。
)。
资料:零价纳米铁胶粒表面带正电,采用物理吸附和还原的共同作用,可将ReO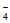 固定,防止其随地下水的运动而迁移。
固定,防止其随地下水的运动而迁移。
(1)利用无机炭作为还原剂,在高温下通过氧化还原反应来制备零价纳米铁,涉及的反应有:
6Fe2O3(s)+C(s)=4Fe3O4(s)+CO2(g)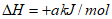
Fe3O4(s)+2C(s)=3Fe(s)+2CO2(g)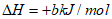
写出无机炭还原氧化铁制备纳米铁的热化学方程式_______________。
(2)液相还原法也可用来制备零价纳米铁。
将50mL KBH4(B元素的化合价为+3)水溶液添加到50 mL FeSO4水溶液中,搅拌数秒钟,溶液变黑时停止搅拌,用磁铁分离沉淀,先用蒸馏水充分洗涤,再用无水乙醇洗涤3次,氮气保护下烘干,即得所需纳米铁。反应原理为:
Fe2++2BH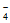 +6H2O=Fe+2B(OH)3+7H2
+6H2O=Fe+2B(OH)3+7H2
①氮气作用下烘干的目的是_______________。
②每生成1 mol Fe,转移电子数为_______________。
(3)零价纳米铁具有很强的还原能力。某酸性样品溶液中含有K+、Na+、Ca2+、Cl-、ReO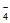 等离子。在酸性环境下,用零价纳米铁可将该样品溶液中的ReO
等离子。在酸性环境下,用零价纳米铁可将该样品溶液中的ReO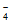 还原成固态的ReO2而除去,自身转化成Fe3+。
还原成固态的ReO2而除去,自身转化成Fe3+。
①写出反应的离子方程式_______________。
②反应后样品溶液中阴离子浓度降低,而阳离子浓度几乎无变化,可能的原因是_______________。
③研究表明pH过高或过低会使ReO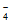 的去除率降低,可能的原因分别是_______________。
的去除率降低,可能的原因分别是_______________。
17. 焦亚硫酸钠(Na2S2O5)为白色或黄色结晶粉末或小结晶,带有强烈的SO2气味,与强酸接触则放出SO2。在医药、橡胶、印染、食品、含铬污水处理等方面应用广泛。
(1)利用烟道气中的SO2生产Na2S2O5的工艺为:
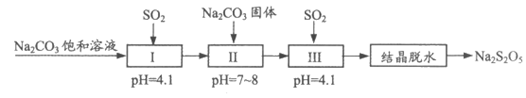
资料:当NaHSO3溶液过饱和后静置,会结晶析出焦亚硫酸钠晶体。
①焦亚硫酸钠中硫元素的化合价为_______________。
②写出Ⅰ中发生反应的离子方程式_______________。
③工艺中加入Na2CO3固体,并再次充入SO2的目的是_______________。
(2)研究表明,焦亚硫酸钠处理含铬(Ⅵ)废水较其他方法效果好,处理费用低。
其工艺流程如下:
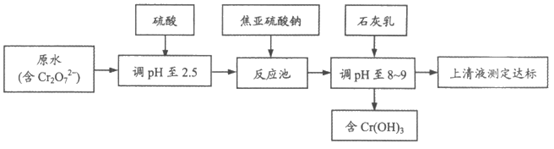
①反应池中发生反应的离子方程式_______________。
②Cr2O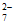 在酸性条件下氧化性强,在实际工业中pH过低,则需要的焦亚硫酸钠的量比理论值高出许多,结合化学用语解释可能的原因是_______________。
在酸性条件下氧化性强,在实际工业中pH过低,则需要的焦亚硫酸钠的量比理论值高出许多,结合化学用语解释可能的原因是_______________。
(3)葡萄酒中常常会加入Na2S2O5做抗氧化剂,中华人民共和国国家标准(G112760-2011)规定葡萄酒中抗氧化剂的残留量(以游离SO2计算)不能超过0.25g/L。在测定某葡萄酒中Na2S2O5残留量时,取50.00mL葡萄酒样品,并用0.0100mol/L的碘标准液(含淀粉)滴定至终点,消耗10.00mL。
①滴定反应的离子方程式为_______________。
②判断达到滴定终点的现象为_______________。
③该葡萄酒中Na2S2O5的残留量为_______g/L(以SO2计)。
18. 为进一步研究过氧化钠与水的反应,某活动小组进行了如下探究。
(1)把一定量水滴入盛有少量过氧化钠固体的试管中,反应的化学方程式为_______________。
(2)向反应后的溶液中滴入酚酞,一段时间后,发现溶液颜色逐渐变浅,最后颜色消失。为探究原因,进行实验1(环境温度为30℃)结果如下:
NaOH溶液浓度/(mol/L) | 10.0 | 2.0 | 1.0 | 0.10 | 0.010 |
滴入酚酞时现象 | 深紫红色 | 深红色 | 深红色 | 深红色 | 深红色 |
溶液变为浅红色时间 | 2~3s | 26~30s | 54~60s | 6~7min | 45min内稳定不变 |
溶液完全褪色时间 | 7~8s | 50~54s 几乎无色 | 100~110s 几乎无色 | 20min后仍为浅红色 | 2h后略 变浅 |
最终溶液是否褪色 | 褪色 | 褪色 | 褪色 | 不褪色 | 不褪色 |
结合表中数据,判断下列说法正确的是_______________。(填字母)
a. 其他条件相同时,NaOH溶液浓度越大褪色越快
b. 溶液褪色可能是NaOH溶液浓度过大导致的
c. 当NaOH溶液浓度大于或等于1.0mol/L时,对溶液颜色变化有明显影响
(3)中间产物H2O2也可能会对溶液颜色的变化产生影响。
①假设1:受H2O2自身氧化性的影响。
为验证假设,设计实验方案:_______________。实验表明,随H2O2浓度的增大,溶液颜色变化更快。
②假设2:_______________。
为验证假设,设计了实验2,请补全实验装置。
实验2结果如下:
NaOH溶液浓度/(mol/L) | 滴入酚酞时现象 | 溶液完全褪色时间 |
2.0 | 深红色 | 约50s |
1.0 | 深红色 | 约1min 50s |
对比实验1,表中数据说明_______________。
(4)若准确称取Na2O2的质量为1.56g,加入一定体积的水后得到20 mL溶液,则所得NaOH溶液的物质的量浓度为_______________。
(5)实验过程中,需待Na2O2固体完全溶解后再加入酚酞,原因是_______________。
综上所述,Na2O2与水反应过程复杂,滴入酚酞时溶液颜色变化受多因素影响。
19. 功能高分子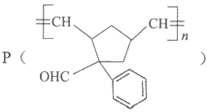 的合成路线如下:
的合成路线如下:
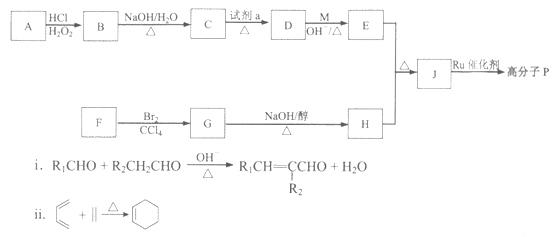
iii. R1CH=CHR2+R3CH=CHR4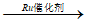 R1CH=CHR4+R3CH=CHR2
R1CH=CHR4+R3CH=CHR2
(1)A属于芳香烃,分子式是C8H8。A的名称是_______________。
(2)C→D所需的试剂a是_______________。
(3)F→G的反应类型是_______________。
(4)E的分子式是C9H8O,D→E的化学方程式是_______________。
(5)H是五元环状化合物,分子式为C5H6,G→H的化学方程式是_______________。
(6)写出J的结构简式_______________。
(7)参照上述信息,写出以乙醇和1,3-丁二烯为原料(其他无机试剂任选),制备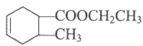 的合成路线:______________。
的合成路线:______________。
(如: 用结构简式表示有机化合物)
用结构简式表示有机化合物)
【试题答案】
说明:考生答案如与本答案不同,若答得合理,可酌情给分,但不得超过原题所规定的分数。
第一部分
选择题(共42分)
(本题共14小题,每小题3分,共42分)
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
B | D | D | C | D | B | C | B | A | B |
11 | 12 | 13 | 14 | ||||||
A | C | D | C |
第二部分
非选择题(共58分)
15. (11分)
(1)粉碎、70℃、催化剂(2分)
(2)I2+5H2O2
 2HIO3+4H2O(2分)
2HIO3+4H2O(2分)
(3)双氧水分解、碘单质升华、催化剂活性降低(2分)
(4)6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑
(2分)
(5)产物无污染(1分)
(6)I--6e-+6OH-=IO3-+3H2O(2分)
16. (10分)
(1)6Fe2O3(s)+9C(s)=12Fe(s)+9CO2(g)
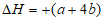 kJ/mol(2分)
kJ/mol(2分)
(2)①防止Fe受热时氧化(1分)
②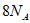 (2分)
(2分)
(3)①4H++Fe+ReO4-=Fe3++ReO2+2H2O(2分)
②零价纳米铁胶粒表面带正电,吸附阴离子(1分)
③pH过低,发生反应Fe+2H+=Fe2++H2;pH过高,生成氢氧化铁包裹在纳米铁表面,降低接触面积,抑制了反应的快速进行(2分)
17. (12分)
(1)①+4(1分)
②H2O+CO32-+2SO2=CO2+2HSO3-(2分)
③增大NaHSO3的浓度,使溶液达到过饱和状态(1分)
(2)①3S2O52-+2Cr2O72-+10H+=6SO42-+4Cr3++5H2O(2分)
②pH过低,发生反应:2H++S2O52-=H2O+2SO2↑,SO2不断逸出,所以需要更多的S2O52(2分)
(3)①3H2O+S2O52-+2I2=4I-+2SO42-+6H+(2分)
②滴入最后一滴碘标准液后,半分钟内蓝色不消失(1分)
③0.128(1分)
18. (12分)
(1)2Na2O2+2H2O=4NaOH+O2↑(2分)
(2)abc(2分)
(3)①取等体积的0.010mol/L的NaOH溶液分置于3个小烧杯中,分别滴加2d酚酞试液,然后同时加入3种不同浓度的H2O2溶液(2分)
②H2O2分解产生的O2的影响(1分)
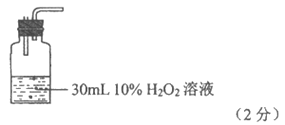
中间产物H2O2分解产生的O2对滴入酚酞溶液时颜色变化几乎没有影响(1分)
(4)2mol/L(1分)
(5)排除因Na2O2剩余时其氧化性对实验造成干扰(1分)
19. (13分)
(1)苯乙烯(1分)
(2)氧气、铜或银(2分)
(3)加成反应(1分)