(考试时间90分钟
满分100分)
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S32 Cl 35.5 Fe 56
第一部分
本部分共14题,每题3分,共42分。在每题列出的四个选项中,选出最符合题目要求的一项。
1. 2020年12月17日,“嫦娥五号“返回器携带月壤成功返回,“可上九天揽月“成为现实。下列涉及火箭发射及“嫦娥五号“的系列材料中,主要成分均为非金属单质的是
|
|
|
|
A. “长征五号“发动机推进剂——液氧和液氢 | B. 制作月面展开的国旗材料之一——高强度芳纶纤维 | C. 返回器减速伞材料——高强度锦纶纤维 | D. 返回器表面所贴“暖宝宝“主要成分——铁粉、碳粉等 |
2. 油脂在人体内的变化过程如图所示。下列说法不正确的是
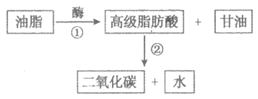
A. 油脂不属于高分子
B. 甘油分子中含有羟基,沸点低于丙醇
C. 酶催化下1 mol油脂完全水解的产物是1 mol甘油和3 mol高级脂肪酸
D. 反应②是人体内脂肪酸的氧化反应,为人体提供能量
3. 双碱法脱硫过程如图所示。下列说法不正确的是
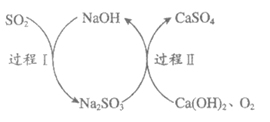
A. 过程I中,SO2表现还原性
B. 过程Ⅱ中,1 molO2可氧化2mol Na2SO3
C. 双碱法脱硫过程中,NaOH可以循环利用
D. 总反应为2Ca(OH)2+2SO2+O=2CaSO4+2H2O
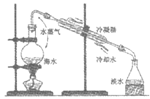
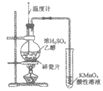
4. 用下列装置不能达到实验目的的是
实验室制氨气 | 海水蒸馏制淡水 | 证明乙醇与浓硫酸 共热生成乙烯 | 用CuSO4溶液 净化乙炔气体 |
|
|
|
|
A | B | C | D |
5. 设NA为阿伏加德罗常数的值,下列说法正确的是
A. 1 mol-OH和1 mol OH–含有的电子数均为10NA
B. 室温下,1 L 0.1 mol·L-l NH4Cl溶液中NH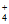 数为0. 1NA
数为0. 1NA
C. 标准状况下,NA个NO分子和0.5NA个O2分子充分反应后气体体积为22.4L
D. 常温常压下,1.6g CH4中含有的共价键总数为0.4NA
6. 某同学用2%的AgNO3溶液和2%的稀氨水配制银氨溶液并进行乙醛的银镜反应实验,过程如图:
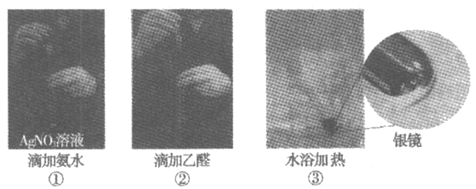
下列解释事实的方程式不正确的是
A. 氨水显碱性:NH3·H2O NH
NH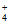 +OH–
+OH–
B. ①中产生沉淀:Ag++OH–=AgOH↓
C. ①中滴加氨水至沉淀消失:AgOH+2NH3·H2O=Ag(NH3)2OH+2H2O
D. ③中出现银镜:CH3CHO+2Ag(NH3)2OH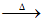 CH3COONH4+2Ag↓+3NH3+H2O
CH3COONH4+2Ag↓+3NH3+H2O
7. 由下列实验及相应事实推理所得的结论,不能用元素周期律解释的是
实验 | 事实 | 结论 | |
A | 将体积相同的Na和K 分别投入冷水中 | K与H2O反应更剧烈 | 金属性:K>Na |
B | 将足量硫酸与 Na3PO4溶液混合 | 生成H3PO4 | 非金属性:S>P |
C | 分别加热HCl气体 和HI气体 | HI气体更易分解 | 稳定性:HCl>HI |
D | 分别加热Na2CO3固体 和NaHCO3固体 | NaHCO3固体更易分解 | 热稳定性:Na2CO3>NaHCO3 |
8.
用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应a可实现氯的循环利用:
反应a:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)
 H1=-115.6kJ·mol-1
H1=-115.6kJ·mol-1
已知:
i. 
ii. H2O(g)=H2O(1)
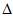 H2=-44kJ·mol-1
H2=-44kJ·mol-1
下列说法不正确的是
A. 反应a中反应物的总能量高于生成物的总能量
B. 反应a中涉及极性键、非极性键的断裂和生成
C. 4HCl(g)+O2(g)=2Cl2(g)+2H2O(1)
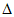 H3=-159.6kJ·mol-1
H3=-159.6kJ·mol-1
D. 断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为31.9kJ
9. 聚脲具有防腐、防水、耐磨等特性,合成方法如下:
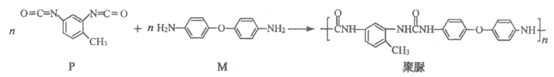
下列说法不正确的是
A. P和M通过加成反应形成聚脲
B. 一定条件下聚脲能发生水解反应
C. M苯环上的一氯代物有2种
D. M与 NH2互为同系物
NH2互为同系物
10. 工业上利用CO和H2合成二甲醚:3CO(g)+3H2(g)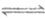 CH3OCH3(g)+CO2(g)△H。
CH3OCH3(g)+CO2(g)△H。
其它条件不变时,相同时间内CO的转化率随温度T的变化情况如图所示。下列说法不正确的是
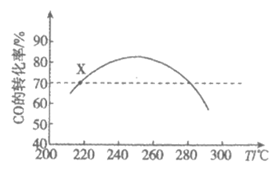
A. △H<0
B. 状态X时,v消耗(CO)=v生成(CO)
C. 相同温度时,增大压强,可以提高CO的转化率
D. 状态X时,选择合适催化剂,可以提高相同时间内CO的转化率
11. 一种三室微生物燃料电池污水净化系统的原理如图所示,图中含酚废水中的有机物可用C6H5OH表示。
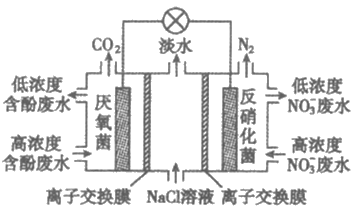
下列说法不正确的是
A. 右室电极为该电池的正极
B. 右室电极附近溶液的pH增大
C. 左侧离子交换膜为阳离子交换膜
D. 左室电极反应式可表示为C6H5OH+11H2O-28e–=6CO2↑+28H+
12. 常温下,用0.10 ml·L-1 NaOH溶液分别滴定20.00 mL浓度均为0.10 mol·L-1 CH3COOH溶液和HCN溶液,所得滴定曲线如图。下列说法不正确的是
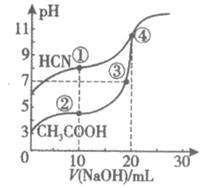
A. 点①所示溶液中,CN–的水解程度大于HCN的电离程度
B. 点①和点②所示溶液中:c(CN–)>c(CH3COO–)
C. 点③所示溶液中:c(Na+)=c(CH3COO–)>c(H+)=c(OH–)
D. 点④所示溶液中:c(Na+)>c(CH3COO–)>c(OH–)>c(H+)
13. 锂电池具有广泛应用。用废铝渣(含金属铝、锂盐等)获得电池级Li2CO3的一种工艺流程如下(部分物质已略去):
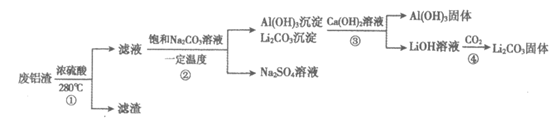
下列说法不正确的是
A. ①中加热后有SO2生成
B. ②中生成Al(OH)3的离子方程式:2A13++3CO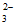 +3H2O=2Al(OH)3↓+3CO2↑
+3H2O=2Al(OH)3↓+3CO2↑
C. 由③推测溶解度:CaCO3>Li2CO3
D. ④中不宜通入过多CO2,否则会造成Li2CO3产率降低
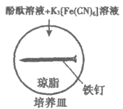
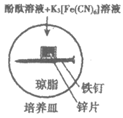
14. 实验小组研究金属电化学腐蚀,实验如下:
序号 | 实验 | 5min | 25min |
实验I |
| 铁钉表面及周边未见明显变化 | 铁钉周边零星、随机出现 极少量红色和蓝色区域, 有少量红棕色铁锈生成 |
实验Ⅱ |
| 铁钉周边出现红色区域,未见蓝色出现 锌片周边未见明显变化 | 铁钉周边红色加深,区域变大,未见蓝色出现 锌片周边未见明显变化 |
下列说法不正确的是
A. 实验Ⅱ中Zn保护了Fe,使铁的腐蚀速率比实验I慢
B. 实验Ⅱ中正极的电极反应式:O2+2H2O+4e–=4OH–
C. 实验I的现象说明K3[Fe(CN)6]溶液与Fe反应生成了Fe2+
D. 若将Zn片换成Cu片,推测Cu片周边会出现红色,铁钉周边会出现蓝色
第二部分
本部分共5题,共58分。
15. (10)用FeSO4·7H2O晶体配制FeSO4溶液,放置一天后发现产生黄色固体。实验小组同学研究固体成分及产生的原因。
(1)①配制100 mL 0.100 mol·L-1 FeSO4溶液,需要称取_______g FeSO4·7H2O晶体。
(已知:FeSO4·7H2O的摩尔质量为278 g·mol-1)
②需要的主要玻璃仪器有:烧杯、玻璃棒、量筒、胶头滴管和________。
(2)小组同学推测放置一天后FeSO4溶液中存在Fe3+,将产生Fe3+的离子方程式补充完整:
□Fe2++□H++□________=□Fe3++□________
(3)分离出黄色固体,经多次洗涤后完成如下实验:
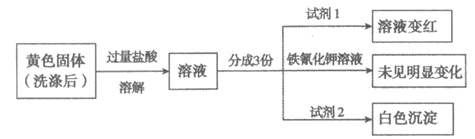
证实黄色固体中含Fe3+和SO ,试剂1和试剂2分别是______、______。
,试剂1和试剂2分别是______、______。
(4)实验测定FeSO4溶液放置过程中溶液的pH和黄色固体的量的变化,结果如下:
1小时 | 6小时 | 24小时 | |
溶液的pH | 2. 39 | 2. 35 | 1. 40 |
黄色固体的量 | 几乎没有 | 少量 | 大量 |
分析黄色固体中除Fe3+、SO 外,还可能含有______离子。
外,还可能含有______离子。
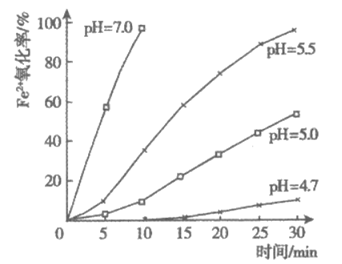
(5)查阅资料:不同pH下Fe2+的氧化率随时间变化的关系如下图。为避免Fe2+被氧化,配制FeSO4溶液时,需要添加________。
16. (12分)氮氧化物会造成环境污染,我国科学家正着力研究SCR技术(NH3选择性催化还原氮氧化物)对燃煤电厂烟气进行脱硝处理。
(1)氮氧化物(以NO为主)直接排放到空气中会形成硝酸型酸雨,反应的化学方程式为_________。
(2)NH3催化还原NO的化学方程式为________。
(3)铁基催化剂在260~300℃范围内实现SCR技术的过程如下:
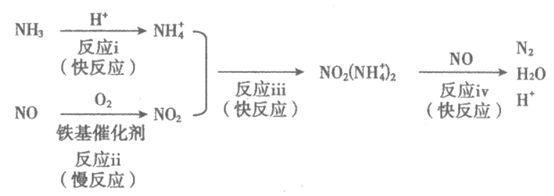
①反应iv中消耗的NO2(NH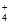 )2与NO的物质的量之比为________。
)2与NO的物质的量之比为________。
②适当增大催化剂用量可以明显加快脱硝速率,结合上述过程解释原因:__________。
③向反应体系中添加NH4NO3可显著提高NO脱除率。原因如下:
NO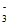 与NO发生反应NO
与NO发生反应NO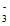 +NO=NO2+NO
+NO=NO2+NO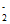 ;
;
NO2与NH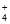 发生反应iii和反应iv转化为N2;
发生反应iii和反应iv转化为N2;
NO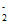 与NH
与NH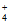 发生反应________(填离子方程式)转化为N2。
发生反应________(填离子方程式)转化为N2。
(4)相比于铁基催化剂,使用锰基催化剂(活性物质为MnO2)时,烟气中含有的SO2会明显降低NO脱除率。
①推测SO2与MnO2会发生反应使催化剂逐渐失效,其化学方程式是_______。
②持续通入含SO2的烟气。不同温度下,每隔1h测定NO脱除率,结果如下:
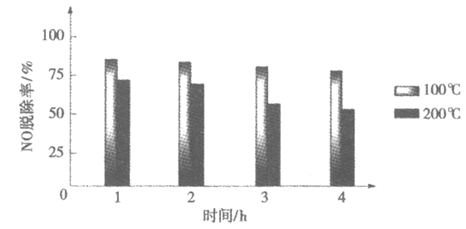
相同时间,200℃时NO脱除率低于100℃,原因是_______。
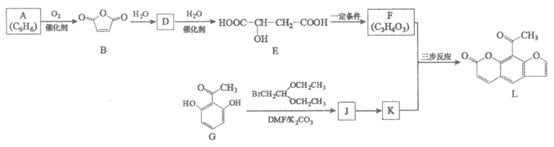
17. (12分)花椒毒素对血液中多种病毒有很好的灭活作用,还可用于治疗皮肤顽疾。花椒毒素的一种中间体L的合成路线如下:
已知:i.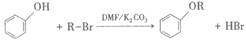
ii. 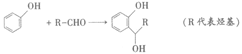
(1)A属于芳香烃,其名称是________。
(2)D为顺式结构。B→D的化学方程式是________。
(3)下列关于E的说法正确的是________(填序号)。
a. E的酸性弱于G
b. E在水中的溶解度大于A
c. 一定条件下,E能形成网状高分子化合物
(4)G→J的反应类型是________。
(5)已知:J→K+2CH3CH2OH,且K分子含两个环状结构。
①J中含有的官能团是醚键、_______和________。
②K的结构简式是__________。
(6)F与K反应生成L的步骤如下:

中间产物1和中间产物2的结构简式分别是________、________。
18. (12分)研究人员将钛(Ti)掺杂进硅沸石中,得到催化剂TS-1,该催化剂能催化丙烯与过氧化氢合成环氧丙烷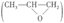 的反应。
的反应。
已知:i. H2O2在酸性溶液中比较稳定,在碱性溶液中易分解。
ii. 环氧丙烷中C—O键活性较强,易断键发生反应。
(1)丙烯转化为环氧丙烷的反应类型是_________。
(2)以甲醇为溶剂,有利于催化剂形成活性中心,可能的催化历程如下。
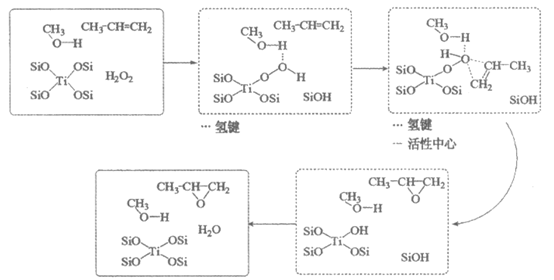
①甲醇中羟基的氢原子与“Ti-OOH”中的氧原子之间能形成氢键,体现出氧的非金属性_______(填“强“或“弱“)。
②研究催化历程常用同位素示踪法。用17O标记H2O2中的所有氧原子,上图所示历程中存在17O的物质除H2O2外,还有_________(填序号)。
a. CH3OH b. 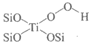 c.
c.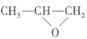
③反应生成的环氧丙烷中含有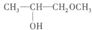 ,这可能是因为环氧丙烷和________发生了副反应产生的。
,这可能是因为环氧丙烷和________发生了副反应产生的。
(3)溶液中适当添加某些碱性物质,能提高环氧丙烷选择性,但会使反应速率明显下降,原因可能有:
i. 碱性较强时,催化剂活性降低;
ii. 碱性较强时,_________。
(4)用环氧丙烷生产具有较高反应活性的碳酸二甲酯,主要过程如下。
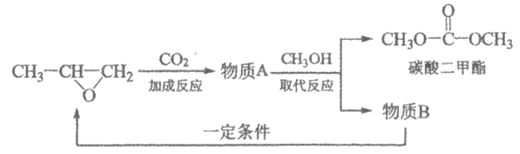
①CO2的电子式为__________。
②A的分子式为C4H6O3(含五元环),其结构简式为__________。
19. (12分)实验小组研究Ag2S的生成与转化。
已知:i. AgCl(s)+3Cl–(aq)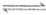 AgCl
AgCl (aq)
(aq)
ii. 常温下一些盐在水中的溶解度及颜色如下表:
盐 | AgCl | Ag2S | Ag2SO3 | Ag2SO4 | CuS |
溶解度/g | 1. 5×10-4 | 1. 3×10-16 | 4. 6×10-4 | 0. 796 | 1. 08×10-17 |
颜色 | 白色 | 黑色 | 白色 | 白色 | 黑色 |
(1)证明AgCl能够转化为Ag2S,实验如下:
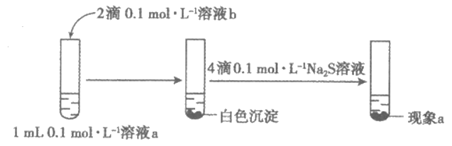
①AgNO3溶液是溶液_________(填“a”或“b”),另一溶液是NaCl溶液。
②现象a是_________。
(2)研究CuCl2溶液能否使Ag2S转化为AgCl,实验如下:
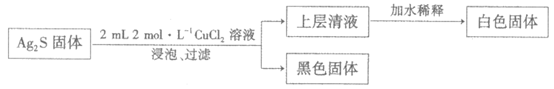
①白色固体含AgCl,结合平衡移动原理解释加水稀释产生白色固体的原因:_______。
②小组同学对Ag2S转化为AgCl的原因提出假设:
假设一:S2-可与Cu2+形成CuS,从而降低c(S2-),加入Cu2+是使Ag2S发生转化的主要原因;
假设二:Ag+可与Cl–形成AgCl ,从而降低c(Ag+),加入Cl–是使Ag2S发生转化的主要原因。
,从而降低c(Ag+),加入Cl–是使Ag2S发生转化的主要原因。
……
小组同学设计对比实验,证明假设二不合理,实验操作和现象是________。
(3)有文献表明,HNO3能使Ag2S转化为Ag2SO3,实验如下:
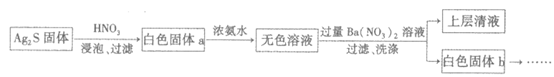
①加入浓氨水,溶解白色固体a的目的是________。
②检验白色固体b中含有亚硫酸根的实验操作和现象是________。
(4)综合上述实验,溶解度较大的银盐转化为Ag2S较容易;而使Ag2S转化为溶解度较大的银盐,可采取的措施有________。
参考答案
第一部分
本部分共 14 题,每题 3 分,共 42 分。在每题列出的四个选项中,选出最符合题目要求的一项。
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
答案 | A | B | A | C | D | B | D | C | D | B |
题号 | 11 | 12 | 13 | 14 | ||||||
答案 | C | B | C | C |
第二部分
本部分共 5 题,共 58 分。
15.(10分)
(1)① 2.78
② 100 mL 容量瓶
(2) 4Fe2+ + 4H+ + O2 = 4Fe3+ + 2H2O
(3)KSCN 溶液 BaCl2 溶液
(4)OH–
(5)适量的稀硫酸和铁粉
16.(12分)
(1)2NO + O2 = 2NO2 ,3NO2 + H2O = 2HNO3 + NO
(2)4NH3 + 6NO 5N2 + 6H2O
5N2 + 6H2O
(3)① 1:1
②
反应 ii 为脱硝反应的决速步,增大催化剂的用量可提高反应 ii 的速率,进而提高脱硝反应速率
③ NO2–+NH4+ = N2 + 2H2O
(4)① MnO2 + SO2 = MnSO4
②
温度升高使催化剂失效速率加快,导致温度升高对 NO 脱除速率增大的影响不如催化剂失效对 NO 脱除速率降低的影响显著
17.(12分)
(1)苯
(2)
(3)bc
(4)取代反应
(5)①
羟基、羰基
②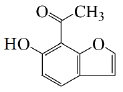
(6)
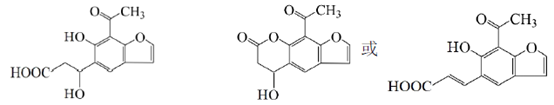
18.(12分)
(1)氧化反应
(2)①强
②bc
③CH3OH
(3)H2O2 分解使反应物浓度降低
(4)①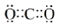
②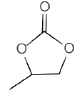
19.(12分)
(1)① b
②白色沉淀变为黑色沉淀
(2)①
加水稀释使平衡 AgCl(s)+ 3Cl–(aq)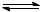 AgCl43-(aq)逆向移动,生成白色沉淀
AgCl43-(aq)逆向移动,生成白色沉淀
②用2mL 4mol/L NaCl 溶液浸泡 Ag2S 沉淀,取上层清液,加水稀释,未见白色沉淀产生
(3)①
使白色沉淀a 中的 SO3
2-进入溶液中,以便后续检验
②
向白色固体b 中加入足量盐酸,沉淀部分溶解
(4)加入合适的试剂,使之转化为更难溶的硫化物;
加入合适的氧化剂,将S2-氧化