本试卷有2道大题,考试时长90分钟,满分100分。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Cl-35.5 Fe-56 Cu-64
一、选择题(共25道小题,每小题2分,共50分。每小题只有1个选项符合题意)
1. 金属材料的应用促进了人类社会的发展。下列不属于金属材料的是
A. 储氢合金 | B. 青花瓷 | C. 航母钢甲板 | D. 钛合金耐压球壳 |
|
|
|
|
2. 下列物质类别中,前者包括后者的是
A. 化合物
电解质 B. 溶液
胶体
C. 氧化物
化合物 D. 溶液
分散系
3. 下列有关性质的比较,不能用元素周期律解释的是
A. 酸性:H2SO4>H3PO4 B. 非金属性:Cl>Br
C. 碱性:NaOH>Mg(OH)2 D. 热稳定性:Na2CO3>NaHCO3
4. 下列微粒中,与OH-具有相同电子总数和质子总数的是
A. K+ B. Na+ C. F- D. Ne
5. 下列物质中,既含有离子键又含有共价键的是
A. H2SO4 B. NaOH C. MgCl2 D. NaCl
6. 重水(2H2O)是重要的核工业原料,下列说法不正确的是
A. 1H与2H是不同的核素 B. 氘(2H)原子核内有1个质子
C. 1H218O与2H216O的摩尔质量相同 D. 1H2O与2H2O互为同位素
7. 2016年,IUPAC命名117号元素为TS(中文名”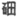 “),Ts的核外最外层电子数是7,下列说法不正确的是
“),Ts的核外最外层电子数是7,下列说法不正确的是
A. Ts是第七周期第ⅦA族元素
B. Ts的同位素原子具有相同的电子数
C. Ts在同族元素中非金属性最弱
D. 中子数为176的Ts核素符号是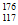 Ts
Ts
8. 下列反应的离子方程式书写正确的是
A. 钠和水反应:Na+H2O=Na++OH-+H2↑
B. 氯化铝溶液中加入氨水:Al3++3OH-=Al(OH)3↓
C. 硫酸亚铁溶液中滴入氯水:2Fe2++Cl2=2Fe3++2Cl-
D. 澄清石灰水与过量小苏打溶液混合:Ca2++OH-+HCO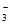 =CaCO3↓+H2O
=CaCO3↓+H2O
9. 下列溶液中的c(SO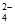 )与50 mL 1 mol/L Al2(SO4)3溶液中的c(SO
)与50 mL 1 mol/L Al2(SO4)3溶液中的c(SO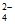 )相等的是
)相等的是
A. 150 mL 1 mol/L Na2SO4溶液 B. 75 mL 2 mol/L(NH4)2SO4溶液
C. 150 mL3 mol/L K2SO4溶液 D. 20 mL 1.5mol/L Fe2(SO4)3溶液
10. 设NA代表阿伏加德罗常数的数值,下列说法正确的是
A. 在常温常压下,11.2L氧气所含的原子数目为NA
B. 1mol/LNa2SO4溶液中含有的Na+的数目为2NA
C. 5.6g铁与足量盐酸反应转移的电子数为0.3NA
D. 18g NH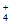 所含的电子数目为10NA
所含的电子数目为10NA
11. 在一定条件下,RO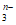 和氟气可发生如下反应:RO
和氟气可发生如下反应:RO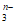 +F2+2OH-=RO
+F2+2OH-=RO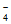 +2F-+H2O。从而可知在RO
+2F-+H2O。从而可知在RO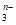 中,元素R的化合价是
中,元素R的化合价是
A. +4 B. +5 C. +6 D. +7
12. 在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是
A. 氯水的颜色呈浅黄绿色,说明氯水中含有Cl2
B. 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+
C. 向氯水中滴加HNO3酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-
D. 向FeCl2溶液中滴加氯水,溶液颜色由浅绿色变成棕黄色,说明氯水中含有HClO
13. 下列有关试剂保存的说法中,不正确的是
A. 新制氯水保存在棕色试剂瓶中 B. 金属钠保存在煤油中
C. 漂白粉可以保存在敞口容器中 D. 过氧化钠应密封保存
14. 打印机使用的墨粉中含有Fe3O4。将FeSO4溶液和Fe2(SO4)3溶液按一定比例混合,再加入一定量的NaOH溶液,水浴加热,可制得Fe3O4,反应如下:
___Fe2++___Fe3++___OH-=___Fe3O4+___H2O
下列分析不正确的是
A. Fe3O4具有磁性
B. 反应中,Fe2+是还原剂,Fe3+是氧化剂
C. 从左至右,反应中各物质的化学计量数依次为1、2、8、1、4
D. Fe3O4可与盐酸反应生成Fe2+和Fe3+,所得两种离子的物质的量之比为1:2
15. 下列物质除杂中所选试剂和分离方法都正确的是
选项 | 物质(括号内为杂质) | 除杂试剂 | 分离方法 |
A | Fe(Cu) | 盐酸 | 过滤 |
B | CO2(HCl) | NaOH溶液 | 洗气 |
C | FeCl2溶液(FeCl3) | 铁粉 | 过滤 |
D | Fe2O3(Al2O3) | 盐酸 | 过滤 |
16. 元素周期表(律)可以指导人们进行推测和判断。下列推测不合理的是
A. 若X+和Y2-的核外电子层结构相同,则原子序数:X>Y
B. 由水溶液的酸性:HCl>H2S,可推断元素的非金属性:Cl>S
C. ⅡA族元素依次为Be、Mg、Ca、Sr、Ba;MgSO4易溶于水,CaSO4微溶于水,则SrSO4可能难溶于水
D. Cs和Ba分别位于第六周期第ⅠA和ⅡA族,则碱性:CsOH>Ba(OH)2
17. 碱金属元素钫(Fr)具有放射性。下列对其性质的预测中,不正确的是
A. 它的金属性比Na强,跟水反应更剧烈
B. 它的原子半径比Na大,离子半径也比Na+大
C. 它与硫酸铜溶液发生置换反应得到金属铜
D. 它的氢氧化物(FrOH)是一种强碱,能使酚酞溶液变红
18. 已知33As、35Br位于同一周期,下列关系正确的是
A. 原子半径:As>Cl>P B. 还原性:AsH3>H2S>HCl
C. 热稳定性:HCl>AsH3>HBr D. 酸性:H3AsO4>H2SO4>H3PO4
19. 在2009年10月1日,新的《饮用天然矿泉水》国家标准正式实施。其中溴酸盐(BrO3–)这一潜在致癌物质被做了严格限制。原因是含有的少量溴化物(Br-),在后续的生产过程中经臭氧(O3)处理可逐渐转化成溴酸盐。下列有关该转化过程中的分析正确的是
A. 溴化物(Br-)得到电子
B. 溴元素被还原,氧元素被氧化
C. 溴元素发生氧化反应,氧元素发生还原反应
D. 臭氧(O3)是氧化剂,溴酸盐(BrO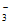 )是还原产物
)是还原产物
20. 已知离子化合物NH4H可以和水反应生成氢气,下列说法不正确的是
A. NH4H既有离子键又有共价键
B. NH4H的电子式: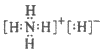
C. 1mol NH4H中含有5NA个N-H键(NA表示阿伏加德罗常数)
D. NH4H与水反应的离子方程式为NH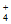 +H-+H2O=NH3·H2O+H2↑
+H-+H2O=NH3·H2O+H2↑
21. 某化学小组用如图所示装置验证卤素单质氧化性的相对强弱。下列说法不正确的是
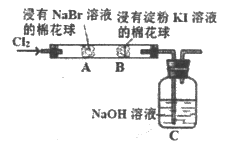
A. A处棉花球变成黄色,说明Cl2的氧化性比Br2强
B. B处棉花球变成蓝色,说明Br2的氧化性比I2强
C. A处发生反应的离子方程式:Cl2+2Br-=2Cl-+Br2
D. 装置C中主要反应的离子方程式:Cl2+2OH-=ClO-+Cl-+H2O
22. 人们常以不同类别物质间的转化为线索,认识元素及其化合物。含钠元素物质的转化关系如下图所示。下列分析不正确的是
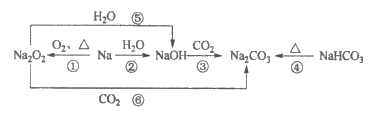
A. 反应③利用了NaOH的碱性
B. 反应④说明NaHCO3的稳定性强于Na2CO3
C. 反应⑤、⑥可用于潜水艇中氧气的供给
D. 转化中涉及了分解反应、化合反应和置换反应
23. 下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是
A. 取a克混合物充分加热,减重b克
B. 取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C. 取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体
D. 取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
24. 几种短周期元素的原子半径及主要化合价如下表,下列说法正确的是
元素代号 | X | Y | Z | N | M | R | Q |
原子半径 | 0.37 | 1.86 | 1.43 | 0.88 | 0.99 | 0.75 | 0.74 |
最高正价 | +1 | +1 | +3 | +3 | +7 | +5 | |
最低负 | -1 | -1 | -3 | -2 |
A. 离子半径:Y>Z>M
B. 气态氢化物稳定性:R>Q
C. Y和Q形成的两种化合物中,阴、阳离子个数比不同
D. Y、Z、M三种元素的最高价氧化物的水化物两两之间会反应
25. 含Ba的三效催化剂是一种常见的汽车尾气催化剂,其催化剂表面物质转化的关系如图所示。下列说法正确的是
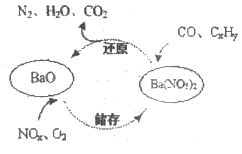
A. 在转化过程中,氮元素均被还原
B. 还原过程中生成1mol N2,转移电子10 mol
C. 依据图示判断催化剂不参与储存和还原过程
D. 当NOx中x=1时,储存过程中,反应的NO和O2的物质的量之比为3:4
二、非选择题(共7道小题,共50分)
1. 配制500mL,0.10mol/L的Na2CO3溶液。
(1)需要的玻璃仪器有烧杯、玻璃棒、胶头滴管和__________。
(2)所需Na2CO3固体质量为__________g。
(3)下列操作会使所配溶液浓度偏低的是__________(填字母序号)。
A. 洗涤步骤中,没有洗涤玻璃棒
B. 加水定容时,水量超过了刻度线
C. 定容读数时,俯视容量瓶上的刻度线
(4)取出50 mL配制好的溶液,加蒸馏水稀释至c(Na2CO3)=0.05 mol/L。则稀释后溶液的体积为__________mL。
2. 印刷电路板(PCB)是用腐蚀液(FeCl3溶液)将覆铜板上的部分铜腐蚀而制得。一种制作PCB并将腐蚀后废液(金属离子主要含:Fe3+、Cu2+、Fe2+)回收再生的流程如下。
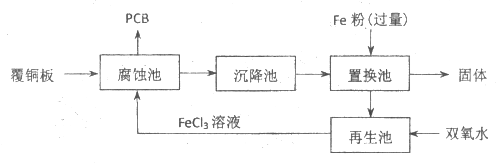
(1)腐蚀池中发生反应的离子方程式是_____________。
(2)上述各池中,没有发生化学变化的是_____________池。
(3)置换池中发生反应的离子方程式有_____________、_____________。
(4)向再生池中通入Cl2也可以使废液再生,相比Cl2,用双氧水的优点是_____________。
3. 2019年诺贝尔化学奖颁给锂离子电池领域,获奖科学家的重要贡献之一是研发出了电极材料——磷酸亚铁锂(LiFePO4)。LiFePO4的一种制备方法如下。
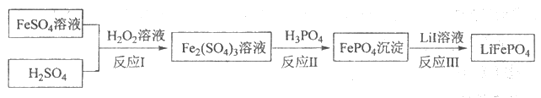
已知:H3PO4能电离出PO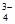 。
。
(1)Li在元素周期表中的位置是_____________。
(2)LiFePO4中,Fe元素的化合价为_____________。
(3)将反应Ⅰ补充完整:____Fe2++2H++____H2O2=____Fe3++2H2O。
(4)反应Ⅲ的化学方程式是_____________。
4. NaHSO4在工业中可以用于金属银的提取,还可以作为某些物质保存的防腐剂。
已知0.1mol/L的NaHSO4溶液和0.1mol/L的盐酸中氢离子浓度相同。
(1)NaHSO4属于_____________类化合物(填物质类别)。
(2)NaHSO4在溶液中的电离方程式是_____________。
(3)将NaHCO3溶液和NaHSO4溶液混合,发生反应的离子方程式为_____________。
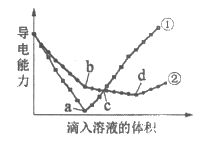
(4)在两份浓度、体积均相同的Ba(OH)2溶液中,分别滴入浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。曲线______代表NaHSO4溶液的曲线,从开始到b点总的离子方程式是_____________。从b点到d点反应的离子方程式是_____________。
5. 下表为元素周期表的一部分,请根据元素①—⑨在表中的位置,回答下列问题:
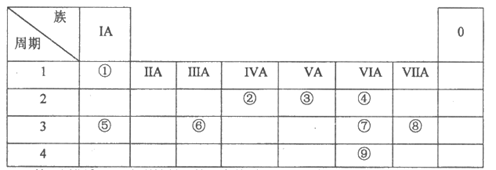
(1)第三周期中,非金属性最强的元素的原子结构示意图为_____________。
(2)⑦的气态氢化物比⑨的气态氢化物稳定。从结构角度解释原因:⑦和⑨均属于第ⅥA族元素,_____________,非金属性强。
(3)③形成单质的电子式为_____________。
(4)用电子式表示④的氢化物的形成过程:_____________。
(5)下列各项可以判断⑤和⑥金属性强弱的是_____________。
A. ⑤的单质的熔点比⑥的单质低
B. ⑤的化合价比⑥的低
C. 单质与水反应,⑤比⑥剧烈
D. ⑤最高价氧化物对应的水化物的碱性比⑥的强
(6)④⑤可以形成原子个数比为1:1的化合物M,M可以作为潜水艇中的供氧剂,M所含的化学键类型是_____________。
6. 高氯酸铜[Cu(ClO4)2]是一种燃烧催化剂,可用于配制烟花火药。该物质易溶于水,在130℃时会分解。以食盐等为原料制备Cu(ClO4)2·6H2O的一种工艺流程如下:
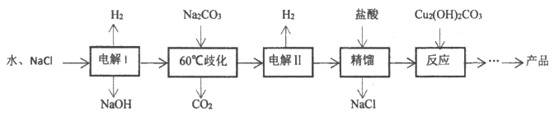
已知:Ⅰ. 产率=(实际产量/理论产量)×100%;
Ⅱ. 精馏是利用混合物中各组分挥发度不同而将各组分加以分离的操作
Ⅲ. HClO4沸点为:19℃
(1)将”电解Ⅰ”的总反应补充完整:2H2O+2NaCl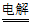 H2↑+_____↑+2NaOH
H2↑+_____↑+2NaOH
(2)”60℃歧化”时生成的产物之一为NaClO3,则该反应的离子方程式为_____________。
(3)”电解Ⅱ”的总反应为:H2O+NaClO3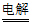 H2↑+NaClO4,其中被氧化的元素和被还原的元素的物质的量之比为_____________。
H2↑+NaClO4,其中被氧化的元素和被还原的元素的物质的量之比为_____________。
(4)”精馏”步骤加入盐酸的目的是_____________。
(5)”反应”的核心步骤是HClO4与Cu2(OH)2CO3反应生成Cu(ClO4)2,该反应的化学方程式为:_____________。
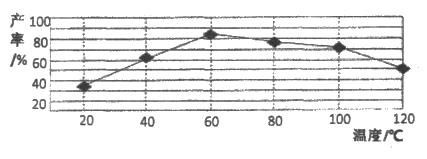
(6)”反应”阶段所采用的不同实验条件对产率影响的结果如下图所示。则该反应最适宜的温度是_____________。用该工艺流程制备高氯酸铜时,若起始时NaCl质量为a t,最终制得的Cu(ClO4)2·6H2O(摩尔质量为371g/mol)为b t,则产率为___________(用含a、b的代数式表示)。
7. 高铁酸钾是一种高效净水剂。某实验小组制备高铁酸钾(K2FeO4)并探究其性质。
【资料】K2FeO4为紫色固体,微溶于KOH溶液:具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)K2FeO4在酸性溶液中产生氧气的离子方程式为_____________。
(2)制备K2FeO4(夹持装置略)
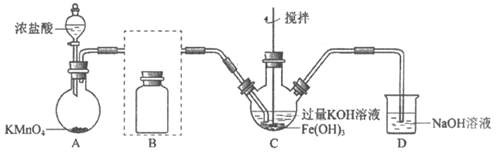
①A为氯气发生装置。A中反应的离子方程式是_____________(锰被还原为Mn2+)。
②将除杂装置B补充完整并标明所用试剂。
③C中得到紫色固体和溶液。C中Cl2发生的反应有
3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O,另外还有_______________。
(3)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
方案Ⅰ | 取少量a,滴加__________,现象_____________ |
方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
i. 由方案Ⅰ中现象证明产生了Fe3+,请将方案Ⅰ补充完整,但Fe3+的产生不能判断一定是K2FeO4将Cl-氧化,Fe3+还可能由_____________产生。
ii. 方案Ⅱ可证明K2FeP4氧化了Cl-。用KOH溶液洗涤的目的是_____________。
②根据K2FeO4的制备实验得出:氧化性Cl2_________FeO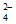 (填”>”或”<“),而方案Ⅱ实验表明,Cl2和FeO
(填”>”或”<“),而方案Ⅱ实验表明,Cl2和FeO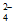 的氧化性强弱关系相反,原因是__________________________。
的氧化性强弱关系相反,原因是__________________________。
【试题答案】
一、选择题(每小题2分,共50分)
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
B | A | D | C | B | D | D | C | C | D | B | D | C |
14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
B | C | B | C | B | C | C | B | B | D | D | B |
二、非选择题(共50分)
1. (4分)
(1)500mL容量瓶
(2)5.30g (3)AB (4)100
2. (7分)
(1)Cu+2Fe3+=Cu2++2Fe2+
(2)沉降
(3)Fe+2Fe3+=3Fe2+ Fe+Cu2+=Fe2++Cu
(4)避免有毒气体污染环境
3. (6分)
(1)第二周期第ⅠA族
(2)+2
(3)2Fe2++2H++1H2O2=2Fe3++2H2O
(4)2FePO4+2LiI=2LiFePO4+I2
4. (6分)
(1)盐(或酸式盐或钠盐等)
(2)NaHSO4=Na++H++SO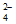
(3)H++HCO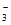 =H2O+CO2↑
=H2O+CO2↑
(4)② H++SO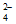 +Ba2++OH-=BaSO4↓+H2O H++OH-=H2O
+Ba2++OH-=BaSO4↓+H2O H++OH-=H2O
5.(7分)
(1)
(2)⑦比⑨电子层数少,半径小,原子核对最外层电子引力大,得电子能力强
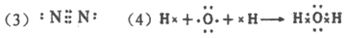
(5)CD (6)非极性共价键,离子键
6.(9分)
(1)Cl2
(2)3CO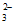 +3Cl2
+3Cl2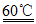 5Cl-+ClO
5Cl-+ClO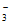 +3CO2
+3CO2
(3)1:2
(4)提高HClO4的产率(答到生成HClO4意思即可)
(5)4HClO4+Cu2(OH)2CO3=3H2O+CO2↑+2Cu(ClO4)2
(6)60℃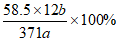
7.(11分)
(1)4FeO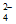 +20H+=4Fe3++3O2↑+10H2O
+20H+=4Fe3++3O2↑+10H2O
(2)①2MnO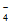 +16H++10Cl-=2Mn2++5Cl2↑+8H2O
+16H++10Cl-=2Mn2++5Cl2↑+8H2O
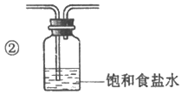
③Cl2+2OH-=Cl-+ClO-+H2O(化学方程式也得分)
(3)①i. 滴加KSCN溶液至过量;溶液呈红色;
酸性条件下自身反应生成
ii. 排除ClO-的干扰
②> 溶液酸碱性不同,对物质氧化性或还原性有影响




