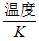本试卷共100分。考试时长90分钟。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Fe 56
第一部分
本部分共14题,每题3分,共42分。在每题列出的四个选项中,选出最符合题目要求的一项。
1. 剧装戏具的制作技艺是首批国家传统工艺振兴项目之一。下列括号中所列高分子材料的主要成分不属于蛋白质的是
|
|
|
|
A. 戏衣(丝绸) | B. 头盔(羽毛) | C. 髯口(毛发) | D. 刀枪把(竹木) |
2. 化学与生活密切相关。下列说法不正确的是
A. 高温可杀灭细菌,是由于高温可使蛋白质变性
B. 纯碱溶液可去油污,是由于NaHCO3水解使溶液显碱性
C. 石灰石可减少煤燃烧的SO2排放,是由于它可将SO2转化为CaSO4
D. 维生素C常与补铁剂(有效成分中铁元素为+2价)同服,是由于它具有还原性
3. 下列化学用语表述正确的是
A. 乙炔的实验式:CH B. H2O2的电子式: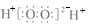
C. Mg2+的结构示意图: D. CO2分子的比例模型:
D. CO2分子的比例模型:
4. 下列离子方程式书写正确的是
A. 氨水与稀盐酸反应:OH–+H+=H2O
B. CuO与稀硝酸反应:CuO+2H+=Cu2++H2O
C. Ba(OH)2溶液与稀硫酸反应:Ba2++SO42-=BaSO4↓
D. 大理石与稀盐酸反应:CO32-+2H+=CO2↑+H2O
5. 锶(Sr)是人体不可缺少的一种微量元素,位于元素周期表中第五周期第ⅡA族。下列关于38Sr的说法不正确的是
A. 原子最外层有2个电子
B. 中子数为52的Sr的核素符号为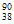 Sr
Sr
C. 与同周期的53I的原子半径:Sr>I
D. 最高价氧化物对应的水化物的碱性:Ca(OH)2>Sr(OH)2
6. 下列颜色变化与氧化还原反应无关的是
A. 用小刀切开金属钠,表面逐渐变暗
B. 推进盛有NO2的密闭针筒的活塞,气体颜色变深
C. 将酸性KMnO4溶液滴入H2C2O4溶液中,溶液紫色褪去
D. 将FeSO4溶液加入NaOH溶液中,最终生成红褐色沉淀
7. 柑橘类水果中含有柠檬酸,其结构简式如下。下列关于柠檬酸的说法不正确的是
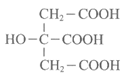
A. 分子式是C6H8O7
B. 是可溶于水的有机化合物
C. 与浓硫酸共热可发生消去反应
D. 核磁共振氢谱有三种不同的吸收峰
8. 火法炼铜的原理:Cu2S+O2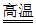 2Cu+SO2。下列说法不正确的是
2Cu+SO2。下列说法不正确的是
A. O2在该反应中作氧化剂
B. 所得气体通入品红溶液,溶液褪色
C. 3.2g O2参与反应时,该反应中电子转移的总数约为4×6.02×1022
D. 所得气体经处理可作工业制硫酸的原料
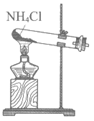
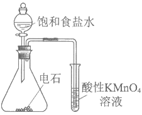
9. 用下图所示装置及药品进行实验,能达到对应实验目的的是
|
|
|
|
图1 | 图2 | 图3 | 图4 |
A. 图1 实验室制氨气 B. 图2 检验乙炔具有还原性
C. 图3 用乙醇萃取碘水中的I2 D. 图4 用海水制取蒸馏水
10. 高分子N可用于制备聚合物离子导体,其合成路线如下:
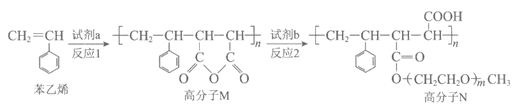
下列说法不正确的是
A. 苯乙烯不存在顺反异构体
B. 试剂a为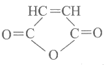
C. 试剂b为HO(CH2CH2O)mCH3
D. 反应1为加聚反应,反应2为缩聚反应
11. 在两个密闭的锥形瓶中,0.05g形状相同的镁条(过量)分别与2mL 2mol·L-1的盐酸和醋酸反应,测得容器内压强随时间的变化曲线如下图。下列说法正确的是
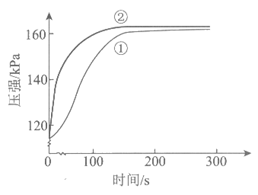
A. ①代表的是盐酸与镁条反应时容器内压强随时间的变化曲线
B. 任意相同时间段内,盐酸与Mg反应的化学反应速率均快于醋酸与Mg反应的化学反应速率
C. 反应中醋酸的电离被促进,两种溶液最终产生的氢气总量基本相等
D. 1 mol·L-l NaOH溶液完全中和上述两种酸溶液,盐酸消耗NaOH溶液的体积更大
12. 新型可充电镁—溴电池能量密度高,循环性能优越,在未来能量存储领域潜力巨大。某镁—溴电池装置如下图(正负极区之间的离子选择性膜只允许Mg2+通过)。
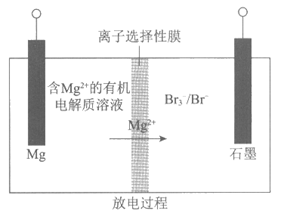
下列说法不正确的是
A. 放电时,Mg电极发生还原反应
B. 放电时,正极反应为:Br3–+2e–=3Br–
C. 充电时,Mg电极应连接电源负极
D. 当0. 1 mol Mg2+通过离子选择性膜时,导线中通过0.2mol e–
13. 一定条件下,分别在甲、乙、丙三个恒容密闭容器中加入A和B,发生反应:
3A(g)+B(g)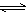 2C(g)
2C(g)
△H>0,448K时该反应的化学平衡常数K=1,反应体系中各物质的物质的量浓度的相关数据如下:
容器
|
|
|
| |
c(A) | c(B) | c(C) | ||
甲 | 448 | 3 | 1 | 0.5 |
乙 | T1 | 3 | 1 | 0.4 |
丙 | 448 | 3 | 2 | a |
下列说法不正确的是
A. 甲中,10分钟内A的化学反应速率:v(A)=0.075 mol·L-1 min-1
B. 甲中,10分钟时反应已达到化学平衡状态
C. 乙中,T1<448K、K乙<K甲
D. 丙中,达到化学平衡状态时A的转化率大于25%
14. 某同学通过实验研究铜盐溶液颜色的变化。下列说法不正确的是
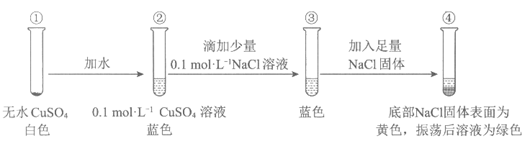
A. 由①②可知,②中溶液呈蓝色是Cu2+与水分子作用的结果
B. 由④可知,Cu2+与Cl–可能会结合产生黄色物质
C. 由③④可知,Cl–的浓度对铜盐溶液的颜色有影响
D. 由②③④可知,CuCl2溶液一定为绿色
第二部分
本部分共5题,共58分。
15. (10分)
某铁矿石中铁元素的化合价为+2价和+3价,测定其中铁元素总含量的实验如下。
已知:i. 该实验条件下,SnCl2的氧化产物为SnCl62-,Cr2O72-的还原产物为Cr3+。
ii. 杂质不参加反应。
I. 将铁矿石粉碎,取mg铁矿石粉于烧杯中,加入浓盐酸,加热使其充分溶解;
Ⅱ. 冷却后过滤、洗涤,将滤液和洗涤液转移到250mL仪器a中定容;
Ⅲ. 移取25mL溶液于锥形瓶中,加入4mol·L-1盐酸,加热至接近沸腾,边摇动锥形瓶边缓慢滴加一定浓度的SnCl2溶液,至恰好完全反应,停止滴加SnCl2溶液;
Ⅳ. 冷却后加入50mL蒸馏水和指示剂,用cmol·L-1 K2Cr2O7溶液滴定至终点;
V. 重复测定三次,消耗K2Cr2O7溶液的平均体积为v mL。
(1)I中,加快化学反应速率的措施有________(至少写出2个)。
(2)Ⅱ中,仪器a的名称是________。
(3)III中,Sn2+还原Fe3+的离子方程式是________。
(4)该铁矿石中铁元素的质量分数为________。
(5)Ⅲ中,若SnCl2过量,测得的铁矿石中铁元素的质量分数会________(填“偏大“、“偏小“或“不变“)。
16. (12分)
石油天然气开采和炼制过程中会产生大量含硫废水(其中S元素的主要化合价是-2价),对设备、环境等造成严重危害。
已知:H2S有剧毒;常温下溶解度为1:2.6(体积)。
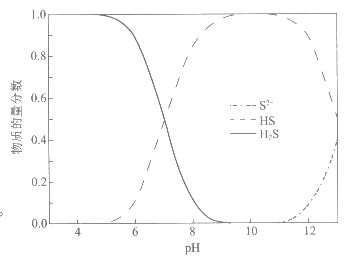
(1)H2S、HS–、S2-在水溶液中的物质的量分数随pH的分布曲线如下图。当pH≈8时,含硫废水中最主要的含硫(-2价)微粒是_______。
(2)沉淀法处理含硫废水:
向pH≈8的含硫废水中加入适量Cu2+的溶液,产生黑色沉淀且溶液的pH降低。用化学平衡移动的原理解释溶液的pH降低的原因:________。
(3)氧化还原法处理含硫废水:
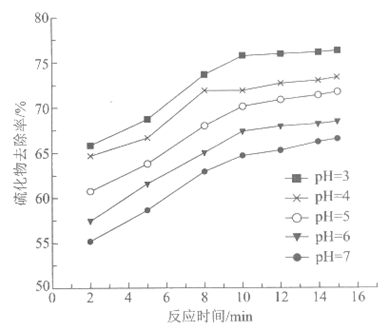
向pH≈8的含硫废水中加入一定浓度的Na2SO3溶液,加酸将溶液调为pH=5,产生淡黄色沉淀。
①反应的离子方程式是________。
②不同pH时,硫化物去除率随时间的变化曲线如下图。本工艺选择控制体系的pH=5,不选择pH<5,从环境保护的角度分析其主要原因:_________。
(4)电浮选絮凝法处理含硫废水:
铝作阳极、石墨作阴极,以直流电电解含一定浓度Na2SO4的pH≈8的含硫废水。阳极产生微小气泡,随后溶液中产生淡黄色浑浊,阳极附近生成的胶体吸附淡黄色浑浊。
- 用离子方程式表述产生淡黄色浑浊的可能原因:_______(1种即可)。
②阴极产生的气泡把污水中的悬浮物(含阳极扩散的胶体)带到水面形成浮渣层,结合电极反应式解释胶体和浮渣层的形成过程:_______。
17. (12分)
某钴矿石的主要成分有CoO、Co2O3、MnO、Fe2O3、MgO和SiO2等。由该矿石粉制备CoC2O4固体的方法如下(部分催化剂已略)。
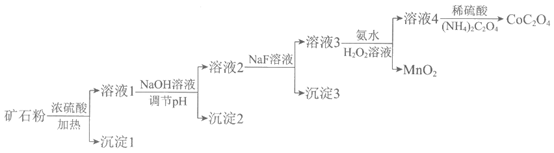
已知:金属离子沉淀的pH:
Fe3+ | Fe2+ | Mg2+ | Mn2+ | Co2+ | |
开始沉淀时 | 1.5 | 6.3 | 8.9 | 8.2 | 7.4 |
完全沉淀时 | 2.8 | 8.3 | 10.9 | 10.2 | 9.4 |
(1)Co2O3溶于浓硫酸,生成Co2+和一种可使带火星的木条复燃的气体,该气体是_______。
(2)向溶液1中加入NaOH溶液,将Fe3+转化为Fe(OH)3沉淀,应调节pH至少大于________。
(3)向溶液2中加入NaF溶液,去除的离子是________。
(4)向溶液3中加入氨水和过氧化氢溶液,将Co2+转化为Co(NH3)63+。
补充完整下列离子方程式:
____Co2++____H2O2+____ NH3——____ Co(NH3)63++____
(5)溶液4中,若将1 mol Co(NH3)63+全部转化为CoC2O4沉淀,需要消耗(NH4)2C2O4____ mol。
(6)关于上述流程,下列说法正确的是____(填序号)。
a. 若矿石粉中存在少量FeO,经上述流程也可制得纯度相同的CoC2O4
b. 向溶液3中加入氨水,作用仅是调节溶液的pH
c. 流程中,仅通过调节溶液的pH无法将金属元素完全分离
18. (12分)
他米巴罗汀是治疗急性髓性白血病的药物,其合成路线如下:
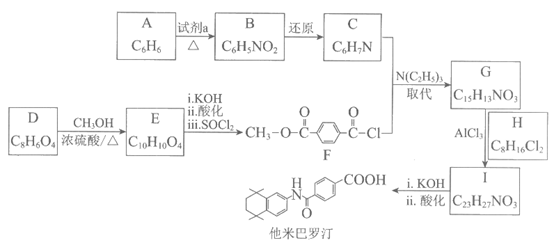
已知: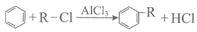
(1)A是芳香烃,试剂a是________。
(2)C中含氮的官能团是________。
(3)D→E为酯化反应,化学方程式是________。
(4)C和F反应得到G为可逆反应,推测N(C2H5)3(一种有机碱)的作用是________。
(5)I的结构简式是________。
(6)H是制他米巴罗汀的重要中间体,以C2H2为原料合成H的路线如下:
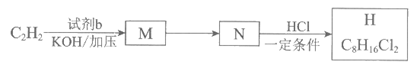
已知:
①试剂b的结构简式是________。
②N→H的化学方程式是________。
19. (12分)
某同学研究浓硝酸与KSCN溶液的反应。
资料:I:SCN–中S、C、N元素的化合价依次为:-2价、+4价、-3价。
Ⅱ. SCN–的性质类似卤素离子,能被氧化为黄色的(SCN)2,(SCN)2可聚合为红色的(SCN)x。
Ⅲ. NO2可溶于浓硝酸。
实验一:
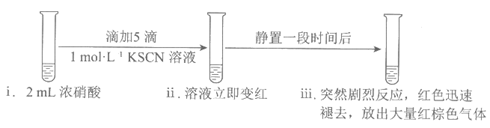
(1)向浓硝酸中滴加KSCN溶液,溶液立即变红是因为生成了______(填化学式)。
(2)研究SCN–的转化产物。
实验二:
a. 将实验一iii中的气体通入Ba(OH)2和NaOH的混合溶液中,有白色沉淀生成。
b. 过滤、洗涤白色沉淀,取少量于试管中,加入过量的稀硝酸,沉淀完全溶解,再滴加少量KMnO4溶液,不褪色。
c. 另取少量实验一iii中试管内的溶液加入BaCl2溶液,产生大量白色沉淀。
①通过b证实了红棕色气体中不含SO2,证据是______。
②a中,Ba(OH)2溶液中加入NaOH溶液以增大OH–浓度的目的是______。
③由上述实验现象可知:SCN–转化的最终产物中一定有______。
(3)继续研究实验一iii中“静置一段时间后,突然剧烈反应,红色迅速褪去“的原因。
实验三
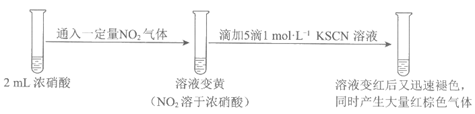
①对比实验一和实验三可得结论:一定浓度的NO2______。
②结合实验三,从化学反应速率的角度解释实验一ii和iii中的现象:______。
参考答案
第一部分
共14小题,每小题3分,共42分。
1. D 2. B 3. A 4. B 5. D 6. B 7. D 8. C 9. D 10. D
11. C 12. A 13. B 14. D
第二部分
共5小题,共58分。
15. (每空2分,共10分)
(1)粉碎、加入浓盐酸、加热
(2)容量瓶
(3)2Fe3++Sn2++6Cl– 2Fe2++SnCl62-
2Fe2++SnCl62-
(4)3.36cv/m×100%
(5)偏大
16. (每空2分,共12分)
(1)HS–
(2)含硫废水中存在HS–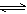 H++S2-,加入适量Cu2+的溶液,S2-+Cu2+=CuS↓,
H++S2-,加入适量Cu2+的溶液,S2-+Cu2+=CuS↓,
c(S2-)减小,使HS–的电离平衡正向移动,c(H+)增大,溶液的pH降低
(3)2HS–+SO32-+4H+=3S↓+3H2O
②pH<5时,溶液中-2价S元素主要以H2S的形式存在,常温下H2S的溶解度为1:2.6,酸性强使H2S更易逸出,H2S有剧毒会污染环境
(4)①2HS–+O2+2H+=2S↓+2H2O(O2+2HS–=2S↓+2OH–)
或HS–-2e–=S↓+H+
②阳极:Al-3e–=Al3+,Al3+形成Al(OH)3胶体,阴极:2H2O+2e–=H2↑+2OH–,H2气泡把污水中吸附了S的Al(OH)3胶体悬浮物带到水面形成浮渣层
17. (每空2分,共12分)
(1)O2 (2)2. 8 (3)Mg2+
(4)2Co2++1H2O2+12NH3=2Co(NH3)63++2OH–
(5)1.5 (6)ac
18. (每空2分,共12分)
(1)浓硝酸、浓硫酸(1分)
(2)氨基(或—NH2)(1分)
(3)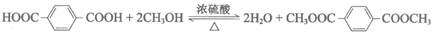
(4)N(C2H5)3能和该反应生成的HCl反应,降低HCl浓度,利于反应正向进行
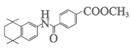
(5)
(6)①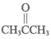
②
19. (每空2分,共12分)
(1)(SCN)x
(2)①向洗净的白色沉淀中加入过量的稀硝酸,沉淀完全溶解,再滴加少量KMnO4溶液,不褪色
②避免混合气体中大量的NO2使溶液呈酸性,干扰检验CO2和SO2
③CO2、SO42-
(3)①能加快浓硝酸氧化(SCN)x的化学反应速率(或能催化浓硝酸氧化(SCN)x)
②实验一中存在反应:a. 浓硝酸氧化SCN–,b. 浓硝酸氧化(SCN)x,化学反应速率:va>vb,所以ii中溶液立即变红;静置过程中,生成的NO2溶于硝酸,浓度积累到一定程度时,使vb增大,红色迅速褪去