本试卷共100分。考试时长90分钟。
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 Cl 35.5 Fe 56
第一部分
本部分共14题,每题3分,共42分。在每题列出的四个选项中,选出最符合题目要求的一项。
1. 下列发电厂(站)的电能由化学能直接转化而成的是
A | B | C | C |
|
|
|
|
燃料电池发电站 | 地热发电厂 | 风力发电厂 | 水力发电站 |
2. 化学与生活息息相关,下列说法不正确的是
A. 淀粉属于多糖
B. 天然药物无毒副作用,可以长期服用
C. 与铜质水龙头连接处的铁质水管更易被腐蚀
D. 医疗垃圾有多种致病微生物,可用高温焚烧处理
3. 下列化学用语正确的是
A. 中子数为18的氯原子: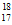 Cl
Cl
B. CO2分子的电子式: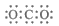
C. 顺-2-丁烯的结构简式: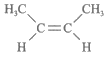
D. Al3+的结构示意图:
4. 下图为甲烷燃料电池的装置示意图,下列说法正确的是
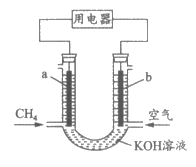
A. a极为正极
B. K+由a极向b极迁移
C. 工作一段时间后,b极附近的pH会减小
D. a极的电极反应为CH4+6OH--8e-=CO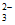 +5H2O
+5H2O
5. 下列化学用语对事实的表述不正确的是
A. 工业上用乙醛催化氧化法制乙酸:2CH3CHO+O2 2CH3COOH
2CH3COOH
B. 向AgNO3溶液中加入过量氨水:Ag++NH3·H2O=AgOH↓+NH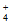
C. 用Na2S除去工业废水中的Hg2+:Hg2++S2-=HgS↓
D. 电镀铜的阴极反应:Cu2++2e-=Cu
6. 2Na2S2O3+I2=2NaI+Na2S4O6是定量分析中的常用反应。下列说法不正确的是
A. 反应中,I2表现了氧化性
B. 反应中,每生成1 molNa2S4O6,有4mol e-发生转移
C. Na2S2O3是含有共价键的离子化合物
D. Na2S2O3在空气中放置会变质,产物可能有Na2SO4
7. 短周期主族元素X、Y、Z、W的原子序数依次增大,X是地壳中含量最多的元素,Y的原子最外层只有1个电子,Z的单质晶体是应用最广泛的半导体材料。下列说法正确的是
A. 原子半径: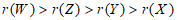
B. Z的非金属性比X的强
C. 由X、Y组成的化合物中可能含有共价键
D. Z的最高价氧化物对应的水化物的酸性比W的强
8. 常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 由水电离的c(H+)=10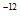 mol/L的溶液中:Na+、NH
mol/L的溶液中:Na+、NH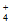 、Cl-、K+
、Cl-、K+
B. 无色溶液中:Na+、K+、Cr2O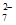 、NO
、NO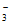
C. 含有I-的溶液中:H+、Na+、Cl-、NO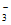
D. pH=14的溶液中:K+、ClO-、CO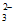 、Cl-
、Cl-
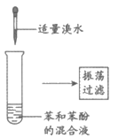
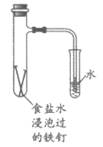
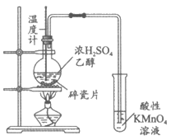
9. 下列实验能达成相应目的的是
|
|
|
|
A. 除去苯中少量苯酚 | B. 验证铁钉能发生析氢腐蚀 | C. 检验乙醇消去反应产物中的乙烯 | D. 研究温度对化学平衡的影响 |
10. PCT树脂是一种应用广泛的高聚物,其结构简式为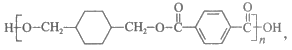 它可由有机物
它可由有机物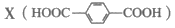 与另一种有机物Y反应制得。下列说法不正确的是
与另一种有机物Y反应制得。下列说法不正确的是
A. X可与H2发生加成反应生成Y B. Y的核磁共振氢谱有4组峰
C. X、Y生成PCT的反应属于缩聚反应 D. PCT制品应避免长时间与碱性物质接触
11. 常温下,向20mL 0.1mol/L的某一元酸(HA)溶液中加入几滴酚酞溶液,再逐滴滴加0.1 mol/L NaOH溶液,测得滴定曲线如图。下列说法不正确的是
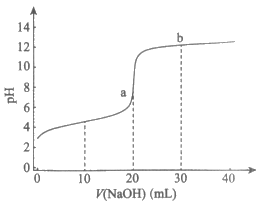
A. V(NaOH)=10mL时,c(HA)>c(A一)
B. pH=7时,V(NaOH)<20mL
C. 滴定终点时,溶液由无色变为浅红色
D. a点的水的电离程度大于b点的水的电离程度
12. 近期,天津大学化学团队以CO2和辛胺为原料实现了甲酸和辛腈的高选择性合成,装置工作原理如图。下列说法正确的是
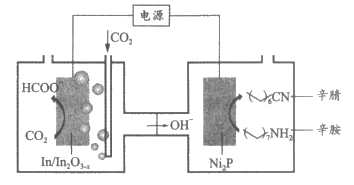
A. Ni2P电极与电源负极相连
B. 辛胺转化为辛腈发生了还原反应
C. In/In2O3-x电极上可能有副产物H2生成
D. 在In/In2O3-x电极上发生的反应为CO2+H2O-2e-=HCOO-+OH-
13. 某种含二价铜微粒[CuII(OH)(NH3)]+的催化剂可用于汽车尾气脱硝,催化机理如图1,反应历程中不同态物质体系所含的能量如图2。下列说法不正确的是
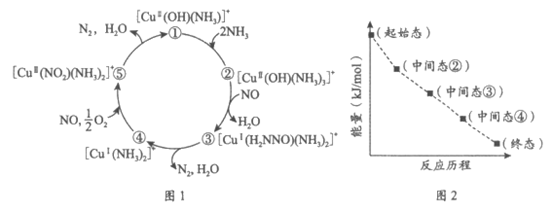
A. 总反应的焓变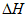 <0
<0
B. 状态②到状态③发生的是氧化还原反应
C. 状态③到状态④的变化过程中有O—H键的形成
D. 总反应的化学方程式为8NH3+2NO+5O2=12H2O+5N2
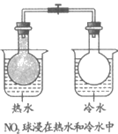
14. 某小组同学探究金属Na、Mg与酸的反应速率,进行下列实验。
实验装置 | 序号 | 实验操作 | 实验现象 |
| 实验1 | 取下胶塞,放入一小片金属Na,迅速塞上胶塞 | 钠浮在液面上并来回移动,表面出现白色固体;白色固体逐渐沉到烧杯底部,液体不沸腾;气球迅速鼓起,15 s时测量气球直径约为3 cm |
实验2 | 取下胶塞,放入与钠表面积基本相同的镁条,迅速塞上胶塞 | 镁条开始时下沉,很快上浮至液面,片刻后液体呈沸腾状,同时产生大量白雾;气球迅速鼓起,15 s时测量气球直径约为5 cm |
下列说法不正确的是
A. 上述实验不能说明Na比Mg的金属性强
B. 上述实验能说明相同温度下,金属Na与酸的反应速率比金属Mg与酸的慢
C. 金属Na、Mg与盐酸的反应速率与反应物的接触面积等因素有关
D. 向实验1所得溶液中通入HCl气体,会继续析出白色沉淀
第二部分
本部分共5题,共58分。
15. (11分)丁烯(C4H8)是重要的化工原料,可由丁烷(C4H10)催化脱氢制备,反应如下:
CH3CH2CH2CH3g(g)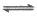 CH2=CHCH2CH3(g)+H2(g)
CH2=CHCH2CH3(g)+H2(g)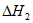
已知:
i. 该工艺过程的副产物有炭(C),生成的积碳会附着在催化剂表面,影响催化剂活性。
ii. 温度过高会引发正丁烷裂解生成低碳烃类的副反应。
iii. H2(g)+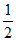 O2(g)=H2O(1)
O2(g)=H2O(1)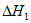
CH3CH2CH2CH3(g)+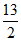 O2(g)=4CO2(g)+5H2O(1)
O2(g)=4CO2(g)+5H2O(1)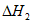
CH2=CHCH2CH3(g)+6O2(g)=4CO2(g)+4H2O(1)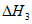
(1)用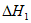 、
、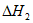 、
、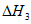 表示丁烷催化脱氢反应的焓变
表示丁烷催化脱氢反应的焓变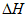 =____________。
=____________。
(2)寻找高效催化剂是脱氢反应重要的研究课题之一。
①催化剂使用一段时间后活性会下降,通入适量氢气可使其改善,氢气的作用是______________。
②其他条件相同时,以SiO2为载体与不同质量分数的CrOx组合,催化效果相关数据如下表。
实验组 | 催化剂组成 | 正丁烷转化率/% | 正丁烯收率/% |
1 | 无催化剂 | 5 | 0.35 |
2 | SiO2 | 5 | 0.35 |
3 | SiO2+9%CrOx | 25.5 | 18.3 |
4 | SiO2+15%CrOx | 27.5 | 20.65 |
5 | SiO2+21% CrOx | 24 | 17.87 |
下列说法正确的是____________(填序号)。
a. 脱氢反应中SiO2不起催化作用
b. CrOx的含量越高,反应的催化效果越好
c. CrOx的含量对丁烷脱氢反应的焓变无影响
(3)其他条件相同,30 min时测得正丁烷转化率、正丁烯收率随温度的变化如图1。
[收率=(生成某产物的原料量/投入的原料量)×100%]
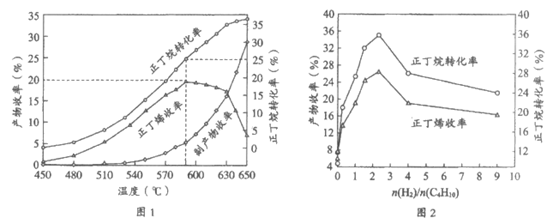
①实际生产的温度选择590℃,由图1说明其依据是______________。
②590℃时,向体积为1L的密闭容器中充入3mol正丁烷气体,据图1计算0~30min内生成正丁烯的平均反应速率为_____________mol/(L·min)。
(4)其他条件相同,30 min时测得正丁烷转化率、正丁烯收率随进料气中n(H2)/n(C4H10)的变化如图2。图2中,n(H2)/n(C4H10)>2.5后,正丁烷转化率和正丁烯收率呈减小趋势,可能的原因是________________。
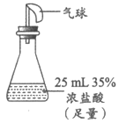
16. (10分)汽车尾气中的氮氧化物(NOx)对环境有危害,可利用化学方法实现氮的转化,从而降低氮氧化物排放。
(1)CO、HC(碳氢化合物)和NH3等均可在催化剂作用下,将NOx转化为N2。
①CO在氮的转化过程中体现了_________性。
②NH3和NO反应的化学方程式为_____________________。
(2)利用电解装置可以将尾气中的NO转化为尿素[CO(NH2)2,其中碳的化合价为+4价,属于非电解质],工作原理如图。
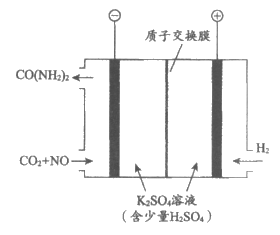
①阴极的电极反应式为______________。
②反应一段时间后,阳极区的pH基本不变,结合化学用语解释原因:___________________。
③用NO 代替NO进行电化学反应,研究表明阴极反应的历程如下:
代替NO进行电化学反应,研究表明阴极反应的历程如下:
Ⅰ. CO2+2H++2e-=CO(pre)+H2O
Ⅱ. ……
Ⅲ. CO(pre)+2NH2(pre)=CO(NH2)2
其中,CO(pre)表示CO前体,NH2(pre)表示NH2前体。用化学用语表示步骤Ⅱ的反应:_________________。
17. (12分)苯巴比妥是一种巴比妥类的镇静剂及安眠药,其合成路线如下图(部分试剂和产物略)。
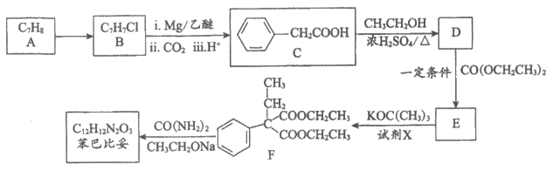
已知:
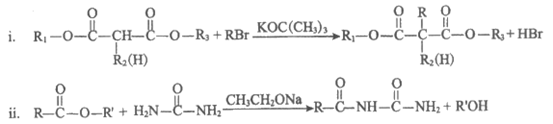
(1)A→B的反应类型为________________反应。
(2)C→D的化学方程式为________________。
(3)试剂X为________________(写结构简式)。
(4)E中所含官能团的名称为________________。
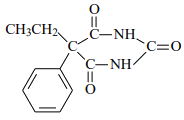
(5)已知苯巴比妥的分子结构中含有2个六元环,其结构简式为________________。
(6)符合下列条件的D的同分异构体共有____________种(不考虑立体异构)。
①属于芳香族化合物;②能发生水解反应;
③能发生银镜反应;
④苯环上只有一个取代基。
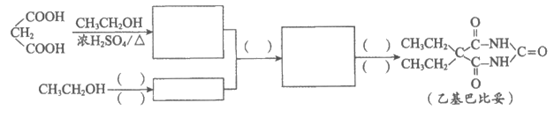
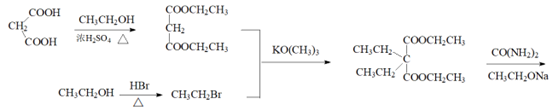
(7)乙基巴比妥也是一种常用镇静剂,可用CH3CH2OH和CH2(COOH)2等为原料合成,将合成路线补充完整:
18. (13分)聚合硫酸铁(PFS)是一种性能优异的无机高分子絮凝剂,其化学式通常表示为[Fe2(OH)2a(SO4)3-a]b。某化工厂制备PFS并用其处理废水。
Ⅰ. 用硫酸铜废液制备PFS
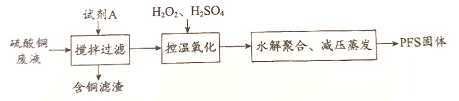
(1)试剂A为________________。
(2)”控温氧化”时发生反应的离子方程式为________________。
(3)测定PFS样品中的,n(OH-):取ag样品,溶解于V1 mL c1 mol/L HCl溶液中,用KF溶液掩蔽F3+(使Fe3+不能与OH-反应),滴入酚酞溶液,再用c2 mol/L NaOH溶液滴定,到达滴定终点时消耗NaOH溶液体积为V2mL。agPFS样品中的n(OH-)=______mol。
Ⅱ. 用石灰乳-PFS法处理酸性含砷废水
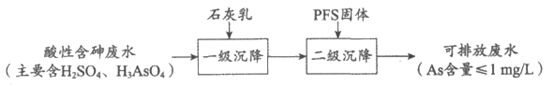
已知:
i. 常温下,Ca3(AsO4)2、CaHAsO4的Ksp均大于FeAsO4的Ksp,Fe2(HAsO4)3可溶;
ii. 常温下,溶液中含砷微粒的物质的量分数与pH的关系如图。
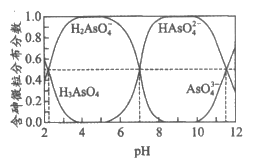
(4)下列说法不正确的是__________(填序号)。
a. NaH2AsO4溶液的pH<7
b. pH=11.5时,c(H2AsO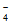 )+2c(HAsO
)+2c(HAsO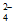 )+3c(AsO
)+3c(AsO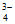 )+c(OH-)=c(H+)
)+c(OH-)=c(H+)
c. Na3AsO4溶液中,3c(Na+)=c(AsO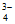 )+c(HAsO
)+c(HAsO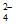 )+c(H2AsO
)+c(H2AsO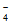 )+c(H3AsO4)
)+c(H3AsO4)
(5)”一级沉降”中,石灰乳的作用是________________。
(6)”二级沉降”中,溶液的pH在8~10之间,PFS形成的Fe(OH)3胶体粒子可通过沉淀反应进一步减少溶液中的As含量,反应的离子方程式为________________。
(7)溶液的pH和m(Fe)/m(As)对As去除率的影响如图。若某酸性含砷废水中As含量为20 mg/L,为达到排放标准(As含量≤1mg/L),从节约成本的角度考虑,工业上选择的最佳条件是___________(填序号)。
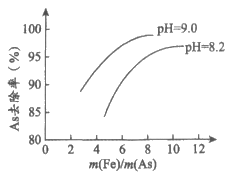
a. pH=8.2 m(Fe)/m(As)=5 b. pH=8.2 m(Fe)/m(As)=8
c. pH=9.0 m(Fe)/m(As)=5 d. pH=9.0 m(Fe)/m(As)=8
[注:m(Fe)/m(As)指PFS中Fe元素质量与对应废水中As元素质量之比]
19. (12分)实验小组探究酸对Fe3++3SCN-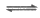 Fe(SCN)3平衡的影响。将0. 005 mol/L FeCl3溶液和0.01 mol/L KSCN溶液等体积混合,得到红色溶液。
Fe(SCN)3平衡的影响。将0. 005 mol/L FeCl3溶液和0.01 mol/L KSCN溶液等体积混合,得到红色溶液。
(1)FeCl3水解显酸性的原因是________________(用离子方程式表示)。
(2)甲同学认为加入酸后,会使Fe3++3SCN-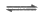 Fe(SCN)3体系中__________增大,导致该平衡正向移动,溶液颜色加深。
Fe(SCN)3体系中__________增大,导致该平衡正向移动,溶液颜色加深。
【设计并实施实验】
取两等份红色溶液,进行实验并记录现象。
【查阅资料】
Fe3+与Cl-、SO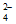 均能发生络合反应:
均能发生络合反应:
Fe3++4Cl-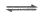 [FeCl4]-(黄色);Fe3++2SO
[FeCl4]-(黄色);Fe3++2SO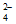
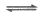 [Fe(SO4)2]-(无色)。
[Fe(SO4)2]-(无色)。
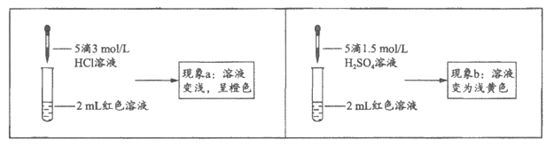
实验Ⅰ. 探究现象a中溶液颜色变化的原因
编号 | 操作 | 现象 |
① | 向2 mL红色溶液中滴加5滴水 | 溶液颜色无明显变化 |
② | 向2mL红色溶液中滴加5滴3 mol/L KCl溶液 | 溶液颜色变浅,呈橙色 |
(3)实验①的目的是________________。
(4)根据实验①和实验②的结果,从平衡移动角度解释现象a:________________。
实验Ⅱ. 探究现象b中溶液呈浅黄色的原因
编号 | 操作 | 现象 |
③ | 取1 mL 0.0025 mol/L Fe2(SO4)3溶液(无色),加入1 mL 0.01 mol/L KSCN溶液,再加入5滴1.5mol/L H2SO4溶液 | 溶液先变红,加硫酸后变为浅黄色 |
④ | 取1 mL0.005 mol/L FeCl3溶液,____________ | _____________ |
(5)结合实验③可推测现象b中使溶液呈浅黄色的微粒可能有两种,分别是________________。
(6)乙同学进一步补充了实验④,确证了现象b中使溶液呈浅黄色的微粒只是(5)中的一种,将实验④的操作及现象补充完整:________________。
【试题答案】
第一部分
选择题
(每小题只有1个选项符合题意,共14个小题,每小题3分,共42分)
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
答案 | A | B | C | B | B | B | C |
题号 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
答案 | D | D | A | A | C | D | B |
第二部分
非选择题(共58分)
评阅非选择题时请注意:
·若无特别说明,每空2分。
·
文字表述题中其他答案合理也给分。
·
方程式中的产物漏写”↑”或”↓”不扣分;化学专用词汇若出现错别字为0分。
15. (11分)
(1)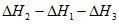
(2)①H2可以除去积炭,提高催化剂活性(1分)
②ac
(3)①图1中590℃时正丁烯收率最高,副产物收率较低
②0.02
(4)答案一:H2含量过高,导致主反应CH3CH2CH2CH3(g)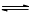 CH2=CHCH2CH3(g)+H2(g)的化学平衡逆向移动
CH2=CHCH2CH3(g)+H2(g)的化学平衡逆向移动
答案二:H2含量过高,不利于反应物与催化剂充分接触,导致反应速率下降
16. (10分)
(1)①还原
②4NH3+6NO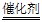 5N2+6H2O
5N2+6H2O
(2)①CO2+2NO+10H++10e-=CO(NH2)2+3H2O
②阳极发生反应:H2-2e-=2H+,根据闭合回路中电量守恒,同时会有等量的H+通过质子交换膜从阳极区进入阴极区,因此,阳极区的pH基本不变。
③2NO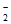 +12H++10e-=2NH2(pre)+4H2O
+12H++10e-=2NH2(pre)+4H2O
17. (12分)
(1)(1分)取代
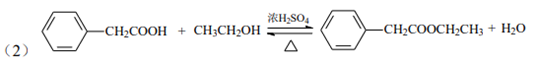
(3)(1分)CH3CH2Br
(4)(1分)酯基
(5)
(6)5
(7)(3分)
18.(13分)
(1)(1分)Fe
(2)2Fe2++H2O2+2H+=2Fe3++2H2O
(3)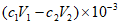
(4)bc
(5)中和酸性溶液,调节溶液pH;形成CaSO4、Ca3(AsO4)2沉淀,去除部分SO4 和H3AsO4
和H3AsO4
(6)Fe(OH)3+HAsO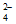 =FeAsO4+2OH-+H2O
=FeAsO4+2OH-+H2O
(7)c
19.(12分)
(1)Fe3++3H2O 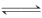 Fe(OH)3+3H+
Fe(OH)3+3H+
(2)c(Fe3+)
(3)排除稀释使溶液颜色变化的干扰(证明溶液颜色变化是否与稀释有关)
(4)在Fe3++3SCN-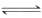 Fe(SCN)3平衡体系中加入盐酸,Fe3+和Cl-发生络合反应使得c(Fe3+)减小,平衡逆向移动,c[Fe(SCN)3]减小,使溶液颜色变浅呈橙色。(多答c[FeCl
Fe(SCN)3平衡体系中加入盐酸,Fe3+和Cl-发生络合反应使得c(Fe3+)减小,平衡逆向移动,c[Fe(SCN)3]减小,使溶液颜色变浅呈橙色。(多答c[FeCl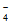 ]变大,不扣分)
]变大,不扣分)
(5)FeCl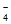 和Fe(SCN)3
和Fe(SCN)3
(6)加入1mL蒸馏水,再加入5滴1.5mol/LH2SO4溶液;无明显现象