本试卷共两部分,39道小题,满分70分。考试时间70分钟。
相对原子质量:H 1 C 12 N 14 O 16 Na 23 Si 28
第一部分
选择题(共25分)
(每小题只有1个选项符合题意。共25个小题,每小题1分)
1. 空气成分中,体积分数约占78%的是
A. 氮气 B. 氧气 C. 二氧化碳 D. 稀有气体
2. 下列元素中,属于金属元素的是
A. 氖 B. 氧 C. 锌 D. 磷
3. 下列物质属于氧化物的是
A. O2 B. H2O C. NaCl D. H2SO4
4. 下列物质在氧气中燃烧,火星四射、生成黑色固体的是
A. 木炭 B. 铁丝 C. 酒精 D. 红磷
5. 下列物质放入水中,能形成溶液的是
A. 牛奶 B. 面粉 C. 花生油 D. 蔗糖
6. 下列金属中,金属活动性最强的是
A. 镁 B. 铜 C. 铁 D. 银
7. 热干面是武汉的传统小吃。下列制作热干面的主要操作中,属于过滤的是
A. 调酱 | B. 煮面 | C. 捞面 | D. 拌面 |
|
|
|
|
8. 氢元素与氧元素的本质区别是
A. 质子数不同 B. 电子数不同
C. 中子数不同 D. 最外层电子数不同
9. 下列做法不利于保护环境的是
A. 将垃圾分类投放 B. 出行乘坐公共交通工具
C. 随意丢弃废旧电池 D. 无纸化办公
10. 下列符号中,表示2个氢原子的是
A. H2 B. 2H C. 2H+ D. 2H2
11. 下图所示的化学实验基本操作中,正确的是
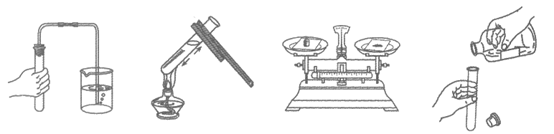
A. 检查气密性 B. 加热液体 C. 称量固体 D. 倾倒液体
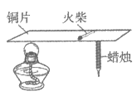
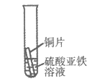
12. 下列措施中,不能防止铁制品锈蚀的是
A. 涂油 B. 镀一层耐腐蚀的金属
C. 制成不锈钢 D. 存放在潮湿的空气中
13. 下列说法不正确的是
A. 水是常见的溶剂
B. 溶液一定是无色的
C. 溶质在溶解的过程中,有的放出热量,有的吸收热量
D. 洗涤剂能使植物油在水中分散成无数细小的液滴,这种现象称为乳化
14. 下图是电解水的实验装置。下列说法中,正确的是
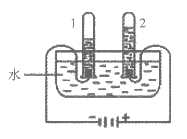
A. 电解水的化学方程式为2H2O=H2↑+O2↑
B. 实验说明水是由氢气和氧气组成的
C. 试管2内产生的气体能使带火星木条复燃
D. 试管1、2中产生气体的质量比为1:2
15. 下列物质的化学式中,书写正确的是
A. 氮气N2 B. 五氧化二磷O5P2
C. 氧化镁MgO2 D. 氢氧化钙CaOH
16. 下列说法不正确的是
A. 燃放烟花爆竹时,远离人群和可燃物
B. 点燃氢气前,先进行验纯
C. 闻气体时用手轻轻扇动,使少量气体飘进鼻孔
D. 正在使用的家用电器着火,立即用水浇灭
17. 次氯酸钠(NaClO)是“84消毒液“的有效成分,其中氯元素的化合价为
A. +5 B. +3 C. +1 D. -1
18. 下图是元素周期表中硫元素的信息示意图,对图中信息解释不正确的是
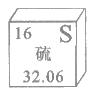
A. 质子数为16 B. 元素符号为S
C. 核外电子数为16 D. 相对原子质量为32.06g
19. 下列物质性质的表述中,属于化学性质的是
A. 碳酸易分解 B. 铝呈银白色
C. 氢气难溶于水 D. 氧气无色无味
20. 固体碘受热升华,下列关于此过程的说法正确的是
A. 碘分子质量变大 B. 碘分子间的间隔变大
C. 碘分子体积变大 D. 碘分子运动速率不变
21. 实验室用过氧化氢溶液制取氧气2H2O2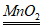 =2H2O+O2↑,关于该反应说法错误的是
=2H2O+O2↑,关于该反应说法错误的是
A. MnO2为催化剂 B. 属于分解反应
C. 反应前后分子种类不变 D. 反应前后原子种类不变
22. 下列实验目的所对应的实验操作中,不正确的是
选项 | 实验目的 | 实验操作 |
A | 鉴别硬水和软水 | 加入肥皂水 |
B | 鉴别O2和CO2 | 伸入燃着的木条 |
C | 除去Cu粉中的Fe粉 | 加足量稀盐酸,过滤 |
D | 除去CO2中的CO | 通入足量澄清石灰水 |
23. 用下图装置进行实验,下列说法不正确的是
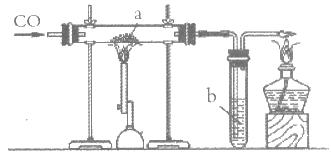
A. a处红棕色粉末变为黑色
B. a处的反应为CO+Fe2O3=2Fe+CO2
C. b处澄清石灰水变浑浊证明有CO2生成
D. 可利用点燃的方法进行尾气处理
24. 在一定条件下,甲和乙反应生成丙和丁。下列说法不正确的是
物质 | 甲 | 乙 | 丙 | 丁 |
|
微观示意图 |
|
|
|
|
A. 甲中碳、氢原子个数比为1:4
B. 乙物质的化学式为H2O
C. 丙的相对分子质量为28
D. 反应生成丙与丁的分子个数比为1:1
25. KCl的溶解度如下表所示,下列说法不正确的是
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 |
溶解度/g | 31.2 | 34.2 | 37.2 | 40.1 | 42.6 | 45.8 |
A. 10℃时,100g水里最多能溶解31.2gKCl
B. 20℃时,向100g水中加入40g KCl,充分搅拌,所得溶液质量为140g
C. 通过升高温度,能将30℃时恰好饱和的KCl溶液转化为不饱和溶液
D. 50℃时,饱和KCl溶液中溶质的质量分数为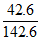 ×100%
×100%
第二部分
非选择题(共45分)
【生活现象解释】
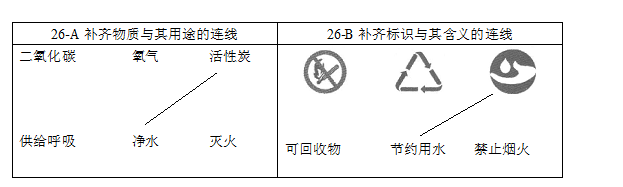
26. (1分)请从26-A或26-B两题中任选一个作答,若两题均作答,按26-A计分。
27. (2分)2020年11月24日,嫦娥五号成功发射,将实现中国首次月球无人采样返回,标志着中国航天又取得重大突破。高致密碳化硅(SiC)特种陶瓷常用作月基光学望远镜的主要材料。
(1)SiC属于__________(填字母序号)。
A. 单质 B. 化合物 C. 纯净物 D. 混合物
(2)SiC中硅元素与碳元素的质量比为__________。
28. (2分)目前使用的燃料大多来自化石燃料。
(1)化石燃料包括天然气、石油、__________。
(2)天然气的主要成分是甲烷(CH4),甲烷燃烧的化学方程式为__________。
【科普阅读理解】
29. (5分)阅读下面的科普短文。
硒(Se)是人体内重要的微量元素之一,在抗氧化、延缓机体衰老等方面发挥重要作用。
含硒丰富的食物有水产品、动物内脏、蘑菇、富硒大米、白菜心等。摄入硒过少可能会导致克山病的发生,而过高会引起中毒,导致腹泻、失明、脱发、甚至死亡。
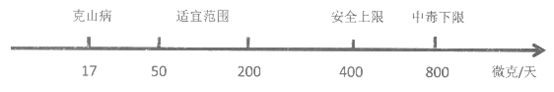
图1 成年人每日硒摄入量与人体健康
人体中硒主要通过土壤–植物–机体食物链摄入。我国土壤中硒含量严重不均衡,因此国内对富硒食品进行了许多开发与研究。施用含硒肥料,可提高植物中硒的含量。
食物中硒主要以硒酸钠(Na2SeO4)、亚硒酸钠Na2SeO3)、植物活性硒形式存在。硒含量的检测可采取荧光光谱法,在相同条件下,将待测液荧光强度与标准曲线(图2)对比,即可快速获取结果。将10g某富硒大米、河虾样品分别制成1L待测液,进行5次实验,测得数据如下(见图3)。
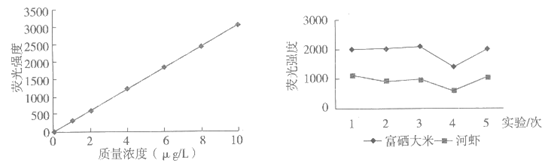
图2 硒质量浓度–荧光强度标准曲线
图3
依据文章内容回答下列问题。
(1)富硒食品中“硒“指的是________(填“元素“或“单质“)。
(2)含硒较为丰富的食物有________(写出一种即可)。
(3)亚硒酸钠(Na2SeO3)由________种元素组成。
(4)图3测定的数据中,第________次实验可能存在较大误差。
(5)下列说法中正确的是________(填字母序号)。
A. 每日摄入“硒“越多,越有利于人体健康
B. 施用含硒肥料,可使植物中的硒含量增加
C. 实验测定的富硒大米硒含量比河虾的高
D. 实验测定的河虾待测液中硒含量大约为3μg/L
【生产实际分析】
30. (3分)某厂排放的废水中含有硫酸铜,将废水处理可得到铜和氧化铁两种产品,过程如下图所示(废水中的其他物质不参与反应):
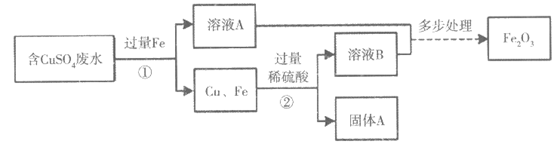
(1)过程①中发生反应的化学方程式为_________。
(2)固体A的成分为_________。
(3)过程①和过程②都需要用到的操作是_________。
31. (4分)利用玉米可生产乙醇(C2H5OH),主要流程如下图所示:
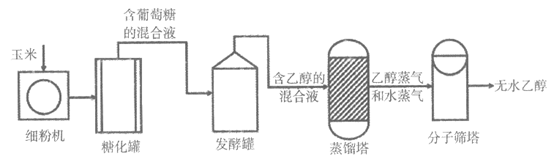
(1)细粉机粉碎玉米的目的是_________。
(2)发酵罐中,葡萄糖(C6H12O6)在酒化酶的催化作用下发生分解反应的化学方程式为:C6H12O6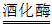 2C2H5OH+2X↑,则X的化学式为_________。
2C2H5OH+2X↑,则X的化学式为_________。
(3)蒸馏塔中发生的是_________(填“物理“或“化学“)变化。
(4)分子筛塔的作用是_________。
【基本实验及其原理分析】
32. (4分)用下图装置进行实验。
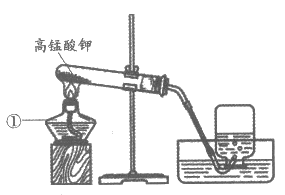
(1)图中仪器①的名称是_________。
(2)高锰酸钾制取氧气的化学方程式为_________。
(3)可以用排水法收集氧气的原因是_________。
(4)用该装置制取氧气,当气体收集完成后,应_________(填字母序号)。
A. 先把导气管移出水面,再熄灭酒精灯
B. 先熄灭酒精灯,再把导气管移出水面
33. (3分)补全实验报告。
目的 | 操作或装置 | 现象 | 结论 |
(1)________ |
| 黄铜能在铜片表面刻画出明显痕迹 | 黄铜的硬度比纯铜的大 |
探究金属铜的导热性 |
| (2)________ | 铜有导热性 |
比较铁和铜的金属活动性 |
| 无明显现象 | (3)________ |
34. (3分)利用下图装置制取二氧化碳(实验前打开K)。
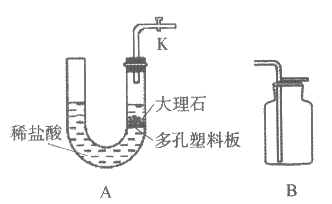
(1)A装置中生成二氧化碳的化学方程式为________。
(2)用B装置收集二氧化碳,验满的操作是________。
(3)若需要停止反应,应进行的操作是________。
35. (2分)为研究二氧化碳与水的反应,做了如下实验(图中小花用紫色石蕊溶液浸泡并晾干)。
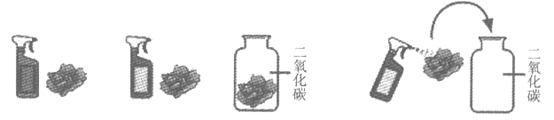
A. 喷稀醋酸 B. 喷水 C. 直接放入CO2中 D. 喷水后放入CO2中
(1)纸花由紫色变为红色的实验是A和________(填字母序号)。
(2)二氧化碳与水反应的化学方程式为________。
36. (3分)从下图选择仪器,配制100g溶质质量分数为10%的NaCl溶液。
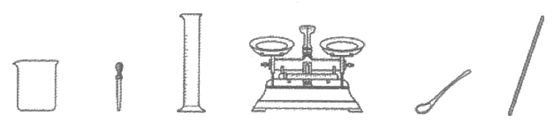
(1)需要称量NaCl的质量为________g。
(2)溶解时用到的仪器有________(写仪器名称)。
(3)配好的溶液中溶质和溶剂的质量比为________。
37. (3分)利用W形玻璃管进行燃烧条件的验证与空气中氧气含量的测定实验。
已知:红磷着火点240℃,白磷着火点40℃
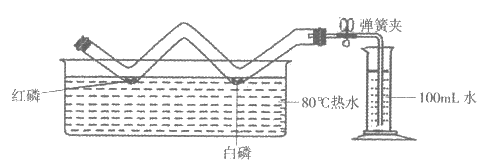
(1)燃烧条件的验证:向W形玻璃管中放入足量红磷和白磷,塞好橡皮塞。然后将其放入80℃的热水中,观察到红磷不燃烧而白磷燃烧,说明可燃物燃烧的条件之一是________。一段时间后白磷熄灭的原因是________。
(2)空气中氧气含量的测定:已知W形玻璃管的容积为200mL,待白磷熄灭,装置冷却至室温后,打开弹簧夹,观察到量筒中的水减少了________mL。
【科学探究】
38.(7分)使燃料充分燃烧是实现“节能减排,低碳生活“的一种重要方法。小组同学探究不同条件下蜡烛燃烧的情况。
【查阅资料】蜡烛燃烧时,生成的CO2与CO的浓度比越大,蜡烛燃烧越充分。
【进行实验】利用下图装置完成实验(所用传感器分别为O2、CO、CO2浓度传感器)。
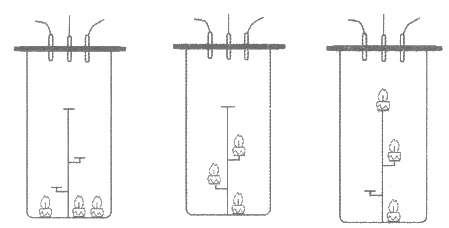
图1 图2 图3
实验 序号 | 容器情况 | 蜡烛位置 | O2起始浓度 | CO2与CO的 浓度比 | 熄灭时O2浓度 |
1 | 敞口 (模拟通风环境) | 如图1 | 21% | 1205.1 | 持续稳定燃烧,保持在20. 4%左右不变 |
2 | 半敞口 (模拟有烟囱的环境) | 如图1 | 21% | 1202.2 | 持续稳定燃烧,保持在20. 3%左右不变 |
3 | 密闭 | 如图1 | 21% | 223.7 | 约16% |
4 | 密闭 | 如图2 | 21% | 255.6 | 约16% |
5 | 密闭 | 如图3 | 21% | 270.6 | 约16% |
6 | 密闭 | 如图3 | 22% | 344.9 | 约16% |
7 | 密闭 | 如图3 | 23% | x | 约16% |
【解释与结论】
(1)蜡烛燃烧时会生成CO2和CO,说明蜡烛中一定含有_______元素。
(2)检验蜡烛燃烧有CO2生成,可在蜡烛火焰上方罩一个内壁涂有_______的烧杯。
(3)对比实验2和3,蜡烛在_______条件下燃烧更充分(填“半敞口“或“密闭“)。
(4)对比实验_______(填实验序号),可得出“其他条件相同时,蜡烛的位置越分散,燃烧越充分“。
(5)实验5、6、7的目的是_______。
(6)x_______344.9(填“>“、“=“或“<“)。
【反思与评价】
(7)综合以上实验分析,下列说法正确的是_______(填字母序号)。
A. 蜡烛燃烧可以消耗尽密闭容器内氧气
B. 蜡烛充分燃烧,可减少污染
C. 实验1中氧气浓度基本不变,是因为分子在不断运动
D. 燃料在氧气浓度较高的富氧空气中燃烧,能起到节能减排的作用
【生产实际定量分析】
39. (3分)叠氮化钠(NaN3)可用作汽车安全气囊的气源,产生气体的原理是:2NaN3+CuO===Na2O+3N2↑+Cu。计算130g NaN3完全反应生成N2的质量。
参考答案
第一部分
选择题
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
答案 | A | C | B | B | D | A | C | A | C | B | A | D | B |
题号 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
答案 | C | A | D | C | D | A | B | C | D | B | D | B |
第二部分
非选择题
26.
27. (1)BC (2)7:3
28.(1)煤
(2)CH4+2O2 2H2O+CO2
2H2O+CO2
29.(1)元素
(2)水产品、动物内脏等
(3)3 (4)4 (5)BCD
30. (1)Fe+CuSO4===Cu+FeSO4
(2)Cu (3)过滤
31.(1)增大固体接触面积,使反应更充分
(2)CO2
(3)物理
(4)除去水蒸气
32.(1)酒精灯
(2)2KMnO4 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
(3)氧气不易溶于水
(4)A
33.(1)比较黄铜和纯铜的硬度
(2)火柴燃烧或蜡烛熔化掉落
(3)铁的金属活动性比铜强
34.(1)CaCO3+2 HCl===CaCl2+H2O+CO2↑
(2)将燃着木条放在集气瓶口
(3)关闭K
35.(1)D (2)CO2+H2O===H2CO3
36.(1)10 (2)烧杯、玻璃棒
(3)1:9
37.(1)温度达到着火点 W形玻璃管内的氧气已被消耗
(2)40
38.(1)碳
(2)澄清石灰水
(3)半敞口
(4)3、4、5
(5)探究蜡烛在O2起始浓度不同的条件下燃烧的情况
(6)> (7) BCD
39. 【解】设:生成N2的质量为x。
2NaN3+CuO===Na2O+3N2↑+Cu
130 84
130g x
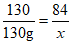
x=84g
答:生成N2的质量为84g。