本试卷有二道大题,考试时长90分钟,满分100分。
一、选择题(1~20题,每题2分,共40分。每小题只有1个选项符合题意)
1.在1L的密闭容器中进行反应A(g)+ 3B (g)
 2C (g),0~2min内A的物质的量由2mol减小到0.8 mol,则用A的浓度变化表示的反应速率[mol/(L·min)]为
2C (g),0~2min内A的物质的量由2mol减小到0.8 mol,则用A的浓度变化表示的反应速率[mol/(L·min)]为
A.1.2 B.1 C.0.6 D.0.4
2.在一定条件下的恒容容器中发生反应:3SiCl4(g)+ 2N2(g)+6H2(g)
 Si3N4(s)+12HCl(g)。不能表示上述反应达到化学平衡状态的是
Si3N4(s)+12HCl(g)。不能表示上述反应达到化学平衡状态的是
A.3v(N2)逆=v(H2)正 B.容器内的压强不变
C.混合气体密度保持不变 D.c(N2):c(H2):c(HCl)=1:3:6
3.H2与N2在催化剂表面生成NH3,反应历程及能量变化示意如下。下列说法不正确的是
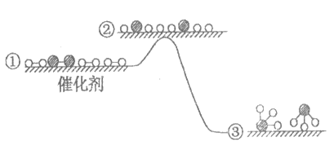
A.①→②吸收能量
B.②→③形成了N-H键
C.该反应为放热反应
D.该催化剂可提高NH3的平衡产率
4.锗(32Ge)与钾(19K)同周期。下列说法正确的是
A.Ge位于第4周期第VA族 B.7032Ge的中子数与电子数的差值为38
C.Ge是一种半导体材料 D.Ge的简化电子排布式为[Ar]4s24p2
5.下列事实不能用平衡移动原理解释的是
|
|
|
|
A.开启啤酒瓶后,瓶中马上泛起大量泡沫 | B.由H2(g)、I2(g)、HI(g)组成的平衡体系加压后颜色变深 | C.将饱和FeCl3溶液滴入沸水中制备Fe(OH)3胶体 | D.石灰岩(主要成分CaCO3)受地下酸性水侵蚀形成溶洞 |
6.下列事实对应的离子方程式不正确的是
A.热的纯碱溶液清洗油污:CO32-+H2O  HCO3–+OH–
HCO3–+OH–
B.0.1mol/L氨水的pH约为11.1: NH3·H2O NH4++OH–
NH4++OH–
C.用醋酸清洗热水壶中的碳酸钙水垢:2H++CaCO3=Ca2++H2O+CO2↑
D.配制AlCl3溶液时需加入盐酸:Al3++3H2O Al(OH)3+3H+
Al(OH)3+3H+
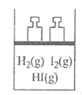
7.某温度下,恒容密闭容器内发生反应:H2 (g) +I2 (g)
 2HI(g) △H<0,该温度下,K=43。某时刻,测得容器内H2、I2、HI的浓度依次为0.01 mol/L、0.01 mol/L、0.02mol/L。一段时间后,下列情况与事实相符的是
2HI(g) △H<0,该温度下,K=43。某时刻,测得容器内H2、I2、HI的浓度依次为0.01 mol/L、0.01 mol/L、0.02mol/L。一段时间后,下列情况与事实相符的是
A.混合气体颜色变深 B.混合气体密度变大
C.氢气的体积分数变小 D.容器内压强变小
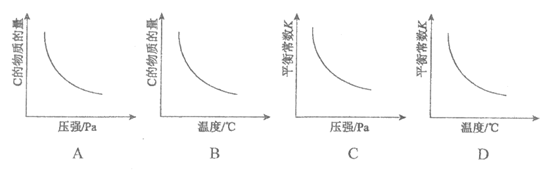
8.对于可逆反应A(g)+B(g)  3C (g) △H>0,以下相关图像正确的是
3C (g) △H>0,以下相关图像正确的是
9.现有四种元素的基态原子的电子排布式如下:①1s22s22p63s23p4
②1s22s22p63s23p3
③1s22s22p3
④1s22s22p5,则下列有关比较中正确的是
A.第一电离能:④>③>②>① B.原子半径:④>③>②>①
C.电负性:④>③>②>① D.最高正化合价:④>③=②>①
10.通过以下反应均可获取H2。
①C(s)+ H2O (g)=CO(g)+H2 (g) △H1=+1313kJ·mol-1
②CH4(g)+ H2O (g)=CO(g)+3H2(g)
△H2=+206.1 kJ·mol-1
③CO(g)+H2O(g)=CO2 (g)+H2 (g) △H3
下列说法正确的是
A.①中反应物的总能量大于生成物的总能量
B.②中使用适当催化剂,可以使△H2减小
C.由①、②计算反应CH4(g)=C(s)+2H2 (g)的△H=-74.8kJ·mol-1
D.若知反应C(s)+CO2 (g)=2CO(g)的△H,结合△H1可计算出△H3
11.某温度下,H2 (g) +CO2 (g)
 H2O (g)+CO(g)的平衡常数
H2O (g)+CO(g)的平衡常数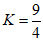 。该温度下,在①、②两个恒容容器中投入H2 (g)和CO2 (g),起始浓度如下表所示。
。该温度下,在①、②两个恒容容器中投入H2 (g)和CO2 (g),起始浓度如下表所示。
下列判断不正确的是
A.反应开始时,反应速率:②>①
B.CO2的平衡转化率:②>①
C.平衡时,①中c(CO2)=0.04 mol·L-1
D.①中H2的平衡转化率为40%
容器 | 起始浓度/mol·L-1 | |
编号 | H2 | CO2 |
① | 0.1 | 0.1 |
② | 0.2 | 0.1 |
12.相同温度、相同浓度下的6种盐溶液,其pH由小到大的顺序如图所示,图中①②③代表的物质可能分别为

A.AlCl3 Al2(SO4) 3 NaClO B.Al2 (SO4) 3 AlCl3 NaClO
C.Al2 (SO4) 3 AlCl3 NaOH D.CH3COOH AlCl3 Al2 (SO4) 3
13.下列实验不能达到实验目的的是
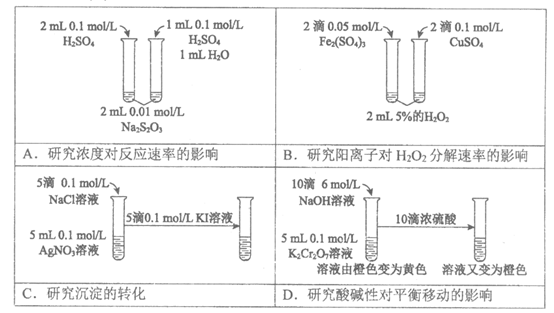
14.常温下用0.1 moI/L NaOH溶液滴定20 mL 0.1 mol/L盐酸,恰好中和后不慎多加了1滴NaOH溶液(1滴溶液的体积以0.05 mL计),再往锥形瓶中加蒸馏水至反应液的体积为50 mL,此时混合溶液的pH约为
A.11.3 B.10 C.7.2 D.4
15.室温下,1L含0.1 mol CH3COOH和0.1 mol CH3COONa的溶液a及加入一定量强酸或强碱后溶液的pH如下表(加入前后溶液体积不变):
溶液a | 通入0.01 mol HCl | 加入0.01 mol NaOH | |
pH | 4.76 | 4.67 | 4.85 |
像溶液a这样,加入少量强酸或强碱后pH变化不大的溶液称为缓冲溶液。
下列说法不正确的是
A.溶液a和0.1 mol·L-1 CH3COOH溶液中CH3COOH的电离程度前者小于后者
B.向溶液a中通入0.01 mol HCl时,CH3COO–结合H+生成CH3COOH,pH变化不大
C.向溶液a中加入0.1 mol NaOH固体,pH基本不变
D.含0.1 mol·L-1 NH3·H2O与0.1 mol·L-1 NH4Cl的混合溶液也可做缓冲溶液
16.电渗析法淡化海水的原理如图所示。已知海水中含Na+、Ca2+、Mg2+、Cl–、SO42-等离子,电极为惰性电极。下列叙述正确的是
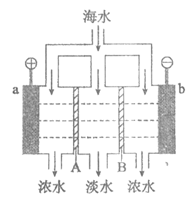
A.A是阳离子交换膜
B.海水中阴离子移向b电极
C.a的电极反应为4OH–-4e–=O2↑+2H2O
D.b极产生无色气体,出现白色沉淀
17.下列叙述正确的是
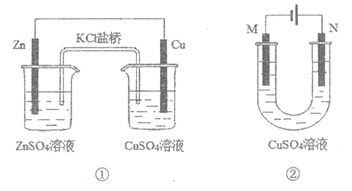
A.装置①中,电子移动的路径是:Zn→Cu→CuSO4溶液→KCl盐桥→ZnSO4溶液
B.在不改变总反应的前提下,装置①可用Na2SO4替换ZnSO4,用石墨替换Cu棒
C.装置②中采用石墨电极,通电后由于OH–向阳极迁移,导致阳极附近pH升高
D.若装置②用于铁棒镀铜,则N极为铁棒
18.工业上可通过如下流程回收铅蓄电池中的铅,下列有关说法不正确的是
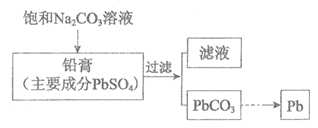
A.PbSO4在水中存在溶解平衡:PbSO4 (s)
 Pb2+(aq)+SO42- (aq)
Pb2+(aq)+SO42- (aq)
B.滤液中不存在Pb2+
C.生成PbCO3的离子方程式为:PbSO4 (s)+CO32-(aq)  PbCO3 (s)+SO42-(aq)
PbCO3 (s)+SO42-(aq)
D.pH:滤液<饱和Na2SO3溶液
19.测定0.1 mol·L-1 Na2SO3溶液先升温再降温过程中的pH,数据如下表。实验过程中,取①、④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多。下列说法不正确的是
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
A.Na2SO3溶液中存在水解平衡:SO32-+H2O HSO3–+OH–
HSO3–+OH–
B.④产生的白色沉淀是BaSO4
C.①→③的过程中,c(SO32-)在降低
D.①→③的过程中,温度与c(SO32-)相比,前者对水解平衡的影响更大
20.实验小组通过酸碱中和滴定计算精制磷酸中H3PO4的质量分数。取ag所得精制磷酸,加适量水稀释得待测液,以酚酞作指示剂,用b mol·L-1 NaOH标准液滴定至终点时生成Na2HPO4,消耗NaOH溶液c mL。下列说法不正确的是
A.分别用酸式滴定管和碱式滴定管量取待测液和标准液
B.滴定达到终点的标志是滴加最后半滴NaOH溶液,溶液由无色恰好变为粉红色,且半分钟内不褪色
C.发生反应的酸与碱的物质的量相等
D.精制磷酸中H3PO4的质量分数是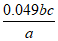
二、非选择题(21~26题,共60分)
21.(7分)下表是元素周期表的一部分。表中所列编号分别代表某一化学元素。
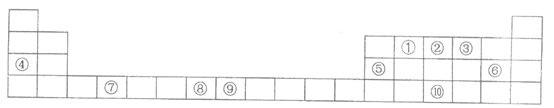
(1)⑧的简化电子排布式是___________,⑩的价层轨道表示式是_______。
(2)⑦元素有_______种运动状态不同的电子。
(3)上述标出的第三周期元素中,电负性最大的元素是_______(填写元素符号)。
(4)已知X逐级失去电子的电离能依次为I1=502 kJ·mol-1,I2=4570 kJ·mol-1,I3=6920 kJ·mol-1,I4=9550 kJ·mol-1……
X可能为以上10种元素中的___________元素(填写元素符号)。
X原子的第二电离能远远大于第一电离能的原因是_________。
(5)⑨在周期表中的位置是_______。
22.(6分)电化学原理在防止金属腐蚀、能量转换等方面应用广泛。
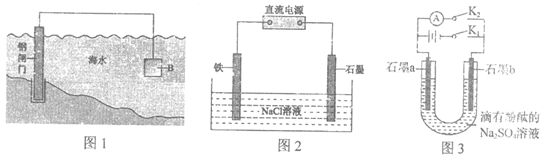
(1)图1中,钢铁在海水中容易发生电化学腐蚀,正极反应式是_______。
为减缓钢闸门的腐蚀,材料B可以选择______________(填“Zn”或“Cu”)。
(2)图2为钢铁防护模拟实验装置,则铁做______________极,检测钢铁保护效果的方法是:取少量铁电极附近的溶液于试管中,_______,则说明保护效果好。
(3)图3为某同学制作的燃料电池示意图,先闭合K1接通电源一段时间后,再断开K1、闭合K2时,电流表指针偏转。下列分析正确的是____________
A.闭合K1时,若消耗3.6 g水,电路中通过了0.4mol的电子
B.闭合K1时,石墨a附近溶液逐渐变红
C.断开K1、闭合K2时,石墨a附近溶液酸性逐渐减弱
D.断开K1、闭合K2时,石墨b极上发生反应:H2-2e–=2H+
23.(10分)下图是闪锌矿(主要成分是ZnS,含有少量FeS)制各ZnSO4·7H2O的工艺流程:

资料:相关金属离子浓度为0.1 mol·L-1时形成氢氧化物沉淀的pH范围如下:
金属离子 | Fe3+ | Fe2+ | Zn2+ |
开始沉淀的pH | 1.5 | 6.3 | 6.2 |
沉淀完全的pH | 2.8 | 8.3 | 8.2 |
(1)闪锌矿在溶浸之前会将其粉碎,目的是______________。
(2)溶浸过程使用过量的Fe2(SO4) 3溶液和H2SO4浸取矿粉,发生的主要反应是:
ZnS+ 2Fe3+=Zn2++ 2Fe2++S。下列判断正确的是 _______(填字母序号)。
a.浸出液中含有Zn2+、Fe2+、Fe3+、H+等阳离子
b.加入硫酸,可以抑制Fe2 (SO4) 3水解
c.若改用CuSO4溶液进行浸取,将发生反应:S2-+Cu2+=CuS↓
(3)工业除铁过程需要控制沉淀速率,因此分为还原和氧化两步先后进行,如图。还原过程将部分Fe3+转化为Fe2+,得到pH小于1.5的溶液。
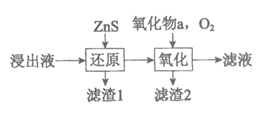
氧化过程向溶液中先加入氧化物a,再通入O2。
①a可以是_______ ,加入a的作用是______________。
②除铁过程中可以控制溶液中c(Fe3+)的一种操作是______________。
24.(14分)研究弱电解质的电离,有重要的实际意义。
(1)已知:25℃时
化学式 | CH3COOH | HClO | H2CO3 |
电离常数 (Ka) | 1.75×10-5 | 3.0×10-8 | K1= 4.4×10-7 K2= 5.6×10-11 |
回答下列问题:
①CH3COOH的电离平衡常数表达式为_____________________,25℃,若初始时醋酸中CH3COOH的浓度为0.010mol·L-1,达到电离平衡时溶液中c(H+)=__________mol·L-1(已知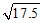 =4.2)。
=4.2)。
②物质的量浓度相同时:
pH(NaClO)______________pH(CH3COONa)(填“>”、“<“或“=”)。
③下列反应可以发生的是_______。
A.HClO+CH3COONa=CH3COOH+NaClO
B.CH3COOH+Na2CO3=NaHCO3+CH3COONa
C.CO2+H2O+2NaClO=Na2CO3+2HClO
(2)常温下,用0.1mol·L-1 NaOH溶液滴定10 mL 0.1 mol·L-1 CH3COOH溶液的滴定曲线如图所示。
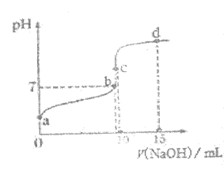
①b点溶液中,c(Na+)__________c(CH3COO–)(填“>”、“<“或“=”)。
②比较a、c两点水的电离程度:a_______ c(填“>”、“<“或“=”)。
③d点溶液中,c(CH3COO–)+c(CH3COOH)=_______ mol·L-1。
25.(12分)煤的洁净技术(包括固硫技术和脱硫技术两类)可有效降低燃煤废气中SO2的含量,已成为我国解决环境问题的主导技术之一。
I.固硫技术:通过加入固硫剂,将硫元素以固体形式留在煤燃烧的残渣中。
石灰石是常用的固硫剂,固硫过程中涉及的部分反应如下:
①CaCO3(s)  CaO(s)+ CO2 (g) △H1= +178.30 kJ/mol
CaO(s)+ CO2 (g) △H1= +178.30 kJ/mol
②CaO(s)+SO2 (g) +0.5O2 (g)  CaSO4(S) △H2=-501.92 kJ/mol
CaSO4(S) △H2=-501.92 kJ/mol
③CO(g)+ 0.5O2(g)
 CO2(g) △H3
CO2(g) △H3
④CaSO4(s)+ CO(g)  CaO(s)+SO2 (g)+ CO2 (g) △H4= +218.92 kJ/mol
CaO(s)+SO2 (g)+ CO2 (g) △H4= +218.92 kJ/mol
(1)温度升高,反应①的化学平衡常数 _______(填“增大“”减小“或“不变“)。
(2) △H3= ______________ kJ/mol。
(3)在煤燃烧过程中常鼓入稍过量的空气以提高固硫率(燃烧残渣中硫元素的质量占燃煤中硫元素总质量的百分比)。鼓入稍过量的空气,可以增大反应体系中氧气的浓度,使反应②平衡正向移动,有利于固硫。请同学们结合反应③、④分析鼓入稍过量的空气提高固硫率的其它原因:______________________。
II.电化学脱硫技术是一种温和的净化技术,其基本原理为利用阳极反应产生的羟基自由基(·OH,氧元素为-1价)将燃煤中的含硫物质氧化除去,其装置示意图如下图所示。
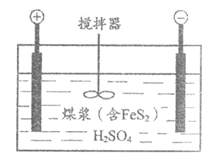
(4)阳极的电极反应式为______________。
(5)补全用羟基自由基除去煤中二硫化亚铁(FeS2)的反应的离子方程式:
 FeS2+
FeS2+  `OH=
`OH= Fe3++
Fe3++ SO42-+
SO42-+ H2O+
H2O+  _______
_______
(6)利用上述装置对某含FeS2的煤样品进行电解脱硫,测得一定时间内随溶液起始pH的改变脱硫率(溶于水中的硫元素质量占煤样中硫元素总质量的百分比)的变化如下图所示。pH大于1.5后脱硫率下降的可能原因有:
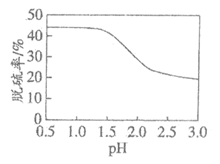
随着pH的升高,反应物的氧化性或还原性降低;
_______________________________________________________________。
26.(11分)为探究Na2SO3溶液和铬(VI)盐溶液的反应规律,某同学进行实验如下:
已知:Cr2O72-(橙色)+ H2O 2CrO42-(黄色)+2H+
2CrO42-(黄色)+2H+
(1)进行实验i和ii:
序号 | 操作 | 现象 |
i | 向2 mL pH=2的0.05 mol·L-1 K2Cr2O7橙色溶液中滴加饱和Na2SO3溶液(pH约为9)3滴 | 溶液变绿色(含Cr3+) |
ii | 向2 mL pH=8的0.1mol·L-1 K2CrO4黄色溶液中滴加饱和Na2SO3溶液(pH约为9)3滴 | 溶液没有明显变化 |
①用化学用语表示饱和Na2SO3溶液pH约为9的原因:_____________________。
②用离子方程式解释i中现象:________________________________。
(2)继续进行实验iii:
序号 | 操作 | 现象 |
iii | 向2 mL饱和Na2SO3溶液中滴加pH =2的0.05 mol·L-1 K2Cr2O7橙色溶液3滴 | 溶液变黄色 |
为了说明产生上述现象的原因,进行补充实验:向2 mL蒸馏水中滴加pH =2的0.05 mol·L-1K2Cr2O7橙色溶液3滴,溶液变成浅橙色。
①补充实验的目的是____________________________。
②用化学平衡移动原理解释iii中现象:___________________________________。
③根据实验i~iii,可推测:Na2SO3溶液和铬(VI)盐溶液的反应与溶液酸碱性有关。
a.碱性条件下,Na2SO3溶液和铬(VI)盐溶液不发生氧化还原反应;
b._______________________________________________________________。
④向实验iii所得黄色溶液中继续滴加硫酸,产生的现象证实了上述推测。该现象是
_______________________________________________________________。
(3)为探究溶液酸性增强对Na2SO3溶液还原性或铬(VI)盐溶液氧化性的影响,该同学利用如图装置继续实验(已知电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大)。
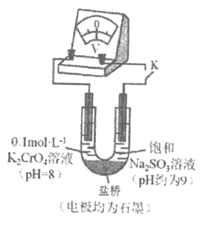
a.K闭合时,电压为x。
b.向U型管左侧溶液中滴加硫酸至pH=2后,电压增大了y。
c.继续向U型管右侧溶液中滴加硫酸后,无气体逸出,电压几乎不变。
上述实验说明:__________________________________________________。
参考答案
一、选择题(共40分)
1-5.CDDCB 6-10.CCAAD 11-15.DBCBC 16-20.DBBDC
二、非选择题(共60分)
21.(每空1分,共7分)
(1) [Ar]3d54s2,
(2) 22 (3) Cl
(4) Na Na原子失去一个电子后,Na+已形成稳定结构,再失去一个电子很困难。
(5)第四周期第VIII族
22.(每空1分,共6分)
(1) O2+4e–+2H2O=4OH– Zn
(2)阴,滴加铁氰化钾(K3Fe(CN)6)溶液,若无蓝色沉淀产生
(3)A、C(2分)
23.(每空2分,共10分)
(1)增大固体表面积,加快反应速率
(2) ab
(3)①ZnO 调节pH值,使Fe3+逐渐沉淀
②通入O2、加入ZnO、加入ZnS等
24.(每空2分,共14分)
(1)①Ka=c(CH3COO–)·c(H+)/c(CH3COOH), 4.2×10-4mol·L-1
②> ③B
(2)①c(Na+)= c(CH3COO–)
②< ③0.04 mol·L-1
25.(每空2分,共12分)
(1)增大 (2) -283
(3)氧气浓度增大会使反应③平衡正向移动,降低CO浓度,增大CO2浓度,使反应④平衡逆向移动,有利于固硫
(4) H2O-e–=·OH–+H+
(5) 1FeS2+15·OH=1Fe3++2SO42-+7H2O+1H+
(6) pH升高,促进Fe3+水解生成Fe(OH)3,覆盖在煤浆表面,阻止反应进行(或其它合理答案)
26.(共11分)
(1)①SO32-+H2O  HSO3–+OH–(2分)
HSO3–+OH–(2分)
②Cr2O72-+3SO32-+8H+=2Cr3++3SO42-+4H2O(2分)
(2)①排除稀释对溶液颜色变化造成的干扰(1分)
②Cr2O72-(橙色)+H2O 2CrO42-(黄色)+2H+,溶液中的SO32-与H+结合,
2CrO42-(黄色)+2H+,溶液中的SO32-与H+结合,
导致溶液中H+浓度下降,平衡正向移动,溶液变黄。(2分)
③b.酸性条件下,Na2SO3与铬盐溶液发生氧化还原反应,生成Cr3+(1分)
④溶液由黄变绿(1分)
(3)溶液酸性增强,铬盐溶液氧化性增强,Na2SO3溶液的还原性几乎没有变化(2分)