本试卷共100分。考试时长90分钟。
可能用到的相对原子质量:H 1 C 12 N 14 O16
第一部分
本部分共14题,每题3分,共42分。在每题列出的四个选项中,选出最符合题目要求的一项。
1. 下列材料的主要成分属于有机物的是
A. 国家速滑馆用于蒸发制冷的材料——二氧化碳
B. 长征五号的整流罩前锥段材料——聚甲基丙烯酰亚胺
C. 港珠澳大桥锚具材料——特殊工艺的低碳钢
D. 我国自主研发的5G芯片的材料——硅
2. 下列反应中,酸体现还原性的是
A. MnO2与浓盐酸共热制Cl2
B. Na2SO3与浓硫酸共热制SO2
C. Zn与稀硫酸反应制H2
D. Cu与稀硝酸反应制备NO
3. 工业上利用反应3Cl2+8NH3=N2+6NH4Cl检查氯气管道是否漏气。下列说法不正确的是
A. 将浓氨水接近管道,若产生白烟说明管道漏气
B. N2的电子式为: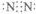
C. NH4Cl中只含有离子键
D. 该反应中氧化剂和还原剂的物质的量之比为3:2
4. 元素周期律的发现是近代化学史上的一座里程碑。下列事实不能用元素周期律解释的是
A. Na2CO3溶液中加盐酸,产生气泡
B. 常温下,形状和大小相同的Mg、Al与同浓度盐酸反应,Mg条更剧烈
C. 气态氢化物的稳定性:H2O>H2S
D. Cl2从NaBr溶液中置换出Br2
5. 下列关于室温下1 L 0.1 mol·L-1 NH3·H2O溶液的说法正确的是
A. NH3·H2O的电离方程式:NH3·H2O=NH4++OH–
B. 加入少量NH4Cl固体后,溶液的pH增大
C. 滴加稀盐酸的过程中,n(NH4+)增大
D. 与FeCl3溶液反应的离子方程式:Fe3++3OH–=Fe(OH)3↓
6. 某小组用如下装置探究SO2的性质。下列离子方程式书写不正确的是
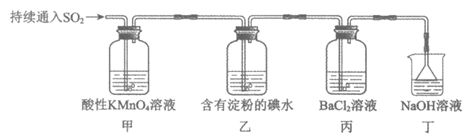
A. 甲中紫色褪去:5SO2+2MnO4–+2H2O=2Mn2++5SO42-+4H+
B. 乙中蓝色逐渐变浅:I2+SO2+2H2O=2I–+SO42-+4H+
C. 丙中产生少量白色沉淀:Ba2++SO2+H2O=BaSO3↓+2H+
D. 丁中可能的反应:SO2+2OH–=SO32-+H2O
7. 下列说法正确的是
A. 标准状况下,22.4 L CCl4含有的分子数约为6.02×1023
B. 1 mol 18O含有的中子数约为8×6.02×1023
C. 1 mol NO2和N2O4的混合物中含有的氮原子数共约为3×6.02×1023
D. 0. 1 mol Cl2与足量的Fe反应转移的电子数约为0.2×6.02×1023
8. 新鲜水果和蔬菜中富含维生素C,在I2作用下可转化为脱氢维生素C,原理如下:
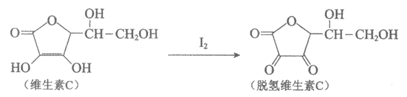
下列关于维生素C的说法正确的是
A. 分子式为C6H7O6
B. 难溶于水,易溶于有机溶剂
C. 与脱氢维生素C都可使酸性KMnO4溶液褪色
D. 与脱氢维生素C互为同分异构体
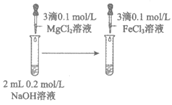
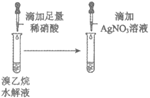
9. 下列实验方案能达到相应目的的是
|
|
|
|
A. 除去CO2 中的HCl | B. 相同温度下的溶解度: Mg(OH)2>Fe(OH)3 | C. 检验溴乙烷水解产物中含有Br– | D. 检验Na2SO3溶液是否变质 |
10. Claisen重排反应是有机合成中常用的重要反应。以CH2=CHOCH2CH=CH2为例,其反应过程对应的机理有两种,如下图(“-“可表示单、双键)。下列说法不正确的是
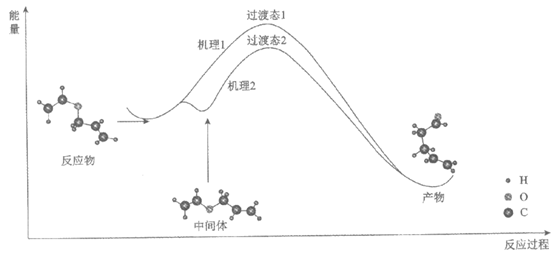
A. 机理1:反应物→产物的过程中,有极性共价键断裂
B. 机理2:反应物→中间体的过程中,没有化学键断裂,只有空间结构变化
C. 该反应的化学方程式:CH2=CHOCH2CH=CH2→CH2=CHCH2CH2CHO
D. 相比于机理1,机理2所需活化能降低,活化分子百分比下降,反应速率减慢
11. 一种新型高分子M的合成方法如下:
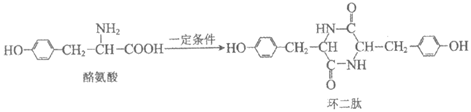
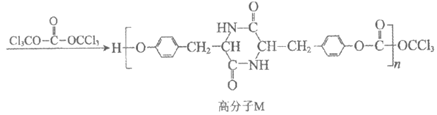
下列说法不正确的是
A. 酪氨酸能与酸、碱反应生成盐
B. 1 mol环二肽最多能与2 mol NaOH反应
C. 高分子M中含有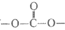 结构片断
结构片断
D. 高分子M在环境中可降解为小分子
12. 利用废铝箔(主要成分为Al,含少量Mg、Fe等)制明矾[KAl(SO4)2·12H2O]的一种工艺流程如下:
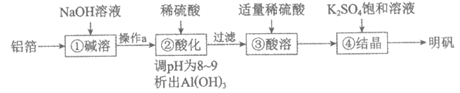
下列说法不正确的是
A. ①中生成了H2:2Al+2NaOH+2H2O=2NaA1O2+3H2↑
B. 操作a是过滤,以除去难溶于NaOH溶液的杂质
C. ②③中加入稀硫酸的作用均是除去杂质
D. 由④可知,室温下明矾的溶解度小于Al2(SO4)3和K2SO4的溶解度
13. 一定温度下,容积为2L的密闭容器中发生反应:A(g)+B(g)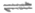 C(g)+D(g)
C(g)+D(g)
△H>0,容器中部分物质的含量见下表(t2>t1):
反应时间/min | n(A)/mol | n(B)/mol | n(C)/mol | n(D)/mol |
0 | 1.2 | 0.6 | 0 | 0 |
t1 | 0.8 | |||
t2 | 0.2 |
下列说法正确的是
A. t1 min内,D的平均化学反应速率为v(D)=0.4/ t1 mol·(L·min)-1
B. 该温度下,反应的化学平衡常数K=1.0
C. 达到化学平衡状态时,A的转化率为66.7%
D. 若升高温度,平衡逆向移动
14. 相同温度和压强下,研究Cl2在不同溶液中的溶解度(用溶解Cl2的物质的量浓度表示)随溶液浓度的变化。在NaCl溶液和盐酸中Cl2的溶解度以及各种含氯微粒的浓度变化如下图。
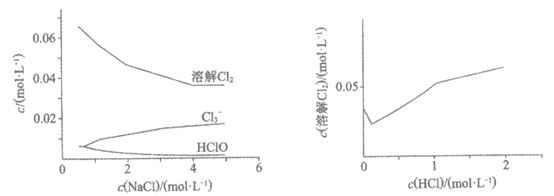
图1 NaCl溶液浓度与溶解Cl2及含氯微粒的浓度变化
图2 盐酸浓度与溶解Cl2的浓度变化
下列说法不正确的是
A. 由图1可知,Cl2溶于NaCl溶液时还发生了反应Cl2+Cl–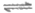 Cl3–
Cl3–
B. 随NaCl溶液浓度增大,Cl2+H2O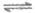 H++Cl–+HClO平衡逆移,Cl2溶解度减小
H++Cl–+HClO平衡逆移,Cl2溶解度减小
C. 随盐酸浓度增加Cl2与H2O的反应被抑制,生成Cl3–为主要反应从而促进Cl2溶解
D. 由上述实验可知,H+浓度增大促进Cl2溶解,由此推知在稀硫酸中,随硫酸浓度增大Cl2的溶解度会增大
第二部分
本部分共5题,共58分。
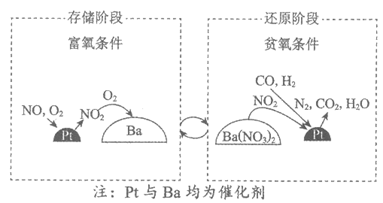
15. (10分)NSR(NO2)的储存和还原在不同时段交替进行)技术可有效降低稀燃柴油和汽油发动机尾气中NO2的排放,其工作原理如下图。
(1)已知:N2(g)+O2(g)=2NO(g)
△H1=+180.5 kJ·mol-1
2CO(g)+O2(g)=2CO2(g)
△H2=-566 kJ·mol-1
则NSR技术工作原理的热化学方程式:
2CO(g)+2NO(g)=N2(g)+2CO2(g)
△H3=_________。
(2)①存储阶段:
Ba存储NO2后转化为Ba(NO3)2的化学方程式是_______。
②还原阶段:NO2从Ba(NO3)2中释放,然后在Pt的表面被CO、H2还原为N2。
若参加反应的n(CO)=n(H2),则反应的n(CO):n(H2):n(NO2)=________。
(3)某实验小组模拟NSR系统中的一个存储、还原过程。让尾气通过NSR反应器,测得过程中出口NO2浓度变化如图。
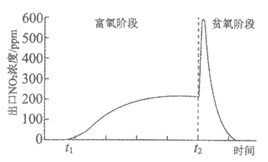
①t1时刻前,NO2的浓度接近0,原因是________。
②t2时刻,切换至贫氧条件。NO2的浓度急剧上升又快速下降的原因是________。
16. (12分)羟胺(NH2OH)为无色固体,结构可视为—OH替代NH3中1个—H。羟胺具有和NH3类似的弱碱性,可以与盐酸反应生成盐酸羟胺(NH2OH·HCl)。盐酸羟胺是一种盐,易溶于水,溶解后完全电离为NH3OH+和Cl–。
(1)NH2OH·HCl中N元素的化合价是________。
(2)过氧化氢催化氧化氨水法制备盐酸羟胺的原理如下:
步骤1: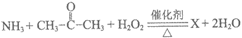
步骤2:
资料:丙酮(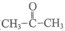 )是一种易溶于水的无色液体,沸点为57℃。
)是一种易溶于水的无色液体,沸点为57℃。
①X的分子式为C3H7NO,其核磁共振氢谱只有两个吸收峰,红外光谱显示其分子结构中存在羟基和碳氮双键。X的结构简式是________。
②步骤1中,相同反应时间氨的转化率随温度变化如图1。温度高于65℃时,随温度上升氨的转化率变化的原因是________。
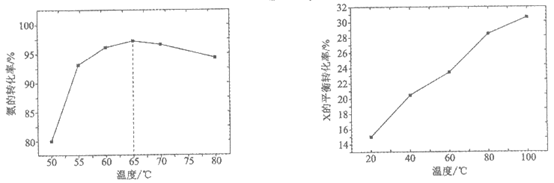
图1 图2
③步骤2中,在密闭容器中反应时,X的平衡转化率随温度变化如图2。该反应为________(填“吸热“或“放热“)反应。
④步骤2中蒸馏出丙酮的目的是________(1点即可)。
(3)电化学法制备盐酸羟胺:
向两侧电极分别通入NO和H2,以盐酸为电解质,组装原电池以制备盐酸羟胺。装置(图3)和正极反应机理图(图4)如下。
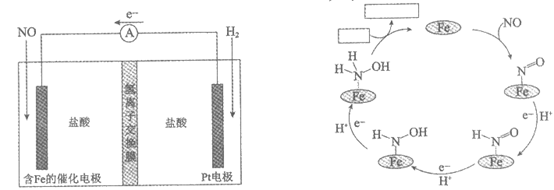
图3 图4
①将图4方框中缺失的物质补充完整。
②一段时间后,正极区的pH与反应前相比_______(填“增大“、“减小“或“不变“)(不考虑溶液体积的变化)。
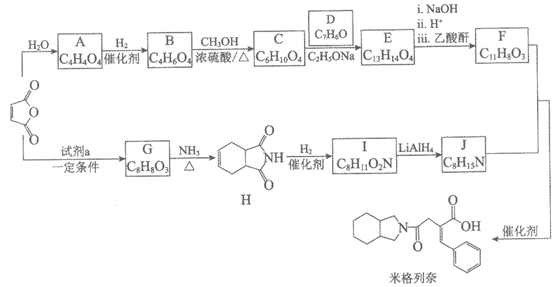
17.(12分)米格列奈可用于治疗糖尿病,其合成路线如下:
已知:i. 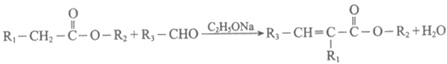
ii. 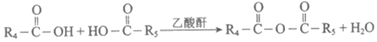
iii. 
(1)1 molA能与2 mol NaHCO3溶液反应生成气体,A中含有的官能团是_______。
(2)B→C的化学方程式是_______。
(3)E的结构简式是_______。
(4)试剂a为CH2=CH-CH=CH2,其名称是_______。
(5)I→J的反应类型是_______。
(6)F+J→米格列奈的过程中,会生成M,M与米格列奈互为碳链异构的同分异构体,则M的结构简式是_______。
(7)酸性溶液中,可采用电解法由A制B,电解时的阴极反应式是_______。
18.(12分)海水中的化学资源具有巨大的开发潜力。
(1)溴及其化合物广泛用于医药、塑料阻燃剂等。苦卤(含Br–)提溴的工业流程如下:
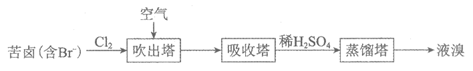
①向吹出塔中通空气的目的是_______。
②吸收塔中盛有Na2CO3溶液,通入足量Br2蒸气时,有BrO3–和无色气体生成,反应的离子方程式是_______。
(2)用下图所示装置( 表示斜发沸石)分离海水中的K+和Na+,料液(含K+、Na+、Cl–和I–)先流过斜发沸石吸附K+和I–。然后通电,双极膜产生的H+将K+交换下来,OH–将I–交换下来,得到A溶液。
表示斜发沸石)分离海水中的K+和Na+,料液(含K+、Na+、Cl–和I–)先流过斜发沸石吸附K+和I–。然后通电,双极膜产生的H+将K+交换下来,OH–将I–交换下来,得到A溶液。
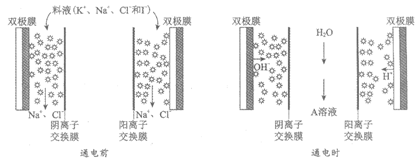
①简述A溶液中含K+不含Na+的原因:_______。
②海水中c(K+)>c(I–),则A溶液中的溶质是_______。
为了提高产率并防止原料浪费,通电一段时间后,将阴、阳极的斜发沸石对调,继续通电,此时斜发沸石内主要反应的离子方程式是_______。
(3)KI广泛用于皮肤科、眼科等疾病的治疗。利用海水中获得的I2和(2)中获得的A溶液及Fe粉,可获得纯度较高的KI晶体,流程如下:
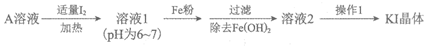
已知:i. KI的溶解度
温度/℃ | 6 | 20 | 60 | 100 |
KI的溶解度/g | 128 | 140 | 176 | 206 |
ii. 3I2+6KOH=5KI+KIO3+3H2O
①用化学方程式说明加入Fe粉的作用:________。
②操作1是______,过滤,洗涤,干燥。
19.(12分)某小组同学根据Fe3+、Fe2+和Zn2+的氧化性推断溶液中Zn与Fe3+可能先后发生两个反应:2Fe3++Zn=2Fe2++Zn2+,Fe2++Zn=Zn2++Fe,进行如下实验。
实验 | 试剂 | 现象 |
I | 2 mL0.1 mol·L-1 FeCl3溶液、过量锌粉 | 黄色溶液很快变浅,接着有无色气泡产生,固体中未检出铁 |
II | 2 mLpH≈0.70的1 mol·L-1 FeCl3溶液、过量锌粉 | 片刻后有大量气体产生,出现红褐色浑浊,约半小时后,产生红褐色沉淀,溶液颜色变浅,产生少量铁 |
(1)取实验I反应后的少量溶液,滴加几滴K3[Fe(CN)6]溶液,生成_____,证明有Fe2+。
(2)结合化学用语解释实验Ⅱ中产生红褐色浑浊的原因:_____。
(3)实验Ⅲ:用Fe2(SO4)3溶液和Fe(NO3)3溶液替代实验Ⅱ中的FeCl3溶液:
实验 | 试剂 | 现象 |
i | 2 mL ph≈0.70的1 mol·L-1 Fe(NO3)3溶液、过量锌粉 | 约半小时后,溶液变为深棕色且浑浊,无铁产生 |
ii | 2 mLph≈0.70的a mol·L-1 Fe2(SO4)3溶液、过量锌粉 | 约半小时后,溶液呈浅绿色且浑浊,有少量铁产生 |
资料:Fe2++NO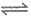 [Fe(NO)]2+,[Fe(NO)]2+在溶液中呈棕色。
[Fe(NO)]2+,[Fe(NO)]2+在溶液中呈棕色。
①a=________。
②有人认为i中深棕色溶液中存在[Fe(NO)]2+,设计实验证明。实验的操作和现象是_______。
③对照实验Ⅱ和Ⅲ,Fe(NO3)3溶液与过量锌粉反应没有生成铁的原因是_______。
(4)实验Ⅳ:将实验Ⅱ中FeCl3水溶液换成FeCl3无水乙醇溶液,加入足量锌粉,片刻后,反应放热,有大量铁产生。
由实验I~Ⅳ可知:锌能否与Fe3+反应得到单质铁,与Zn和Fe3+的物质的量、Fe3+的浓度、_______、_______等有关。
参考答案
第一部分共14小题,每小题3分,共42分。
1. B 2. A 3. C 4. A 5. C
6. C 7. D 8. C 9. C 10. D
11. B 12. C 13. B 14. D
第二部分共5小题,共58分。
说明:其他合理答案均可参照本参考答案给分。
15. (10分)
(1)-746.5 kJ·mol-1(2分)
(2)①Ba+O2+2NO2=Ba(NO3)2(2分)
②1:1:1(2分)
(3)①t1时刻前几乎所有的NO2都被存储在催化剂上(2分)
②存储在催化剂上的NO2被迅速释放,后又与还原性气体快速反应转化为N2(2分)
16. (12分)
(1)-1(2分)
(2)①(CH3)2C=N—OH(1分)
②65℃以上,温度升高促进过氧化氢分解,且氨和丙酮易挥发,浓度均降低,化学反应速率减慢,氨的转化率降低(2分)
③吸热(2分)
④降低丙酮的浓度,促进该平衡正向移动,提高X的平衡转化率;得到的丙酮可循环使用(2分)
(3)①H+(1分) NH3OH+(1分)(或HCl NH2OH·HCl)
②增大(1分)
17. (12分)
(1)羧基、碳碳双键(各1分)
(2)HOOC—CH2—CH2—COOH+2CH3OH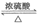 CH3OOC—CH2—CH2—COOCH3+2H2O(2分)
CH3OOC—CH2—CH2—COOCH3+2H2O(2分)
(3)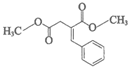 (2分)
(2分)
(4)1,3-丁二烯(1分)
(5)还原反应(1分)
(6)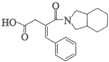 (2分)
(2分)
(7)HOOC—CH=CH—COOH+2e–+2H+→HOOC—CH2—CH2—COOH(2分)
18. (12分)
(1)①将Br2蒸气吹出(2分)
②3Br2+3CO32-=5Br–+BrO3–+3CO2(2分)
(2)①料液(含K+、Na+、Cl–和I–)先流过斜方沸石,K+被吸附,与Na+分离,Na+随溶液流出,然后通电,双极膜产生的H+将K+交换下来,K+通过阳离子交换膜进入H2O中(2分)
②KI、KOH(1分) H++OH–=H2O(1分)
(3)①KIO3+3Fe+3H2O=KI+3Fe(OH)2(2分)
②加热浓缩,降温结晶(2分)
19.(12分)
(1)蓝色沉淀(2分)
(2)Fe3++3H2O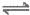 Fe(OH)3+3H+,H+被消耗,促进Fe3+的水解,产生氢氧化铁沉淀(2分)
Fe(OH)3+3H+,H+被消耗,促进Fe3+的水解,产生氢氧化铁沉淀(2分)
(3)①0.5(2分)
②过滤,取少量深棕色溶液,加热,溶液棕色变浅,液面上方产生红棕色气体(2分)
③Fe2+与NO结合生成[Fe(NO)]2+,溶液中Fe2+的浓度下降,使得Fe2+与Zn反应的化学反应速率变慢(2分)
(4)阴离子种类(1分)溶剂(1分)