本试卷分为选择题和非选择题两部分,满分100分。考试时间90分钟。
可能用到的相对原子质量:H-1 O-12 N-14 O-16 K-39 Cr-52
第一部分(选择题
共42分)
本部分共14个小题,每小题3分,在每题列出的四个选项中,选出最符合题目要求的一项。
1.化学是材料科学、生命科学、环境科学、能源科学和信息科学等的重要基础。下列过程没有涉及化学变化的是
A.煤的脱硝脱硫 B.风力发电
C.以黏土为原料烧结陶瓷 D.以N2为原料合成氨及铵盐
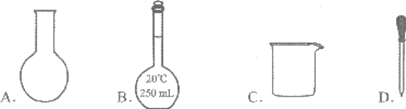
2.实验室配制250 mL 0.1mol/L的Na2CO3溶液,无需用到的仪器是
3.下列关于元素及元素周期律的说法,正确的是
A.同主族元素的原子,最外层电子数相等且等于主族序数
B.铝元素在周期表中位于第4周期IIIA族
C.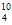 Be的原子核内中子数是10
Be的原子核内中子数是10
D.第117号元素Ts的非金属性强于Br
4.下列解释实验事实的化学方程式正确的是
A.大理石溶于盐酸:CO32-+2H+=H2O+CO2↑
B.用FeCl3溶液“腐蚀“覆铜板:Fe3++ Cu=Fe2++Cu2+
C.小苏打溶液呈弱碱性:HCO3–+H2O H2CO3+OH–
H2CO3+OH–
D.“84消毒液“中加少量醋增强漂白性:ClO–+H+=HClO
5.NaN3是汽车安全气囊系统中普遍使用的物质之一。当汽车受到猛烈碰撞时,瞬间引发反应:2NaN3=2Na+3N2↑,同时释放大量的热。NaN3为离子化合物,下列说法正确的是
A.生成3mol N2时,转移2 mol电子 B.1个N3–中含有21个电子
C.NaN3中只含离子键 D.N2的电子式为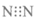
6.实验小组设计下图所示装置,验证SO2性质,对实验现象分析不正确的是
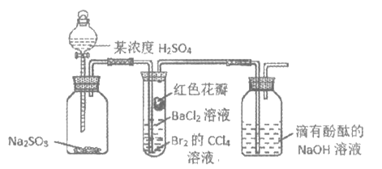
A.试管内Br2的CCl4溶液褪色,说明SO2具有还原性
B.一段时间后试管内有白色沉淀,说明SO2与BaCl2反应生成BaSO3
C.试管中的红色花瓣褪色,说明SO2具有漂白性
D.滴有酚酞的NaOH溶液红色变浅,说明SO2能与碱溶液反应
7.下列各项比较中,相等的是
A.相同物质的量浓度的CH3COOH和CH3COONa溶液中的c(CH3COO–)
B.相同质量的乙炔和苯中所含的氢原子数
C.相同物质的量的Cl2分别与足量的Fe、Ca(OH)2充分反应转移电子数
D.标准状况下,相同体积的NO和NO2所含氧原子数
8.氢化亚铜(CuH)是一种红棕色的难溶物,可在40℃~50℃时用CuSO4溶液和“另一种反应物“制取。CuH在Cl2中能燃烧生成CuCl2和HCl; CuH跟盐酸反应生成CuCl难溶物和H2。下列推断不正确的是
A.“另一种反应物“在反应中表现还原性
B.CuH与Cl2反应的化学方程式为:2CuH+3Cl2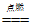 2CuCl2+2HCl
2CuCl2+2HCl
C.CuH与Cl2反应时,CuH做还原剂
D.CuH与盐酸反应的离子方程式为:CuH+H+=Cu++ H2↑
9.“中国芯“的发展离不开高纯单晶硅。从石英砂(主要成分为SiO2)制取高纯硅涉及的主要反应用流程图表示如下:
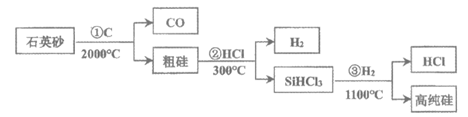
下列说法不正确的是
A.反应①中氧化剂和还原剂之比为1:2 B.流程中HCl和H2可以循环利用
C.反应①②③均为置换反应 D.由②③反应推测,③为放热反应
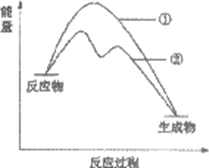
10.H2O2是重要的绿色消毒液和氧化剂,研究其分解反应有重要意义。在含有少量I–的溶液中,H2O2分解的机理是:i.H2O2+I–=H2O+IO–;ii.H2O2+IO–=H2O+O2↑+I–。分解反应过程中能量变化如下图所示,下列判断不正确的是
A.I–改变了H2O2分解的路径,曲线②为含有I–的反应过程
B.反应i和ii均为放热过程
C.反应i的反应速率比反应ii慢
D.I–不能改变总反应的能量变化
11.为了减少白色污染,科学家合成了PLA塑料,其结构片段如下图所示(图中 表示链延长)。下列说法不正确的是
表示链延长)。下列说法不正确的是
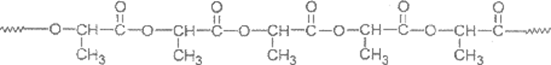
A. PLA聚合物的链节为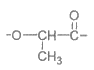
B.PLA可由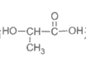 通过缩聚反应制得
通过缩聚反应制得
C.PLA制取过程中可能生成副产物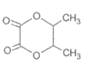
D.PLA相比于聚氯乙烯塑料的优点是易降解
12.外加少量酸或碱而pH基本不变的溶液,称为缓冲溶液。人体血液存在H2CO3/HCO3–的缓冲体系,能消耗人体正常代谢产生的酸或碱,保持pH的稳定。已知人体血液在正常体温时,H2CO3的一级电离常数Ka1=1×10-6。下列说法不正确的是
A.人体血液存在缓冲作用可用平衡表示:H++HCO3–
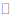 H2CO3
H2CO3
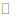 CO2+H2O
CO2+H2O
B.人体血液在酸中毒时,可注射少量NaHCO3溶液缓解
C.代谢产生的H+与HCO3–结合形成H2CO3来维持血液pH的稳定
D.某血液中c(HCO3–):c(H2CO3)≈20:1,则c(H+)≈5×10-7mol/L
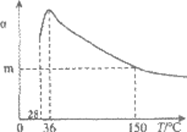
13.正戊烷异构化为异戊烷是油品升级的一项重要技术。在合适催化剂和一定压强下,正戊烷的平衡转化率(α)随温度变化如图所示。
名称 | 熔点/℃ | 沸点/℃ | 燃烧热 △H/kj·mol-1 |
正戊烷 | -130 | 36 | -3506.1 |
异戊烷 | -159.4 | 27.8 | -3504.1 |
下列说法不正确的是
A.25℃,101kPa时,正戊烷异构化成异戊烷的热化学反应方程式为:
CH3CH2CH2CH2CH3(l)= (CH3)2CHCH2CH3(l) △H=-2.0kJ/mol
B.28~36℃时,随温度升高,正戊烷的平衡转化率增大,原因是异戊烷气化离开体系,产物浓度降低,平衡正向移动
C.36~150℃时,随温度升高,正戊烷异构化反应的平衡常数增大
D.150℃时,体系压强从100kPa升高到500kPa,正戊烷的平衡转化率基本不变
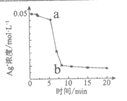
14.某小组对Fe2+和Ag+的反应进行了如下探究实验:
操作 | 现象 | Ag+浓度变化曲线 | |
实验I | 向1mL 0.1 mol/LFeSO4溶液中加入1 mL0.1 mol/LAgNO3溶液 | 几分钟后,出现大量灰黑色浑浊 |
|
实验Ⅱ | 先向试管中加入几滴Fe2(SO4)3溶液,然后重复实验I的操作 | 现象与实验I相同 |
(已知:Ag2SO4为白色微溶物;反应过程中测得温度几乎无变化)
下列说法正确的是
A.实验I只发生反应:Fe2++ Ag+
 Fe3++ Ag,灰黑色浑浊是Ag
Fe3++ Ag,灰黑色浑浊是Ag
B.图中c(Ag+)由a→b急速变化的可能原因是反应放热
C.图中c(Ag+)由a→b急速变化的可能原因是生成的Ag起催化作用
D.图中c(Ag+)由a→b急速变化的可能原因是生成的Fe3+起催化作用
第二部分(非选择题
共58分)
本部分共5题,共58分
15.(14分)《本草纲目》记载红曲米有特殊功效,受此启发有学者从红曲米中分离出具有降脂功能的有效成分——洛伐他汀,之后科学家合成了多种他汀类药物。“匹伐他汀钙“是人工合成的一种他汀类药物,其合成路线如下:
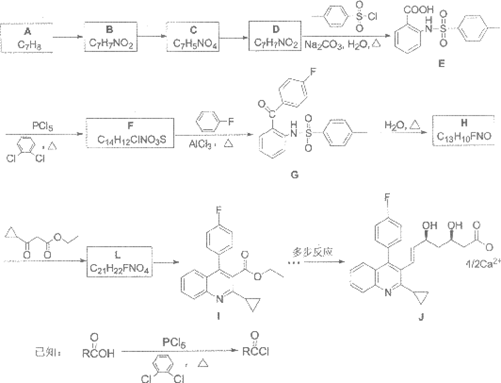
(1)A是一种芳香烃,A的名称是________。
(2)由B生成C的反应类型是________。
(3) D→E的化学方程式是________。
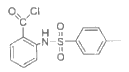
(4)F的结构简式是________。
(5)D的同分异构体中,满足下列条件的有________种。
①与FeCl3作用显色;
②能够发生银镜反应。
写出其中一种同分异构体的结构简式________。
(6)H含有2个苯环,核磁共振氢谱图中有7组峰,且面积比为2:2:2:1:1:1:1,G→H的化学方程式是________。
(7) H→I反应中生成中间体L,L含有3个六元环,1mol的L转化成I需要脱去2mol水,L的结构简式是________。
16.(10分)化学工业为疫情防控提供了强有力的物质支撑。氯及其化合物既是重要化工原料,又是广泛使用的高效灭菌消毒剂。回答下列问题:
(1)用氯气制备漂白液的离子方程式是________。
(2) TCCA是一种高效含氯消毒漂白剂,贮运稳定,在水中释放有效氯时间长,应用于游泳池等公共场合,其分子结构如图所示:
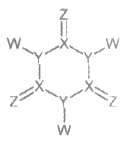
已知:X、Y、Z、W属于原子序数递增的短周期元素,Z核外最外层电子数是电子层数的3倍。
①TCCA的分子式是________。
②X、Y、Z对应简单氢化物中热稳定性最强的是________(用氢化物的化学式表示)。
(3) ClO2和NaClO2均为重要的杀菌消毒剂,将ClO2通入到NaOH和H2O2混合溶液中,可制备NaClO2。
资料:NaClO2晶体易溶于水,难溶于乙醇。NaClO2饱和溶液在温度低于38℃时析
出NaClO2·3H2O晶体,高于38℃时析出NaClO2晶体,高于60℃时NaClO2分解成NaClO3和NaCl。
①写出由ClO2制备NaClO2的离子方程式________。
②从上述NaClO2溶液获得干燥的NaClO2晶体的操作步骤为:将溶液在减压和55℃条件下蒸发至大量晶体析出后,___________,____________,低于60℃干燥,得到NaClO2晶体(补全实验步骤)。
17.(10分)将CO2还原成甲烷,是实现CO2资源化利用的有效途径之一。
I.CO2甲烷化
CO2甲烷化过程可能发生反应:
i.CO2g)+4 H2(g)  CH4(g)+2H2O(g) △H1
CH4(g)+2H2O(g) △H1
ii.CO2 (g)+ H2 (g)
 CO(g)+ H2O (g) △H2=+41.2 kJ·mol-1
CO(g)+ H2O (g) △H2=+41.2 kJ·mol-1
iii.CO(g)+3H2(g)  CH4(g)+ H2O (g) △H3=-206.1 kJ·mol-1
CH4(g)+ H2O (g) △H3=-206.1 kJ·mol-1
……
(1)△H1=____kJ·mol-1。
(2)不同条件下,按照n(CO2):n(H2)=1:4投料,CO2的平衡转化率如下图所示。
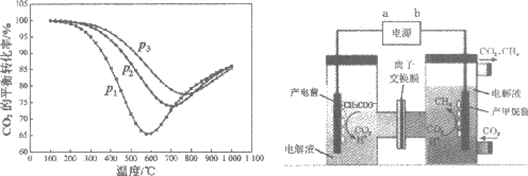
①压强p1、p2、p3由大到小的顺序是_________。
②压强为p1时,随着温度升高,CO2的平衡转化率先减小后增大。解释温度高于600℃之后,随着温度升高CO2转化率增大的原因________。
Ⅱ.微生物电化学法
微生物电化学产甲烷法是将电化学法和生物还原法有机结合,装置如上图所示。
(3)阴极的电极反应式是________。
(4)若生成1 mol CH4,理论上阳极室生成CO2的体积是________L(标准状况,忽略气体的溶解)。
18.(11分)重铬酸钾在工业中有广泛的应用,可用铬铁矿为原料制备。以铬铁矿(主要成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3、Fe2O3等杂质)制备重铬酸钾(K2Cr2O7)固体的工艺流程如下:
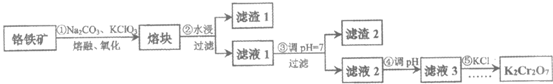
资料:①NaFeO2遇水强烈水解。
②Cr2O72-+H2O 2CrO42-+2H+。
2CrO42-+2H+。
(1) K2Cr2O7中Cr元素的化合价是________。
(2)步骤①发生多个反应,补全下列化学方程式:
_____ FeO·Cr2O3+____Na2CO3+____ KClO3=12Na2CrO4+____Fe2O3+____CO2+____
(3)熔块的主要成分为Na2CrO4、NaFeO2、Na2SiO3和NaAlO2等可溶性盐,滤渣1为红褐色固体,写出步骤②NaFeO2水解的离子方程式________。
(4)结合化学用语解释步骤④调pH的目的________。
(5)重铬酸钾纯度测定
称取重铬酸钾试样2.9400 g配成250 mL溶液,取出25.00 mL于锥形瓶中,加入10 mL2 mol/L H2SO4和足量碘化钾(Cr2O72-的还原产物为Cr3+),放于暗处5 min,然后加入100 mL水和淀粉指示剂,用0.1200 mol/L Na2S2O3标准溶液滴定(I2+2S2O32-=2I–+S4O62-)。
④滴定终点的颜色变化是________。
②若实验共用去Na2S2O3标准溶液40.00 mL,则所得产品中重铬酸钾的纯度是_______(滴定过程中其它杂质不参与反应)。
19.(13分)亚硝酸钠(NaNO2)是一种常见的食品添加剂。某实验小组制备NaNO2并对其性质进行探究。
资料:Ag+与NO2–反应,可生成AgNO2白色沉淀或无色配离子。
I.NaNO2的制取(夹持装置略)
实验i
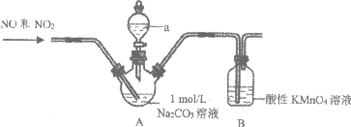
向装置A中通入一段时间N2,再通入NO和NO2混合气体,待Na2CO3反应完全后,将所得溶液经系列操作,得到NaNO2白色固体。
(1)仪器a的名称是________。
(2)制取NaNO2的离子方程式是________。
(3)小组成员推测HNO2是弱酸。为证实推测,向NaNO2溶液中加入试剂X,“实验现象“证实该推测合理,加入的试剂及现象是________。
Ⅱ.NaNO2性质探究
将实验i制取的NaNO2固体配制成0.1 mol/L·NaNO2溶液,进行实验ii和iii。
实验ii
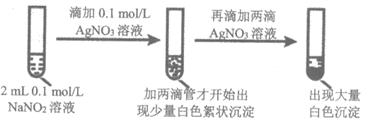
(4)①由实验ii的现象得出结论:白色沉淀的生成与________有关。
②仅用实验ii的试剂,设计不同实验方案进一步证实了上述结论,实验操作及现象是________。
(5)①酸性条件下,NO2–氧化I–的离子方程式是________。
实验iii
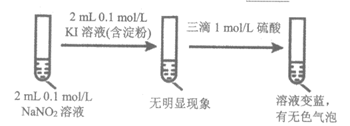
②甲同学认为,依据实验iii的现象可以得出结论:该条件下,NO2–能氧化I–。乙同学则认为A装置中制取的NaNO2含有副产物,仅凭实验iii不能得出上述结论,还需要补充实验iv进行验证,乙同学设计实验iv证明了实验iii条件下氧化I–的只有NO2–,实验iv的实验方案是________。
参考答案
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
答案 | B | A | A | C | A | B | B | D | D | B | C | D | C | C |
阅卷说明:
1.化学方程式评分标准:
(1)化学(离子)方程式中,离子方程式写成化学方程式2分的给1分:化学方程式写成离子方程式的不扣分。
(2)反应物、生成物化学式均正确得1分,有机反应核心物质对可以给1分。
(3)不写条件或未配平,按要求看是否扣分;不写“↑”或“↓”不扣分。
2.简答题的答案仅供参考,逻辑合理即给分。
15.(14分)(除标明的外,其余均为2分)
(1)甲苯(1分)
(2)氧化反应
(3)
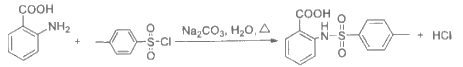
(4)
(5) 13(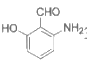 3个官能团10个,
3个官能团10个,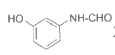 2个官能团3个),
2个官能团3个),
任意写一种(1分)
(6)
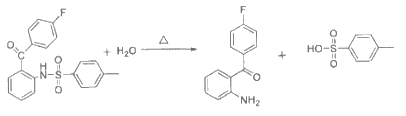
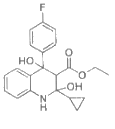
(7)
16.(10分)(除标明的外,其余均为2分)
(1) Cl2+2OH–= Cl–+ClO–+H2O
(2)①C3N3O3Cl3
②H2O
(3)①2ClO2+H2O2+2OH–=2ClO2–+O2+2H2O
②趁热过滤(或高于38℃过滤),乙醇洗涤(各1分)
17.(10分)
(每空均为2分)
(1) -164.9
(2)①p3>p2>p1
②CO2平衡转化率为反应i和反应ii的CO2平衡转化率之和。反应i为放热反应,
随温度升高CO2平衡转化率降低,反应ii为吸热反应,随温度升高CO2平衡转化率升高。温度较高时,CO2平衡转化率主要取决于反应ii。(或:i为放热反应;ii为吸热反应。600℃之后,CO2转化率主要取决于反应ii)
(3) CO2+8e–+8H+=CH4+2H2O
(4) 44.8
18.(11分)(除标明的外,其余均为2分)
(1)+6
(2) 6FeO·Cr2O3 +12Na2CO3+7KClO3=12Na2CrO4+3Fe2O3+12CO2+7KCl
(3) FeO2–+2H2O=Fe(OH)3↓+OH–(合理即可)
(4)增大c(H+),促使平衡Cr2O72-+H2O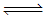 2CrO42-+2H+向逆反应方向移动,将CrO42-转化成Cr2O72-
2CrO42-+2H+向逆反应方向移动,将CrO42-转化成Cr2O72-
(5)①由蓝色变为无色,且半分钟内不变色(1分)
②80%
19.(13分)(除标明的外,每空2分)
(1)分液漏斗(1分)
(2) NO+NO2+CO32-=2NO2–+CO2
(3)无色酚酞,溶液变成红色
(4)①AgNO3溶液或NaNO2溶液的相对用量
②向AgNO3溶液中逐滴滴加NaNO2溶液,先有白色沉淀生成,后沉淀逐渐溶解
(5)①2NO2–+2I–+4H+=2NO↑+I2+2H2O (无色气体写N2也可以)
②取2mL 0.1mol/L NaNO3溶液于试管中,加2mL 0.1mol/L KI溶液(含淀粉),再滴加三滴1mol/L硫酸溶液,溶液没有变蓝(其它合理亦可)