本试卷满分共100分
考试时间90分钟
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S 32 Cl 35.5 Mn55
第一部分
选择题(共42分)
下列各题的四个选项中,只有一个选项符合题意。(每小题3分,共42分)
1. 下列我国古代的技术应用中,不涉及化学反应的是
|
|
|
|
A. 胆矾炼铜 | B. 火药使用 | C. 打磨磁石制指南针 | D. 粮食酿醋 |
2. 下列应用中利用了物质还原性的是
A. 明矾净化水 B. 漂白粉漂白织物
C. 纯碱去油污 D. 铁粉作食品脱氧剂
3. 下列实验中的颜色变化与氧化还原反应有关的是
A. NO2气体溶于水,气体由红棕色变为无色
B. SO2气体通入品红溶液,溶液由红色变为无色
C. KI溶液滴入AgCl浊液中,沉淀由白色逐渐变为黄色
D. KSCN溶液滴入FeCl3溶液中,溶液由棕黄色变为红色
4. 已知1~18号元素的离子aW3+、bX+、cY2-、dZ–都具有相同的电子层结构,下列关系正确的是
A. 质子数c>b B. 离子的还原性Y2->Z–
C. 原子半径X<W D. 氢化物的稳定性H2Y>HZ
5. 下列叙述正确的是
A. 0.5mol/L CuCl2溶液中含有3.01×1023个Cu2+
B. 常温常压下28g CO与22.4 L O2所含分子数相等
C. 相同状况下的12C18O和14N2,若体积相等,则密度相等
D. 等物质的量的—CH3与—OH所含电子数相等
6. 下列离子方程式正确的是
A. 用小苏打治疗胃酸过多:HCO3–+H+===CO2↑+H2O
B. 过量的SO2通入NaOH溶液中:SO2+2H–=SO32-+H2O
C. 稀硝酸与过量的铁屑反应:3Fe+8H++2NO3–=3Fe3++2NO↑+4H2O
D. 氢氧化钡溶液与稀硫酸反应:Ba2++OH–+H++SO42-=BaSO4↓+H2O
7. 下列实验过程可以达到实验目的的是
编号 | 实验过程 | 实验目的 |
A | 称取11.7g固体NaCl置于500mL容量瓶中,加入适量蒸馏水溶解,定容 | 配制0.4mol/L的NaCl溶液 |
B | 常温下,测定等物质的量浓度的盐酸和醋酸溶液的pH | 证明相同条件下,在水溶液中HCl电离程度大于CH3COOH |
C | 向Na2SO3溶液中加入Ba(NO3)2溶液和稀HNO3,观察实验现象 | 检验Na2SO3溶液是否变质 |
D | 无水乙醇与浓H2SO4共热至170℃,将产生的气体通入溴水,观察溴水是否褪色 | 证明乙烯跟溴水发生反应 |
8. 内酯Y可以由X通过电解合成,并可在一定条件下转化为Z,转化路线如下:
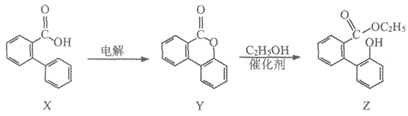
下列说法不正确的是
A. X→Y的反应在电解池阳极发生
B. Y→Z的反应类型是加成反应
C. X、Y、Z中只有Y不能与Na2CO3溶液反应
D. 在催化剂作用下Z可与甲醛发生反应
9. 在大量排放CO2导致全球气候变暖的背景下,以CO2为原料的甲烷催化干重整工艺(DRM)被广泛关注。其主要反应机理如图:
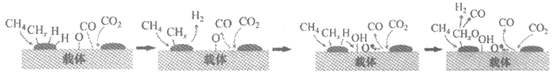
下列关于该过程的说法不正确的是
A. CO2是氧化剂
B. 只有极性键发生断裂
C. 载体没有参与反应
D. 获得的产物可用作燃料、冶炼金属等
10. 一种微生物电池可用于污水净化、海水淡化,其工作原理如图:
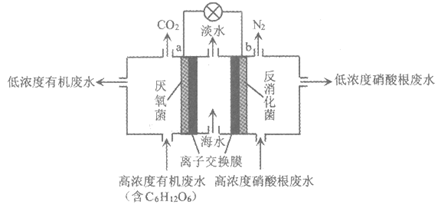
下列说法正确的是
A. a电极作原电池的正极
B. 处理后的硝酸根废水pH降低
C. 电池工作时,中间室的Cl–移向右室,Na+移向左室,实现海水淡化
D. 左室发生反应的电极反应式:C6H12O6-24e–+6H2O=6CO2↑+24H+
11. 以CO2、H2为原料合成CH3OH涉及的主要反应如下:
①CO2(g)+3H2(g)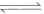 CH3OH(g)+H2O(g) △H1=-49.5 kJ/mol
CH3OH(g)+H2O(g) △H1=-49.5 kJ/mol
②CO(g)+2H2(g)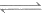 CH3OH(g) △H2=-90.4 kJ/mol
CH3OH(g) △H2=-90.4 kJ/mol
③CO2(g) + H2 (g) CO(g)+ H2O(g) △H3
CO(g)+ H2O(g) △H3
不同压强下,按照n(CO2):n(H2)=1:3投料,CO2平衡转化率随温度变化关系如图。下列说法正确的是
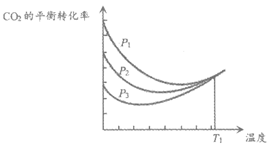
A. △H3=-40. 9kJ/mol
B. p1<p 2<p 3
C. 为同时提高CO2的平衡转化率和CH3OH的平衡产率,反应条件应选择高温、高压
D. T1温度时,三条曲线几乎交于一点的原因是:该温度下,主要发生反应③
12. 常温下,下列说法不正确的是
A. pH均为5的稀盐酸和NH4Cl溶液,由水电离的H+浓度之比为1:104
B. 向水中加入少量NaHSO4固体,c(H+)增大,KW不变
C. 等物质的量浓度的HCOONa和NaF溶液,前者pH较大,则可发生反应:
HCOOH+NaF=HF+HCOONa
D. 等物质的量浓度等体积的CH3COOH和CH3COONa溶液混合后pH约为4.7,则混合液中c(CH3COO–)>c(Na+)>c(H+)>c(OH–)
13. 可用作安全玻璃夹层的高分子PVB的合成路线如下:
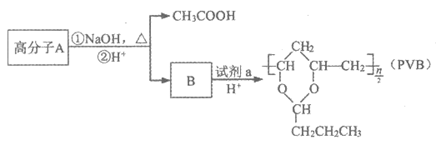
已知:醛与二元醇反应可生成环状缩醛,如: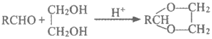
下列说法不正确的是
A. 合成A的聚合反应是加聚反应
B. B易溶于水
C. 试剂a是1-丁醛
D. B与试剂a反应的物质的量之比为2:1
14. 向2 mL1 mol / L淀粉KI溶液中通入SO2,再加入1 mL 1 mol/L盐酸,溶液迅速变黄,塞紧胶塞静置一段时间,溶液变成乳黄色。
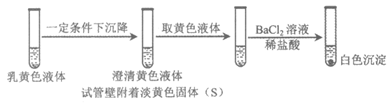
下列说法中不正确的是
资料:SO2+4I–+4H+=S↓+2I2+2H2O
A. 整个反应过程中,KI可能起到了催化剂的作用
B. 该反应能够证明SO2既有氧化性又有还原性
C. 改变c(H+)对反应速率没有影响
D. 结合实验现象可以证明SO2与I–的反应速率小于SO2与I2的反应
第二部分
非选择题(共58分)
15. 锰广泛存在于自然界中,工业可用软锰矿(主要成分是MnO2)制备锰。
资料:1. MnCO3难溶于水,可溶于稀酸。
2. 在Mn2+催化下,SO2在水溶液中被氧化成H2SO4。
I. 制备
(1)写出铝热法还原MnO2制备锰的化学方程式________。
(2)工业上制备锰时,会产生大量废水和锰渣。锰渣煅烧会产生含高浓度SO2的烟气,可用以下方法处理。
处理方法一:
①用软锰矿进行脱硫可生成硫酸锰,从而达到资源的循环使用。写出一定条件下利用MnO2进行脱硫的化学方程式________。
②研究表明,用Fe2+/Fe3+可强化脱硫效果,其过程如下所示:
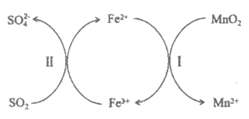
过程:……
过程Ⅱ:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
过程I的离子方程式是_________。
处理方法二:
③用MnCO3进行脱硫,可提高脱硫率。结合化学用语解释原因:_________。
Ⅱ. 废水中锰含量的测定
(3)取1 mL废水置于20mL磷酸介质中,加入HClO4,将溶液中的Mn2+氧化为Mn3+,用c mol/L(NH4)2Fe(SO4)2溶液进行滴定,达到滴定终点时,滴定管刻度由V0 mL变为V1 mL,废水中锰的含量为________ g/mL。
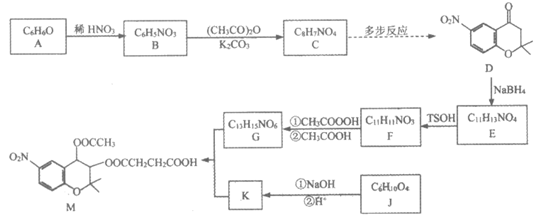
16. 有机化合物M是某抗高血压药物的中间体,其合成路线如图:
已知:
i. 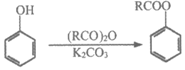
ii. 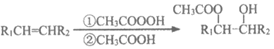
iii. 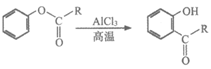
(1)A→B的反应类型是___________。
(2)C中含有的官能团名称是___________。
(3)J中只含有一种官能团,J的名称是___________。
(4)G与K反应生成M的化学方程式是___________。
(5)C→D转化的路线如下图:
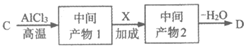
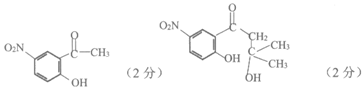
X的分子式为C3H6O,核磁共振氢谱只有一组峰,中间产物1和2的结构简式分别为________、_________。
(6)写出符合下列条件的E的同分异构体的结构简式_________(任意1种即可)。
a. 与NaHCO3反应放出CO2
b. 硝基与苯环直接相连
c. 分子中只有4种不同化学环境的氢原子
17. 保险粉(Na2S2O4)是一种白色粉末,在空气中易被氧化,在强酸性环境中不稳定,遇水自身易发生氧化还原反应。可用作还原剂和漂白剂。
I. 实验室制法
将甲酸钠(易溶于水,微溶于甲醇)、80%甲醇水溶液和NaOH溶液混合,再通入SO2气体,并维持体系弱酸性环境。
(1)补全反应的化学方程式:
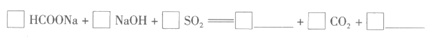
(2)实验中采用80%甲醇水溶液的目的是_________。
(3)反应一段时间后,装置中有白色固体析出,将固体过滤、洗涤、干燥、收集。干燥保险粉的最佳方法_________。(选填字母)
a. 空气中蒸发干燥 b. 真空干燥 c. 氯化氢气流中蒸发干燥
Ⅱ. 工业制法
(4)用惰性电极电解NaHSO3溶液制备Na2S2O4,装置如图所示。写出a电极的电极反应式_________。
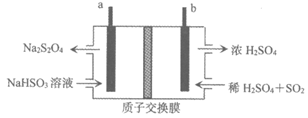
Ⅲ. 制备过程中,产生COD值很高的废水的处理方法
资料:COD为化学需氧量,是表示水中还原性物质多少的一个指标。是指在一定的条件下,采用一定的强氧化剂处理水样时,所消耗的氧化剂量。
在Fe2+催化下,H2O2分解为具有强氧化性的氢氧自由基(· OH),可利用其氧化性氧化水体中的还原性物质,以达到处理COD值很高的废水的目的。
(5)用化学用语表示产生氢氧自由基(· OH)的过程________。
(6)当Fe2+投入量超过一定值,会使得还原性物质的脱除率降低,COD无法达到预期指标。可能的原因是________。
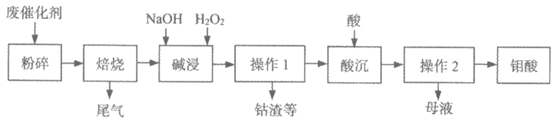
18. 合成氨工业产生的钴钼废催化剂(主要成分MoS2、CoO、Fe2O3等)是一种相当宝贵的二次资源。用碱浸法处理钴钼废催化剂的工艺流程如下:
资料:1. 氧化钼(MoO3):熔点795℃,易升华(即使在低于熔点情况下,也有显著的升华现象)。
2. 钼酸(H2MoO4):难溶于水和酸的黄色晶体,可通过酸化钼酸盐溶液而制得。
(1)焙烧:
①将废催化剂在空气中焙烧可生成氧化钼,写出反应的化学方程式________。
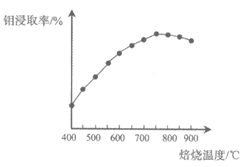
②解释钼浸取率随焙烧温度变化的原因是________。
③氯氧化法吸收SO2废气,可制备硫酸。实际生产中,每小时向反应塔中通入含1%SO2的烟气11200m3(折合成标准状况),从反应塔中排出SO2和Cl2的排放量分别为a kg/h和b kg/h时,反应塔中通入Cl2的量为________kg/h。
(2)碱浸:
碱浸时杂质钴元素以Co(OH)2的形式浸出,加入双氧水可将其氧化为Co(OH)3沉淀。写出反应的化学方程式_________。
(3)酸沉:传统工艺中酸沉多在不锈钢离心机中进行。文献记载,选用浓硝酸比用硫酸和盐酸效果更佳,可避免Mo(Ⅵ)还原成低价态,利用了浓硝酸的_________性。
(4)从母液中获得无水Na2SO4的操作是_________。
19. 某小组为探究Mg与NH4Cl溶液反应机理,常温下进行以下实验。实验中所取镁粉质量均为0.5g,分别加入到选取的实验试剂中。
资料:①CH3COONH4溶液呈中性。
②Cl–对该反应几乎无影响。
实验 | 实验试剂 | 实验现象 |
1 | 5mL蒸馏水 | 反应缓慢,有少量气泡产生(经检验为H2) |
2 | 5mL 1. 0mol/L NH4Cl溶液(pH=4. 6) | 剧烈反应,产生刺激性气味气体和灰白色难溶固体 |
(1)经检验实验2中刺激性气味气体为NH3,检验方法是_________。用排水法收集一小试管产生的气体,经检验小试管中气体为H2。
(2)已知灰白色沉淀中含有Mg2+、OH–。为研究固体成分,进行实验:将生成的灰白色固体洗涤数次,至洗涤液中滴加AgNO3溶液后无明显浑浊。将洗涤后固体溶于稀HNO3,再滴加AgNO3溶液,出现白色沉淀。推测沉淀中含有_________,灰白色固体可能是_________(填化学式)。
(3)甲同学认为实验2比实验1反应剧烈的原因是NH4Cl溶液中c(H+)大,与Mg反应快。用化学用语解释NH4Cl溶液显酸性的原因是________。
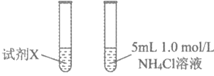
(4)乙同学通过实验3证明甲同学的说法不合理。
实验 | 实验装置 |
3 |
|
①试剂X是_______。
②由实验3获取的证据为_______。
(5)为进一步探究实验2反应剧烈的原因,进行实验4。
实验 | 实验试剂 | 实验现象 |
4 | 5mL NH4Cl乙醇溶液 | 有无色无味气体产生(经检验为H2) |
依据上述实验,可以得出Mg能与NH4+反应生成H2。乙同学认为该方案不严谨,需要补充的实验方案是_______。
(6)由以上实验可以得出的结论是_______。
参考答案
说明:考生答案如与本答案不同,若答得合理,可酌情给分,但不得超过原题所规定的分数。
第一部分
选择题(共42分)
(本题共14小题,每小题3分,共42分)
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
C | D | A | B | D | A | B | B | C | D |
11 | 12 | 13 | 14 | ||||||
D | C | D | C |
第二部分
非选择题(共58分)
15.(10分)
(1)4Al+3MnO2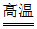 3Mn+2Al2O3(2分)
3Mn+2Al2O3(2分)
(2)①MnO2+SO2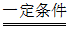 MnSO4(2分)
MnSO4(2分)
②2Fe2++MnO2+4H+=Mn2++2Fe3++2H2O(2分)
③溶液中存在平衡:MnCO3(s) Mn2+(aq)+CO32-(aq),CO32-消耗溶液中的H+,促进SO2溶解:SO2+H2O
Mn2+(aq)+CO32-(aq),CO32-消耗溶液中的H+,促进SO2溶解:SO2+H2O H2SO3,H2SO3
H2SO3,H2SO3 H++HSO3–;生成Mn2+有催化作用,可促进反应2SO2+O2+2H2O
H++HSO3–;生成Mn2+有催化作用,可促进反应2SO2+O2+2H2O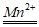 4H++2SO42-发生(2分)
4H++2SO42-发生(2分)
(3)55c(V1-V0)×10-3(2分)
16. (12分)
(1)取代反应(1分)
(2)硝基、酯基(2分)
(3)1,4-丁二酸二甲酯(1分)
(4)

(5)
(6)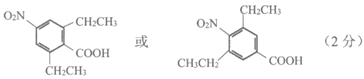
17. (12分)
(1)1 HCOONa+1 NaOH+2SO2=1 Na2S2O4+1 CO2+1 H2O(2分)
(2)溶解反应原料,并且最大限度的减少保险粉遇水反应,提高收率(2分)
(3)b(2分)
(4)2HSO3–+2e–+2H+=S2O42-+2H2O(2分)
(5)H2O2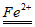 2·OH(2分)
2·OH(2分)
(6)Fe2+消耗·OH,·OH浓度降低(或Fe2+消耗H2O2,使得H2O2分解产生的· OH浓度降低/在测定COD时,Fe2+会消耗更多的氧化剂,使得COD脱除率降低)(2分)
18. (12分)
(1)①2MoS2+7O2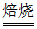 2MoO3+4SO2(2分)
2MoO3+4SO2(2分)
②反应开始时随温度的升高,反应速率加快,钼的浸取率增大;温度高于750℃氧化钼易升华,所以钼的浸取率下降(2分)
③71×(5000-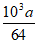 )×10-3+b(2分)
)×10-3+b(2分)
(2)2Co(OH)2+H2O2=2Co(OH)3(2分)
(3)强氧化性(2分)
(4)加热浓缩至有大量固体析出、趁热过滤,过滤出的固体洗涤、干燥,得无水Na2SO4
(2分)
19. (12分)
(1)将湿润的红色石蕊试纸放在试管口,试纸变蓝(2分)
(2)Cl–(1分)
Mg(OH)Cl(1分)
(3)NH4++H2O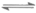 NH3·H2O+H+(2分)
NH3·H2O+H+(2分)
(4)①5mL 1.0mol/L CH3COONH4(2分)
②两试管反应剧烈程度相当(1分)
(5)取5mL无水乙醇,加入0. 5g Mg粉无明显变化(2分)
(6)NH4Cl水解产生的H+对反应影响小,NH4+对反应影响大(1分)