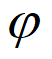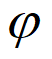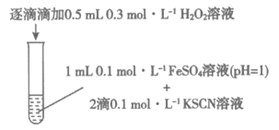本试卷共100分。考试时长90分钟。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Ag 108
第一部分
本部分共14题,每题3分,共42分。在每题列出的4个选项中,选出最符合题目要求的一项。
1. 2020年10月,我国实施嫦娥五号登月计划,实现月球表面无人采样返回。嫦娥五号探测器所用下列构件主要由有机合成材料制造的是

A. 聚酰胺国旗
B. 陶瓷雷达密封环
C. 单晶硅太阳能电池板
D. 铝基碳化硅”挖土”钻杆
2. 下列反应中,水只作氧化剂的是
A. Cl2与水反应 B. Na2O2与水反应
C. CaC2与水反应 D. Fe与水蒸气反应
3. 下列说法不正确的是
A. 新制氢氧化铜可用于区分葡萄糖和蔗糖
B. 酒精可使细菌中的蛋白质变性,起到杀菌消毒的作用
C. 淀粉与纤维素的分子式均可表示为(C6H10O5)n,二者互为同分异构体
D. 其他条件相同时,油脂在碱性条件下的水解程度大于其在酸性条件下的水解程度
4. 下列除杂或鉴别方法利用了氧化还原反应的是
A. 用CuSO4溶液除去乙炔中的H2S
B. 用酸性KMnO4溶液除去CO2中的SO2
C. 用焰色试验鉴别NaCl溶液和KCl溶液
D. 用盐酸鉴别Na2CO3固体和NaOH固体
5. 有机物G是合成药物心律平的中间体,其结构简式如下。下列关于G的说法不正确的是
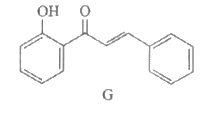
A. 分子式是C15H12O2
B. 存在顺反异构体
C. 能发生还原反应和取代反应
D. 1mol G最多能与2mol Br2发生反应
6. 常温下,下列实验事实能证明醋酸是一元酸的是
A. 0.1 mol·L-1醋酸溶液pH=3
B. 向醋酸钠溶液中滴加酚酞溶液,溶液变红
C. 等物质的量浓度时,醋酸溶液的导电性弱于盐酸
D. 完全中和25mL 0.1 mol·L-1醋酸溶液需要25 mL 0.1 mol·L-1 NaOH溶液
7. 根据下列反应所得结论正确的是
选项 | 反应 | 结论 |
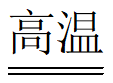
A | SiO2+2C | 非金属性:C>Si |
B | Br2+2I-=2Br-+I2 | 非金属性:Br>I |
C | KCl+Na | 金属性:Na>K |
D | Cu+2Fe3+=2Fe2++Cu2+ | 金属性:Fe>Cu |
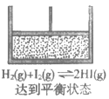
8. 一定温度下,将气体X和Y各0.4 mol充入2L恒容密闭容器中,发生反应:X(g)+Y(g) M(g)+N(g),K=1。其中Y呈红棕色,其他气体均无色。下列事实不能说明反应达到平衡状态的是
M(g)+N(g),K=1。其中Y呈红棕色,其他气体均无色。下列事实不能说明反应达到平衡状态的是
A. 容器内气体颜色保持不变
B. 容器内气体密度保持不变
C. c(X)=c(N)=0.1 mol·L-1
D. X的转化率达到50%
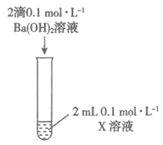
9. 下列实验中相关反应的离子方程式书写不正确的是
装置 | 编号 | 溶质X |
| ① | H2SO4 |
② | CuSO4 | |
③ | NaHCO3 | |
④ | KAl(SO4)2 |
A. ①Ba2++OH-+H++SO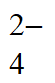 =BaSO4↓+H2O
=BaSO4↓+H2O
B. ②Ba2++2OH-+Cu2++SO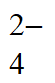 =BaSO4↓+Cu(OH)2↓
=BaSO4↓+Cu(OH)2↓
C. ③Ba2++2OH-+2HCO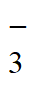 =BaCO3↓+2H2O+CO
=BaCO3↓+2H2O+CO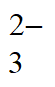
D. ④3Ba2++6OH-+2Al3++3SO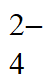 =3BaSO4↓+2Al(OH)3↓
=3BaSO4↓+2Al(OH)3↓
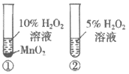
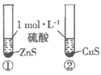
10. 根据下列实验所得结论正确的是
选项 | A | B | C | D |
装置 |
|
|
|
|
现象 | ①中产生大量气泡 ②中无明显现象 | 试管中溶液出现浑浊 | ①中固体溶解 ②中固体不溶解 | 压缩体积, 气体颜色加深 |
结论 | MnO2是H2O2 分解的催化剂 | 酸性:碳酸>苯酚 | ZnS的溶解度大于CuS | 增大压强,上述平衡逆向移动 |
11. 常温下,用0.10 mol·L-1NaOH溶液滴定10 mL 0.10 mol·L-1H2A溶液,测得滴定曲线如下。下列说法正确的是
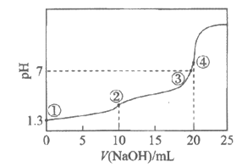
A. 溶液①中H2A的电离方程式是H2A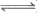 2H++A2-
2H++A2-
B. 溶液②中c(HA-)=c(A2-)>c(H2A)
C. 溶液③中c(Na+)=c(HA-)+c(A2-)
D. 溶液④中2c(Na+)=c(A2-)+c(HA-)+c(H2A)
12. 塑料PET的一种合成路线如下图所示,其中①和②均为可逆反应。
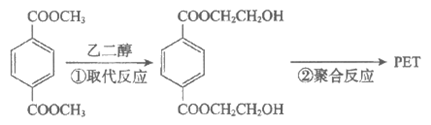
下列说法不正确的是
A. PET在一定条件下可降解成单体
B. ①中可通过蒸馏分离出CH3OH提高反应物的转化率
C. 依据①推测PET的结构简式为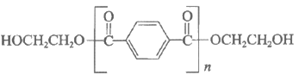
D. 该合成路线中乙二醇可循环使用
13. 我国科学家利用Na2CO3和碳纳米管组装”无Na预填装”的Na-CO2二次电池(如下图所示)。b电极中的碳纳米管可作导体、反应物和CO2通道等。电池的总反应2Na2CO3+C 3CO2↑+4Na
3CO2↑+4Na
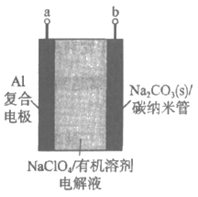
下列关于该电池的说法不正确的是
A. 不能用水配制电解液
B. 电池组装后,在使用前必须先充电
C. 放电时,电解液中的Na+向a电极移动
D. 充电时,b极反应为2Na2CO3+C-4e-=4Na++3CO2↑
14. 用下图装置探究铜与硝酸的反应,实验记录如下:
装置 | 步骤 | 操作 | 现象 |
| ① | 打开止水夹,挤压胶头,使浓硝酸滴入试管 | 产生红棕色气体,溶液变为绿色 |
② | 一段时间后,关闭止水夹,推动注射器活塞使部分水进入试管 | 注射器内剩余的水被”吸入”试管;铜表面产生无色气泡,溶液变蓝,试管内气体逐渐变为无色 | |
③ | 一段时间后,打开止水夹,拉动注射器活塞吸取少量无色气体;拔下注射器,再拉动活塞吸入少量空气 | 注射器中无色气体变为红棕色 |
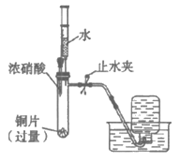
下列说法不正确的是
A. ①中反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+2NO2+2H2O
B. ②中注射器内剩余的水被”吸入”试管的原因可能是NO2与H2O反应导致压强减小
C. ③中的实验现象能证明②中Cu与硝酸反应生成了NO
D. 待②中反应停止后,向试管内滴加少量稀硫酸,有气体产生
第二部分
本部分共5题,共58分。
15. (10分)开发利用核能可以减少对化石能源的依赖。UO2是一种常用的核燃料,其铀元素中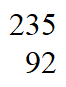 U需达到5%。该核燃料的一种制备流程如下:
U需达到5%。该核燃料的一种制备流程如下:
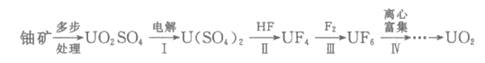
(1)天然铀主要含99.3%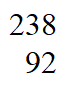 U和0.7%
U和0.7%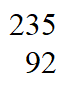 U,
U,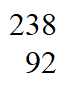 U和
U和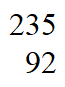 U互为_______________。
U互为_______________。
(2)Ⅰ中,将含有硫酸的UO2SO4溶液通入电解槽,如下图所示。
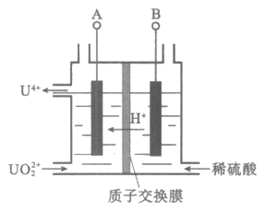
①A电极是____________(填”阴极”或”阳极”),其电极反应式是_____________。
②U4+有较强的还原性。用质子交换膜隔开两极区溶液可以_______________,从而提高U4+的产率。
(3)Ⅲ中使用的F2可通过电解熔融KF、HF混合物制备,不能直接电解液态HF的理由是HF属于______________化合物,液态HF几乎不电离。
(4)Ⅳ中利用了相对分子质量对气体物理性质的影响。铀的氟化物的熔沸点如下:
UF4 | UF6 | |
熔点/℃ | 1036 | 64(150kPa) |
沸点/℃ | 1417 | 56.5升华 |
①离心富集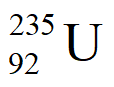 时,采用
时,采用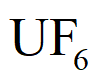 的优点:
的优点:
a. F只有一种核素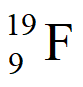 ,且能与U形成稳定的氟化物;
,且能与U形成稳定的氟化物;
b. ______________。
②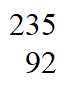 UF6和
UF6和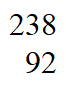 UF6的相对分子质量之比约为____________(列出计算表达式)。
UF6的相对分子质量之比约为____________(列出计算表达式)。
16. (12分)有机物K是合成一种治疗老年性白内障药物的中间体,其合成路线如下。
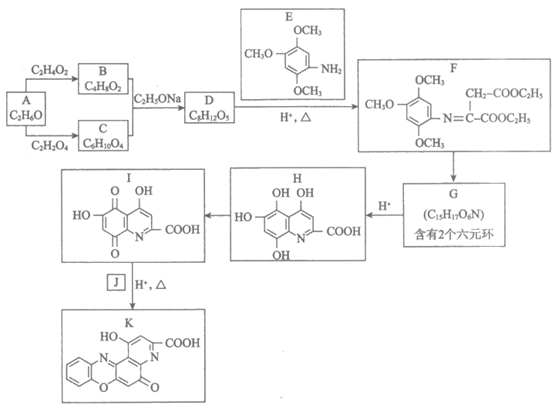
已知:
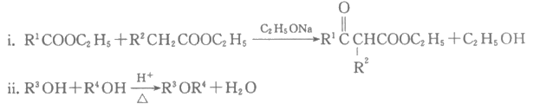
(1)由A制C2H5ONa的化学方程式是__________________。
(2)B的同分异构体中,与B具有相同官能团的有____________种。
(3)B+C→D的化学方程式是___________________。
(4)官能团转化是有机反应的核心。D中____________(填官能团名称,下同)和E中____________相互反应生成F。
(5)G的结构简式是___________________。
(6)J的结构简式是_________________。
17. (12分)实验室研究从医用废感光胶片中回收银的方法。
(1)银的浸出
Ⅰ. 两步法: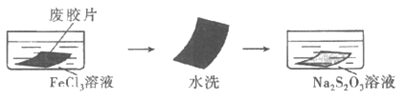
已知:i. FeCl3溶液与Na2S2O3溶液直接混合能发生氧化还原反应;
ii. Ag++2S2O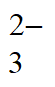
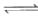 [Ag(S2O3)2]3-,K=3×1013。
[Ag(S2O3)2]3-,K=3×1013。
①FeCl3溶液将胶片上的单质银转化为AgCl,其离子方程式是_____________________。
②Na2S2O3溶液能溶解AgCl并得到含[Ag(S2O3)2]3-的浸出液。结合平衡移动原理解释AgCl溶解的原因:_____________________________。
Ⅱ. 一步法:用水溶解FeCl3和乙二胺四乙酸二钠(用Na2H2Y表示)的混合固体,调节pH形成[FeY]-溶液,再加入一定量Na2S2O3,配成浸取液。将废感光胶片浸入浸取液中,发生反应:
[FeY]-+Ag+2S2O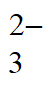 =[FeY]2-+[Ag(S2O3)2]3-
=[FeY]2-+[Ag(S2O3)2]3-
③从物质氧化性或还原性的角度分析加入Na2H2Y的作用:_____________________。
(2)银的还原
调节(1)所得浸出液的pH,向其中加入KBH4溶液(B的化合价为+3)至不再产生黑色沉淀,过滤得到粗银;滤液中的S2O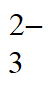 可以循环使用。补全离子方程式:
可以循环使用。补全离子方程式:
BH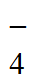 +□[Ag(S2O3)2]3-+□___________=[B(OH)4]-+□__________+□________+□H2O
+□[Ag(S2O3)2]3-+□___________=[B(OH)4]-+□__________+□________+□H2O
(3)银浸出率的测定
称取m1 g洗净干燥的原胶片,灼烧灰化后用HNO3溶解,过滤。滤液用c mol·L-1 NH4SCN标准溶液滴定至终点,消耗标准溶液V1 mL。另取m2g洗净干燥的浸取后胶片,用同样方法处理,滴定,消耗NH4SCN标准溶液V2mL。
(已知:Ag++SCN-=AgSCN↓)
①银的浸出率= =__________
=__________
(列出计算表达式)。
②实验发现在浸取试剂均过量、浸取时间足够长的情况下,与Ⅱ相比,Ⅰ中银的浸出率明显偏低,其原因可能是___________________。
18. (11分)乙二醇是一种重要的基本化工原料。煤制乙二醇的工艺流程如下:
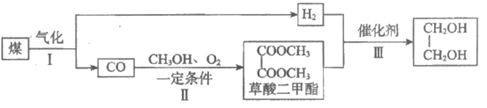
(1)Ⅰ中气化炉内的主要反应有:
i. C(s)+H2O(g) CO(g)+H2(g)
CO(g)+H2(g)
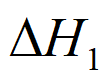 =+131kJ·mol-1
=+131kJ·mol-1
ii. CO(g)+H2O(g)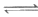 CO2(g)+H2(g)
CO2(g)+H2(g)
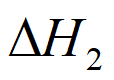 =-41kJ·mol-1
=-41kJ·mol-1
①写出CO2被C还原成CO的热化学反应方程式:_________________。
②其他条件相同时,增大气化炉内水蒸气的分压P(混合气体中某气体的分压越大,表明其浓度越大),达到平衡时各组分的体积分数(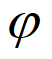 )如下表所示。解释出现该变化趋势的可能原因是________________________________。
)如下表所示。解释出现该变化趋势的可能原因是________________________________。
P/MPa |
|
|
|
0.017 | 15.79 | 31.50 | 51.23 |
0.041 | 19.52 | 27.12 | 52.04 |
0.065 | 21.15 | 23.36 | 54.14 |
0.088 | 21.64 | 21.72 | 55.46 |
(2)Ⅱ的总质量是 ,该过程分两步进行。
,该过程分两步进行。
第一步为CO与亚硝酸甲酯(CH3ONO)在Pd催化剂作用下发生反应:
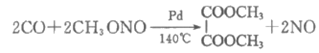
第二步为常温常压下利用NO、CH3OH和O2进行的CH3ONO再生反应。
①第二步反应的化学方程式是________________________。
②第一步反应的机理如图所示,下列说法正确的是______________(填字母序号)。
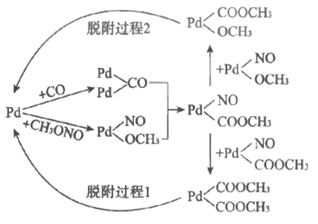
a. CH3ONO中氮氧双键在Pd表面断裂
b. 脱附过程1生成了草酸二甲酯
c. 脱附过程2生成了副产物碳酸二甲酯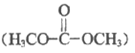
d. 增大投料比[n(CO):n(CH3ONO)],可提高最终产物中草酸二甲酯的比率
③第一步反应时,若CO中混有少量H2,H2在Pd表面易形成Pd—H中间体,结合第一步反应机理,推测因H2导致生成的副产物有_____________、_______________。
(3)Ⅲ中,草酸二甲酯经过催化氢化可生成乙二醇和甲醇。
理论上,该反应中n(草酸二甲酯):n(氢气)=_______________。
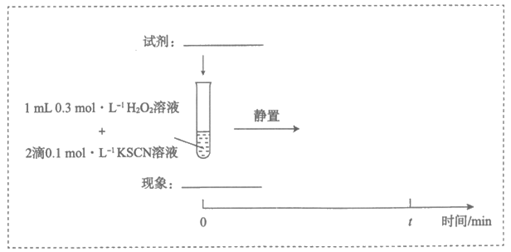
19. (13分)某小组在验证H2O2氧化Fe2+时发现异常现象,并对其进行深入探究。
实验Ⅰ:
装置与操作 | 现象 |
| 溶液立即变红, 继续滴加H2O2溶液, 红色变浅并逐渐褪去 |
(1)实验Ⅰ中溶液变红是因为Fe3+与SCN-发生了反应,其离子方程式是___________________。
(2)探究实验Ⅰ中红色褪去的原因:取反应后溶液,______________(填实验操作和现象),证明溶液中有Fe3+,而几乎无SCN-。
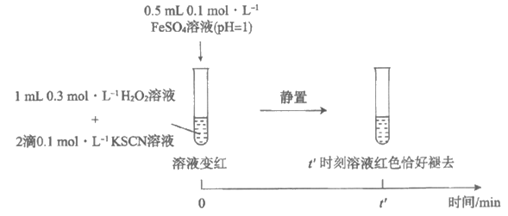
(3)研究发现,酸性溶液中H2O2能氧化SCN-,但反应很慢且无明显现象,而实验Ⅰ中褪色相对较快,由此推测Fe3+能加快H2O2与SCN-的反应。通过实验Ⅱ和Ⅲ得到了证实。参照实验Ⅱ的图例,在虚线框内补全实验Ⅲ。
实验Ⅱ:
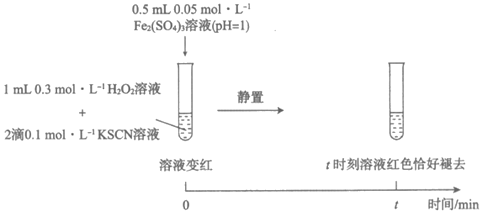
实验Ⅲ:
(4)查阅资料:Fe3+加快H2O2与SCN-反应的主要机理有
i. Fe3++H2O2=Fe2++HO2·+H+
ii. Fe2++H2O2=Fe3++·OH+OH-
iii. ·OH(羟基自由基)具有强氧化性,能直接氧化SCN-
为探究Fe2+对H2O2与SCN-反应速率的影响,设计实验如下:
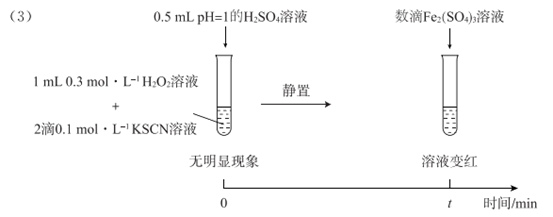
实验Ⅳ:
① 。对比实验Ⅳ和Ⅱ可得出结论:在本实验条件下,__________________。
。对比实验Ⅳ和Ⅱ可得出结论:在本实验条件下,__________________。
②结合资料和(1)~(4)的研究过程,从反应速率和化学平衡的角度解释实验Ⅰ中溶液先变红后褪色的原因:_____________________。
③实验Ⅰ~Ⅳ中均有O2生成,小组同学推测可能是HO2·与溶液中其他微粒相互作用生成的,这些微粒有_______________。
【试题答案】
注:学生答案与本答案不符时,合理答案给分。
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
答案 | A | D | C | B | D | D | B |
题号 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
答案 | B | A | C | B | C | C | C |
15.(10分)
(1)同位素
(2)①阴极 UO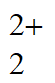 +4H++2e-=U4++2H2O
+4H++2e-=U4++2H2O
②防止U4+移动到阳极附近被氧化
(3)共价
(4)①b. UF6易升华,56.5℃以上为气态
②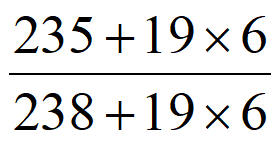 或
或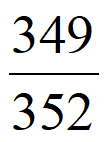
16. (12分)
(1)2C2H5OH+2Na→2C2H5ONa+H2↑
(2)3
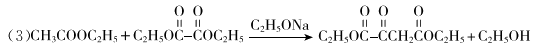
(4)羰基
氨基
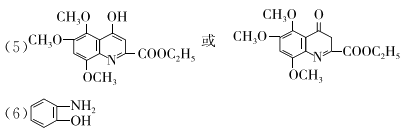
17.(12分)
(1)①Fe3++Cl-+Ag=AgCl+Fe2+
②体系中存在AgCl(s) Ag+(aq)+Cl-(aq),S2O
Ag+(aq)+Cl-(aq),S2O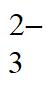 与Ag+结合成
与Ag+结合成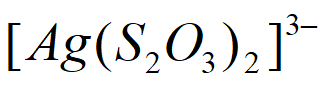 ,使c(Ag+)降低,平衡正向移动,AgCl溶解
,使c(Ag+)降低,平衡正向移动,AgCl溶解
③Na2H2Y将Fe3+转化为[FeY]-,氧化性降低,避免S2O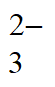 被氧化
被氧化
(2)BH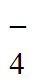 +8[Ag(S2O3)2]3-+8OH-=[B(OH)4]-+8Ag↓+16S2O
+8[Ag(S2O3)2]3-+8OH-=[B(OH)4]-+8Ag↓+16S2O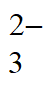 +4H2O
+4H2O
(3)①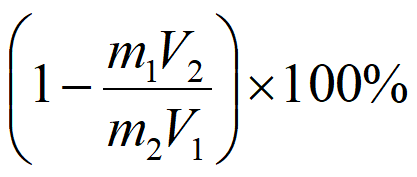
②Ⅰ中第一步反应生成的AgCl附着在Ag表面,阻碍FeCl3继续与Ag反应,未被氧化的Ag无法在第二步被浸出
18.(11分)
(1)① CO2(g)+C(s)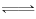 2CO(g)
2CO(g)
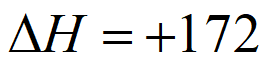 kJ·mol
kJ·mol
②随着气化炉内水蒸气分压增大,水蒸气浓度增大,使反应i、ii的平衡均正向移动,且ii中平衡移动的程度更大
(2)①4NO+4CH3OH+O2→4CH3ONO+2H2O
②bcd
③CH3OH HCOOCH3
(3)1:4
19.(13分)
(1)Fe3++3SCN- Fe(SCN)3
Fe(SCN)3
(2)滴加KSCN溶液,溶液变红
(4)①Fe2+也能加速H2O2与SCN-反应,且效果比Fe3+更好
②刚滴入H2O2时,ii反应速率快,生成的Fe3+迅速与SCN-结合,溶液立即变红;继续滴加H2O2,c(·OH)升高,加快·OH氧化SCN-,使c(SCN-)降低,
Fe3++3SCN-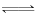 Fe(SCN)3平衡逆向移动,红色褪去
Fe(SCN)3平衡逆向移动,红色褪去
③·OH、H2O2、Fe3+

 Si
Si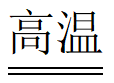 K
K