本试卷满分共100分 考试时间 90分钟
可能用到的相对原子质量:H1 C12 N14 O16 Fe56 Mn55
第一部分
本部分共14小题,每小题3分,共42分。在每小题列出的四个选项中,选出最符合题目要求的一项。
1.2020年2月4日投入使用的武汉火神山医院在建设中使用了大量建筑材料。下列主要成分为无机非金属材料的是
|
|
|
|
A.瓷砖 | B.硫氧镁彩钢板 | C.塑料管道 | D.螺纹钢 |
2.下列化学用语或图示表达正确的是
A.乙烯的结构式是CH2 =CH2
B.质量数为3的氢原子是31H
C.钠离子的结构示意图是
D. CO2的电子式是
3.下列说法不正确的是
A.毛发和蚕丝的主要成分都是蛋白质
B.天然气和沼气的主要成分都是甲烷
C.油脂氢化、氨基酸形成多肽、蛋白质水解都属于取代反应
D.氨基乙酸、乙醛、乙二醇均可发生聚合反应
4.下列各项比较中,一定相等的是
A.等物质的量的OH–和-OH中所含电子数
B.等质量的氧气和臭氧中含有的氧原子数目
C.1 mol Na2O2固体中阳离子与阴离子的数目
D.等物质的量的Cu与Fe分别与足量的稀硝酸反应时转移的电子数
5.根据元素周期律判断,不正确的是
A.酸性:H3PO4> H2SO4
B.稳定性:HF>HCl
C.原子半径:Na>S
D.失电子能力:Ca>Mg
6.下列实验对应的化学用语正确的是
A.FeSO4溶液中滴加NaOH溶液,在空气中静置后:Fe2+ +2OH–=Fe(OH)2↓
B.酸性氯化亚铁溶液中加入双氧水:2Fe2++H2O2 =2Fe3++O2↑+2H+
C.AgCl悬浊液中滴入Na2S溶液:2Ag+ +S2- =Ag2S ↓
D.澄清石灰水中加入过量NaHCO3溶液:Ca2+ +2OH– +2HCO3 =CaCO3– ↓+2H2O+CO32-
7.反应条件会影响化学反应产物或现象。下列有关影响因素的分析不正确的是
选项 | 反应物 | 反应产物或现象 | 影响因素 |
A | C2H5OH、浓硫酸 | C2H4或乙醚 | 温度 |
B | Fe、H2SO4 | 有H2或无H2 | H2SO4的浓度 |
C | Na、O2 | Na2O或Na2O2 | O2用量 |
D | AgNO3溶液、氨水 | 现象不同 | 试剂滴加顺序 |
8.工业排放的对苯二甲酸回收困难,经研究采用ZnO为催化剂,催化脱羧制备苯,脱羧反应机理如下。下列说法中不正确的是
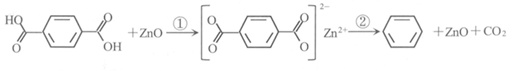
A.过程①中断开O-H键需要吸收能量
B.过程②中断开C-C键,形成C-H键
C.对苯二甲酸在脱羧反应中被还原为苯
D.ZnO能降低对苯二甲酸脱羧反应的焓变
9. PTMC 属于可降解脂肪族聚酯,在药物释放、医疗器械等生物医学领域有广泛的应用。PTMC由X[ ]、Y(HOCH2CH2CH2OH)、Z[
]、Y(HOCH2CH2CH2OH)、Z[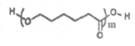 ]反应而成,其结构如下。下列说法正确的是
]反应而成,其结构如下。下列说法正确的是
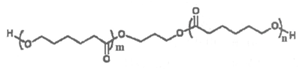
A. X与Z单体相同
B. X与Z互为同分异构体
C.生成PTMC的反应为缩聚反应
D. 1 mol PTMC完全水解需要消耗(m+n-1) mol NaOH
10.直接碳固体氧化物燃料电池作为全固态的能量转换装置,采用固体碳作为燃料,以多孔Pt作电极、氧化锆为电解质,其工作原理如下图。下列说法不正确的是
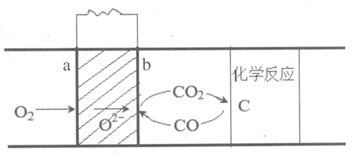
已知:CO2(g)+C(s)= =2CO(g) △H = +172.5 kJ·mol-1
CO(g)+1/2O2(g) =CO2(g) △H=-283kJ·mol-1
A.电极a为正极,电子由b经过导线到a
B.电极b发生的电极反应为:CO+O2--2e– =CO2
C.依据装置原理可推测,该条件下CO放电比固体C更容易
D.若1 mol C(s)充分燃烧,理论上放出的热量为110.5 kJ
11.由下列实验及现象推出相应结论正确的是
选项 | 实验 | 现象 | 结论 |
A | 某溶液中加入Ba(NO3)2溶液,再加足量盐酸 | 先有白色沉淀生成,加盐酸后白色沉淀不消失 | 原溶液中有SO42- |
B | 将湿润的淀粉碘化钾试纸放在盛有红棕色气体的集气瓶口 | 试纸变蓝 | 红棕色气体为溴蒸气 |
C | 将碳酸钠与盐酸反应产生的气体通入盛有硅酸钠溶液的烧杯中 | 烧杯中液体变浑浊 | 非金属性:Cl> C>Si |
D | 将0.1mol/L MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol/L CuSO4溶液 | 先有白色沉淀生成,后转变为蓝色沉淀 | 溶解度:Cu(OH)2 <Mg(OH)2 |
12. 已知常温下,3种物质的电离平衡常数如下表:
物质 | HCOOH | CH3COOH | NH3·H2O |
电离平衡常数K | 1.77×10-4 | 1.75×10-5 | 1.76×10-5 |
下列说法不正确的是
A.等物质的量浓度时,溶液pH:HCOONa< CH3COONa
B. pH均为3时,溶液浓度:c(HCOOH)> c(CH3COOH)
C. HCOOH溶液与氨水混合,当溶液pH=7时,c(HCOO–)=c(NH4+)
D.等物质的量浓度等体积的CH3COOH溶液和氨水混合,溶液pH约为7
13.在一定温度下,将气体X和气体Y各0.4 mol充入4 L恒容密闭容器中,发生反应:X(g)+Y(g) 2Z(g) △H<0。一段时间后达到平衡,反应过程中测定的数据如下表,下列说法不正确的是
2Z(g) △H<0。一段时间后达到平衡,反应过程中测定的数据如下表,下列说法不正确的是
t/min | 2 | 4 | 10 | 15 |
n(Y)/mol | 0.32 | 0.28 | 0.20 | 0.20 |
A.反应前4 min平均速率v(X)= 7.5×10-3 mol·L-1·min-1
B.该温度下此反应的平衡常数:K=20
C.其他条件不变,降低温度,反应达到新平衡前:v(逆)<v(正)
D.保持其他条件不变,起始时向容器中充入0.8 mol 气体X和0.8 mol 气体Y,到达平衡时,Y的转化率为50%
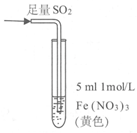
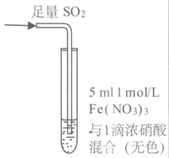
14.某小组同学探究SO2与Fe3+盐溶液的反应,进行了如下实验:
已知:Fe3++HSO3– Fe(HSO3)2+(红棕色)
Fe(HSO3)2+(红棕色)
实验 | ① | ② | ③ |
操作 |
|
|
|
现象 | 溶液中立即产生大量红棕色物质,无丁达尔现象;5h后,溶液变为浅黄色,加入铁氰化钾溶液,产生蓝色沉淀 | 溶液中立即产生大量红棕色物质,无丁达尔现象;5h后,溶液几乎无色,加入铁氰化钾溶液,产生大量蓝色沉淀 | 溶液中立即产生大量红棕色物质,无丁达尔现象;5h后,溶液变为黄色(比①深),加入铁氰化钾溶液,产生蓝色沉淀 |
结合上述实验,下列说法不正确的是
A.产生红棕色物质的反应速率快于SO2与Fe3+ 氧化还原反应的速率
B.①与②对照,说明阴离子种类对SO2与Fe3+ 氧化还原反应的速率有影响
C. Fe(NO3)3溶液中加入1滴浓硝酸后变为无色,说明浓硝酸具有漂白性
D.5 h后③比①黄色更深不能证明是NO3–浓度的增大减慢了SO2 与Fe3+反应的速率
第二部分
本部分共5小题,共58分。
15. (9分)乙醇俗称酒精,在生活中使用广泛。
资料1 乙醇分子有两个末端,一端是憎水(易溶于油)的-C2H5;一端是亲水(易溶于水)的-OH。
资料2 破坏蛋白质分子中形成蜷曲和螺旋的各种力,使长链舒展、松驰,可导致蛋白质变性。
资料3 水分子可以松弛蛋白质外部亲水基团之间的吸引力,而-OH不能;-C2H5可以破坏蛋白质内部憎水基团之间的吸引力。
(1)乙醇的结构及性质
①1mol乙醇分子中的极性共价键有_________mol。
②从结构角度解释乙醇的沸点比乙烷高的原因__________。
(2)乙醇的用途
①医用酒精(75%)制备过程与制酒的过程类似,不能饮用,但可接触人体医用。
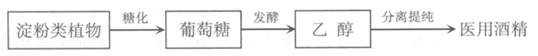
结合题中资料,下列说法正确的是__________(填字母)。
a.糖化、发酵的过程均含有化学变化
b.获得医用酒精常采用的分离提纯方法是蒸馏
c.浓度99%的酒精消毒杀菌效果一定大于75%的酒精
②乙醇是一种很好的溶剂,在油脂的皂化反应中,加入乙醇可加快反应速率,其原因是___________。
(3)乙醇的工业制取
乙醇的工业制取方法很多,由碳的氧化物直接合成乙醇燃料已进入大规模生产。下图是由二氧化碳合成乙醇的工艺流程。
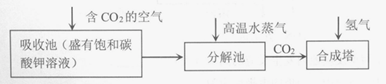
该流程中能循环使用的物质是___________。
16.(10分)加工含硫原油时,需除去其中含硫物质。
(1)铁离子浓度是原油加工中防腐监测的重要指标。测定铁离子浓度前,需去除原油加工产生的酸性废水中的硫化氢及其盐。实验室模拟过程如下。
I.将250 mL酸性废水置于反应瓶中,加入少量浓盐酸,调节pH小于5。
II.在吸收瓶中加入饱和氢氧化钠溶液。
III.打开脱气—吸收装置,通入氮气,调节气流速度,使气体依次经过反应瓶和吸收瓶。当吹出气体中H2S体积分数达到标准,即可停止吹气。
已知:含硫微粒的物质的量分数(δ)随pH变化情况如下图所示。
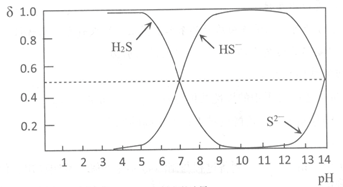
①步骤I中加入浓盐酸调节pH<5的原因是____________。
②当测定吸收液的pH为____________时,需要更换NaOH溶液。
③利用邻菲罗啉分光光度法可测定样品中的含铁量。测定前需用盐酸羟基胺(NH2OH·HCl)将Fe3+还原为Fe2+。将下述离子方程式补充完整:
______Fe3++_____ NH2OH·HCl →_____Fe2++N2↑+_____+_____+____Cl–
(2)原油中的硫化氢还可采用电化学法处理,并制取氢气,其原理如下图所示。
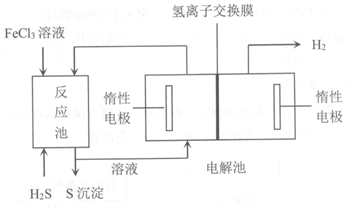
①写出反应池内发生反应的离子方程式___________。
②电解池中,阳极的电极反应为___________。
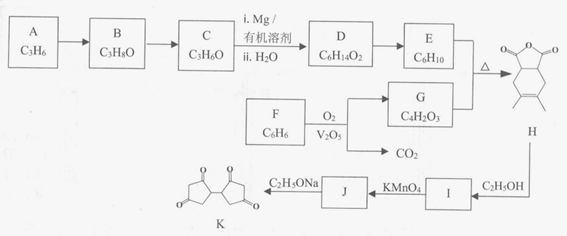
17. (15分)有机物K是一种化工原料,其合成路线如下:
已知:i.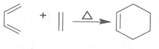
ii. 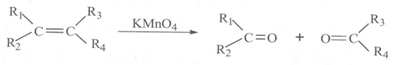
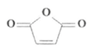
iii.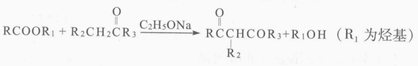
(1)按照官能团分类,A的类别是___________。
(2) C分子中只有一种类型的氢原子,B→C的化学方程式是___________。
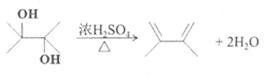
(3) 已知D的核磁共振氢谱有2个吸收峰,1 mol D与足量Na反应可生成1 molH2,写出D→E的化学方程式是___________。
(4)G的结构简式是___________。
(5)由F制备G,产物G与CO2物质的量之比为___________。
(6)M是G的同分异构体,写出符合下列条件的M的结构简式__________。
a.能与NaHCO3反应产生气泡
b.能发生银镜反应
(7)写出结构简式:I__________ J__________
18.(11分)高铁酸钾(K2FeO4)是一种安全性很高的水处理剂,其合成的部分流程如下。
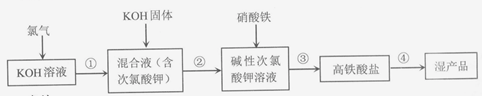
资料:
i.高铁酸钾可溶于水,微溶于浓KOH溶液,在碱性溶液中较稳定,在酸性或中性溶液中快速与水反应产生O2,且+3价铁能催化该反应。
ii.次氯酸钾容易分解,2KClO=2KCl+O2。
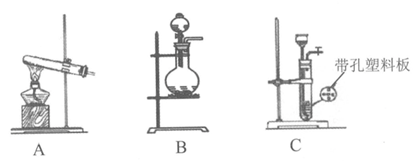
(1)实验室使用高锰酸钾与浓盐酸制备氯气时,应选择下列装置中的____________。
(2)写出步骤①的离子反应方程式____________。
(3)加入KOH固体是为了过滤除盐,过滤除去的是____________。
(4)相同投料比、相同反应时间内,反应温度对高铁酸钾产率的影响如图1所示,请分析高铁酸钾产率随温度变化的原因:___________。
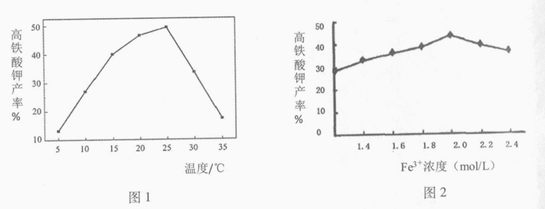
(5)相同投料比、相同反应时间内,硝酸铁浓度对产率的影响如图2所示,当Fe3+浓度大于2.0 mol/L时,高铁酸钾产率变化的原因可能是____________。
(6)高铁酸钾可用于除去水体中Mn(+2价),生成Mn(+4价)和Fe(+3价)。一定条件下,除去水体中1.1g Mn(+2价),当去除率为90%时,消耗高铁酸钾的物质的量为___________mol。
19.(13分)某小组探究酸化条件对0.1 mol/L KI溶液氧化反应的影响。
序号 | 操作及现象 |
实验1 | 取放置一段时间后依然无色的0.1 mol/L KI溶液,加入淀粉溶液,溶液不变蓝;向溶液中继续加入2滴6 mol/L的稀硫酸,溶液立即变蓝 |
实验2 | 取新制的0.1 mol/L KI溶液,加入淀粉溶液,溶液不变蓝;向溶液中继续加入2滴6mol/L的稀硫酸,溶液10s后微弱变蓝 |
(1)溶液变蓝,说明溶液中含有_________。结合实验1和实验2,该小组同学认为酸化能够加快I–氧化反应的速率。
(2)同学甲对滴加稀硫酸后溶液变蓝速率不同的原因提出猜想:放置一段时间后的0.1 mol/L KI溶液成分与新制0.1 mol/L KI溶液可能存在差异,并继续进行探究。
实验3:取新制0.1 mol/L KI溶液在空气中放置,测得pH如下:
时间 | 5分钟 | 1天 | 3天 | 10天 |
pH | 7.2 | 7.4 | 7.8 | 8.7 |
资料:i.pH<11.7时,I–能被O2氧化为I2。
ii.一定碱性条件下,I2容易发生歧化,产物中氧化产物与还原产物的物质的量之比为1:5。
①用化学用语解释0.1 mol/L KI溶液放置初期pH升高的原因:_________________。
②对比实验1和实验2,结合化学用语和必要的文字,分析实验1中加稀硫酸后”溶液立即变蓝”的主要原因可能是__________。
(3)同学甲进一步设计实验验证分析的合理性。
序号 | 操作 | 现象 |
实验4 | 重复实验2操作后,继续向溶液中加入__________。 | 溶液立即变蓝 |
(4)该组同学想进一步探究 pH对I2发生歧化反应的影响,进行了如下实验。
实验5:用20 ml 4种不同浓度的KOH溶液与2 ml淀粉溶液进行混合,测量混合液的pH后,向其中加入2滴饱和碘水,观察现象。记录如下:
实验组 | A | B | C | D |
pH | 11.4 | 10.6 | 9.5 | 8.4 |
现象 | 无颜色变化 | 产生蓝色后瞬间消失 | 产生蓝色,30s 后蓝色消失 | |
①从实验5可以看出pH越大,歧化反应速率越__________(填”快”或”慢”)。
②解释pH=8.4时,”产生蓝色,30s后蓝色消失”的原因:__________。
参考答案
第一部分
本部分共14小题,每小题3分,共42分。在每小题列出的四个选项中,选出最符合题目要求的一项。
1 | 2 | 3 | 4 | 5 | 6 | 7 |
A | B | C | B | A | D | C |
8 | 9 | 10 | 11 | 12 | 13 | 14 |
D | A | D | D | B | B | C |
第二部分
本部分共5小题,共58分。
15.(9分)
(1)①7 ②乙醇分子中含有羟基,分子之间能形成氢键
(2)①a b ②增大反应物的接触几率或接触面积
(3) K2CO3或碳酸钾
16. (10分)
(1)①可将硫元素全部转化为H2S吹出
②9~11均可
③2Fe3+ + 2NH2OH·HC1 =2Fe2++N2↑+4H++2H2O+2Cl–
(2)①2Fe3+ + H2S = 2Fe2+ +S↓ +2H+
②Fe2+-e– =Fe3+
17. (15分)
(1)烯烃
(2)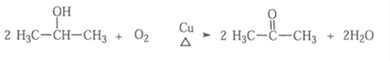
(3)
(4)
(5)1:2
(6)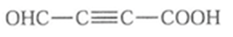
(7) I: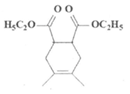 J:
J: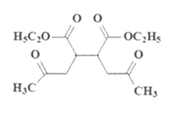
18.(11分)
(1)B
(2)Cl2+20H– = Cl–+C1O–+H2O
(3)KCl
(4)5℃≤T≤25℃时,温度升高速率加快; T>25℃时,温度升高,次氯酸钾分解,ClO–浓度减小,速率减慢
(5)+3价铁的量增多催化了高铁酸钾与水的反应,导致产率减小。
(6)0.012
19. (13分)
(1) I2或碘单质
(2)①2H2O+4I– +O2 = 2I2 + 4OH–
②IO3–+5I– +6H+ == 3H2O+3I2,该反应的速度快
(3)少量KIO3固体
(4)①快
②pH=8.4时,同时发生了:碘与淀粉变蓝和碘单质与氢氧化钾的歧化反应。由于碘与淀粉变蓝反应快,所以先产生蓝色,随着歧化反应的进行,碘单质浓度降低,蓝色消失。