本试卷共100分,考试时长90分钟。
第一部分
本部分共14题,每题3分,共42分。在每题列出的四个选项中,选出最符合题目要求的一项。
1. 下列事实与电化学无关的是
|
|
|
|
A. 暖宝宝(含铁粉、碳、氯化钠等)发热 | B. 海沙比河沙混凝土更易使钢筋生锈 | C. 家用铁锅生锈 | D. 铁罐运输浓硫酸 |
2. 下列物质的应用中,利用了氧化还原反应的是
A. 双氧水作消毒剂 B. 生石灰作干燥剂
C. 碳酸氢钠作膨松剂 D. 氧化铁作红色颜料
3. 下列化学用语的表述正确的是
A. 中子数为8的碳原子: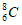 B. 甲基的电子式:
B. 甲基的电子式: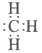
C. 乙烷的结构简式:C2H6 D. 氯元素的原子结构示意图: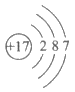
4. 化学与生活密切相关,下列说法不正确的是
A. 油脂属于酯类物质可发生皂化反应
B. 灼烧的方法能区分蚕丝和棉纤维
C. NH4Cl溶液和CuSO4溶液均可使蛋白质变性
D. 酿酒过程中葡萄糖在酒化酶的作用下转化为乙醇
5. 下列解释事实的方程式正确的是
A. CO2通入过量的NaOH溶液中:CO2+OH-=HCO3-
B. SO2的催化氧化反应:2SO2+O2
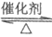 2SO3
2SO3
C. 过氧化钠做呼吸面具的供氧剂:Na2O2+CO2=Na2CO3+O2
D. 氯气用于自来水消毒:Cl2+H2O  2H++Cl-+ClO-
2H++Cl-+ClO-
6. 实验室可用KMnO4代替MnO2与浓盐酸反应,在常温下快速制备Cl2,反应原理为:
2KMnO4+16HCl(浓)=5Cl2↑+2KCl+2MnCl2+8H2O。
下列说法不正确的是
A. Cl2是氧化产物
B. 浓盐酸在反应中只体现还原性
C. 每生成标准状况下2.24L Cl2,转移0.2mol电子
D. 反应中KMnO4的氧化性强于Cl2
7. 以X为原料制备缓释布洛芬的合成路线如下:
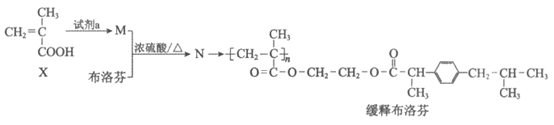
下列说法不正确的是
A. X不存在顺反异构
B. 试剂a为CH3CH2OH
C. N→缓释布洛芬为加聚反应
D. 布洛芬的结构简式为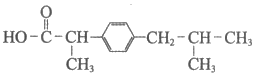
8. 下列各项比较中,一定相等的是
A. 相同物质的量浓度的氨水和NH4Cl溶液中的NH4+的物质的量浓度
B. 相同物质的量的Na分别完全转化为Na2O和Na2O2时转移电子的数目
C. 相同物质的量的正丁烷和2-甲基丁烷中含有的C—H键的数目
D. 标准状况下,相同体积的乙炔和水中含有的H原子的数目
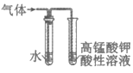
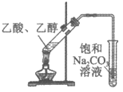
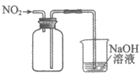
9. 用下列仪器或装置(图中部分夹持略)进行相应实验,可以达到实验目的的是
验证溴乙烷消去反应的气体产物为乙烯 | 实验室制乙酸乙酯 | 收集NO2气体 | 酸性:碳酸>苯酚 |
|
|
|
|
A | B | C | D |
10. CO2的转化一直是世界范围内的研究热点。利用两种金属催化剂,在水溶液体系中将CO2分别转化为CO和HCOOH的反应过程示意图如下:
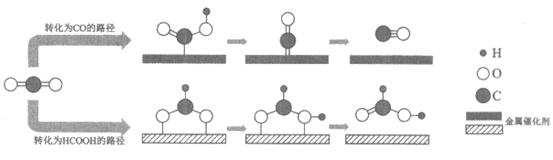
下列说法正确的是
A. 在转化为CO的路径中,只涉及碳氧键的断裂和氧氢键的形成
B. 在转化为HCOOH的路径中,CO2被氧化为HCOOH
C. 在转化为两种产物的过程中碳、氧原子的利用率均为100%
D. 上述反应过程说明催化剂具有选择性
11. 碳酸钠晶体(Na2CO3·10H2O)失水可得到Na2CO3·H2O(s)或Na2CO3(s),两个化学反应的能量变化示意图如下:
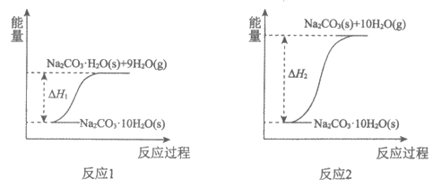
下列说法正确的是
A.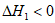
B. 碳酸钠晶体(Na2CO3·10H2O)失水不是化学变化
C. Na2CO3·H2O(s)失水生成Na2CO3(s):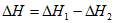
D. 向Na2CO3(s)中滴加几滴水,温度升高
12. 具有独特空间结构的有机化合物丙的制备过程如下:
下列说法不正确的是
A. 苯和甲的核磁共振氢谱都只有1组峰
B. 可以用酸性KMnO4溶液鉴别乙和丙
C. 苯和甲反应生成乙为加成反应
D. 1 mol苯最多可以和3 mol甲反应
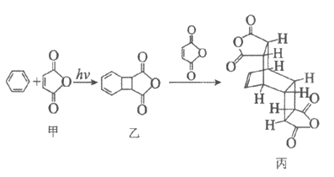
13. 室温下向100 mL蒸馏水中加入1g CaCO3,一段时间后再向其中加入10mL蒸馏水,一段时间后继续加入10mL蒸馏水。该过程中电导率的变化如下图:
已知:室温下,CaCO3的溶解度为0.0013g。
下列说法不正确的是
A. a→b电导率上升是由于CaCO3固体部分溶解于水中
B. c和e对应的时刻分别加入了10mL蒸馏水
C. c→d、e→f,电导率下降,说明CaCO3的溶解平衡逆向移动
D. g后的电导率几乎不再改变,说明CaCO3的溶解达到平衡状态
14. 10℃时,分别向4支小试管中滴加8滴1mol/L CuSO4溶液,再分别向其中滴加2mol/L NaOH溶液,边滴加边振荡,实验数据及现象如下表:
试管编号 | 1 | 2 | 3 | 4 |
滴加NaOH溶液的量 | 2滴 | 6滴 | 12滴 | 16滴 |
立即观察沉淀的颜色 | 浅绿色 | 浅绿色 | 蓝色 | 蓝色 |
酒精灯加热浊液后沉淀的颜色 | 浅绿色 | 浅绿色 | 黑色 | 黑色 |
取浅绿色沉淀用蒸馏水反复洗涤,加入稀盐酸完全溶解,再加入适量BaCl2溶液,产生大量白色沉淀。取蓝色沉淀重复上述实验,无白色沉淀。经检验,试管3、4中黑色沉淀中含有CuO。
下列说法不正确的是
A. 由实验现象可知浅绿色沉淀中可能含有碱式硫酸铜
B. CuSO4溶液与NaOH溶液反应时,其相对量不同可以得到不同的产物
C. 试管3、4中的固体在加热过程中发生了反应:Cu(OH)2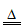 CuO+H2O
CuO+H2O
D. 取浅绿色沉淀再滴加适量NaOH溶液后加热仍不会变黑
第二部分
本部分共5题,共58分。
15. (10分)草酸(H2C2O4)是二元弱酸,其工业合成方法有多种。
Ⅰ. 甲酸钠钙化法
(1)CO和NaOH溶液在2MPa、200℃时生成甲酸钠(HCOONa),化学方程式是______________________。
(2)“加热“后,甲酸钠脱氢变为草酸钠。则“钙化“时,加入的试剂a是____________。
(3)若将草酸钠直接用H2SO4酸化制备草酸,会导致结晶产品不纯,其中含有的杂质主要是________________。
(4)“酸化“过程中加入H2SO4的目的是_______________。
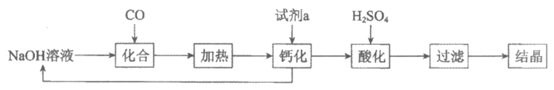
Ⅱ. 一氧化碳偶联法
分三步进行:
i. 偶联反应:
ii. 水解反应:……
iii. 再生反应:4NO+4CH3OH+O2→4CH3ONO+2H2O
(5)酸性条件下,“水解反应“的化学方程式是__________________。
(6)从原子经济性的角度评价偶联法制备草酸的优点是____________________。
16. (12分)他莫昔芬可用于治疗某些癌症,中间体K的合成路线如下:
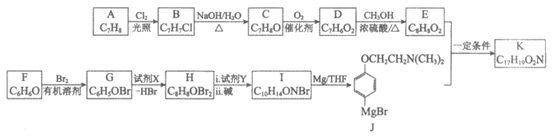
已知:
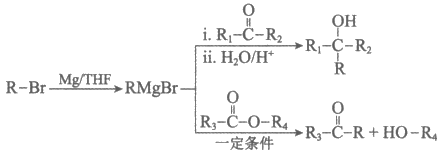
(1)A为芳香族化合物,A的同系物中相对分子质量最小的物质是______________。
(2)B→C的化学方程式是_________________。
(3)D中含有的官能团是________________。
(4)试剂X的分子式为C2H4Br2,试剂Y的分子式为C2H7N。
下列说法正确的是____________(填序号)。
a. 1mol F最多能与3mol H2发生加成反应
b. G核磁共振氢谱有3组吸收峰,峰面积比为1:2:2
c. 试剂X的名称为1,1-二溴乙烷
(5)K的结构简式是_________________。
(6)由K可通过如下过程合成他莫昔芬:
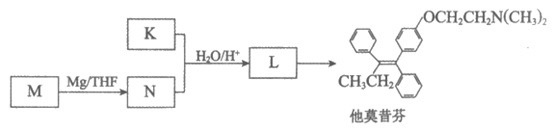
①M的结构简式是_________________。
②L→他莫昔芬的反应类型是________________。
17. (12分)菱锰矿的主要成分是MnCO3,其中含有FeCO3、CaCO3、MgCO3等杂质。工业上采用硫酸铵焙烧菱锰矿法制备高纯MnCO3,流程如下图:
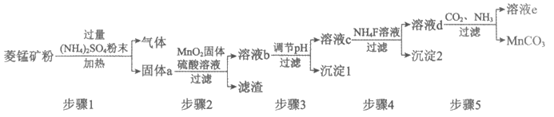
已知:
Ⅰ. 金属碳酸盐和硫酸铵混合粉末在加热条件下反应,生成硫酸盐、NH3和CO2。
Ⅱ. 溶液中金属离子沉淀的pH如下表:
金属离子 | Fe3+ | Fe2+ | Mn2+ | Mg2+ | Ca2+ |
开始沉淀pH | 1.5 | 6.3 | 8.2 | 8.9 | 11.9 |
完全沉淀pH | 2.8 | 8.3 | 10.2 | 10.9 | 13.9 |
(1)步骤1中MnCO3与(NH4)2SO4反应的化学方程式是______________。
(2)步骤2和3中加入MnO2固体、调节pH的目的分别是__________________。
(3)上述流程中可以再利用的物质有__________。
a. (NH4)2SO4 b. NH3 c. CO2
(4)MnCO3可用于制备苯甲醛,流程如下:
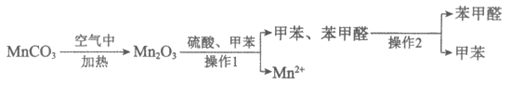
已知:甲苯难溶于水,密度小于水,沸点为110.4℃;
苯甲醛微溶于水,易溶于甲苯,沸点为179℃。
①MnCO3在空气中加热的化学方程式是__________________。
②操作1是___________;操作2是____________。
③该方法制备1.06kg苯甲醛,则理论上消耗Mn2O3___________kg
[M(Mn2O3)=158g/mol;M(苯甲醛)=106g/mol]。
18. (12分)利用工业废渣DSS,其主要成分为FeS、Fe2(SO4)3、FeSO4等,制备无机高分子絮凝剂——聚合硫酸铁【Fe2(OH)n)(SO4)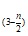 ]m。
]m。
(1)Na2S2O8为氧化剂处理DSS制备Fe2(SO4)3,反应过程如下:

反应②的离子方程式是_______________。
(2)Fe2(SO4)3经水解、聚合两步连续反应制得聚合硫酸铁。
①水解反应:____________(离子方程式)。
②聚合反应:mFe2(OH)n(SO4)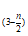 =[Fe2(OH)n(SO4)
=[Fe2(OH)n(SO4)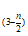 ]m
]m
(3)测定并改进聚合硫酸铁絮凝剂的性能
①表征聚合硫酸铁絮凝剂性能的重要指标是盐基度(OH-与Fe3+的物质的量比值),盐基度越大絮凝效果越好。
测定某聚合硫酸铁样品盐基度的方案如下,请补全步骤并计算。
资料:KF溶液可以掩蔽Fe3+使其不与OH-反应。
取a g样品,完全溶解于V1 mL c1 mol/L,盐酸中,__________,滴入酚酞溶液,用c2mol/L NaOH溶液滴定至终点,消耗NaOH溶液体积为V2 mL;另取a g样品,测得Fe3+的物质的量为b mol。该样品的盐基度为___________(列出表达式)。
②某小组利用如图电解装置来提高聚合硫酸铁的盐基度。
A是聚合硫酸铁溶液,B是提高盐基度后的聚合硫酸铁溶液。
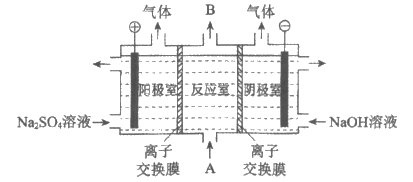
i. 离子交换膜是__________(填“阴“或“阳“)离子交换膜。
ii. 简述反应室中提高盐基度的原理:__________________________。
19. (12分)某实验小组探究盐溶液对弱电解质的电离及难溶电解质的溶解的影响。
文献指出:向弱电解质或难溶电解质中加入具有不同离子的可溶性强电解质溶液,会使弱电解质的电离程度或难溶电解质的溶解度增大,这种现象可称为”盐效应”。
(1)对弱电解质Fe(SCN)3的电离的影响。
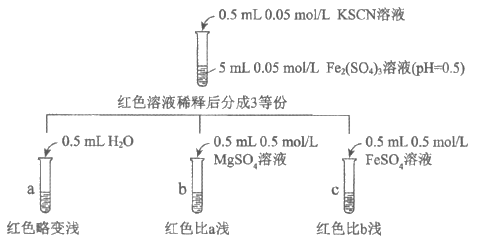
资料:1. 等浓度的MgSO4与FeSO4的盐效应相当。
2. Fe2++2SCN-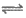 Fe(SCN)2(无色);Mg2+与SCN-不反应。
Fe(SCN)2(无色);Mg2+与SCN-不反应。
①加入0.5mL H2O的目的是________________________。
②对比a、b中的现象,得出的结论是___________________。
③结合化学平衡移动原理解释c中红色比b浅的原因:______________________。
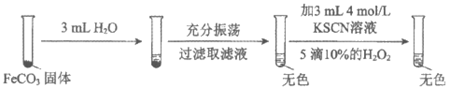
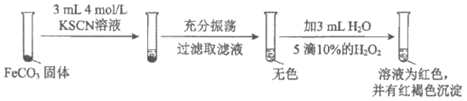
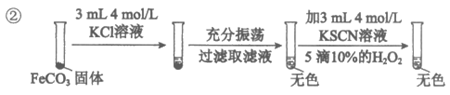
(2)对难溶电解质FeCO3的溶解性的影响。
i |
|
ii |
|
资料:等浓度的KCl与KSCN的盐效应相当。
对比实验i、ii,对于ii中溶液为红色,提出假设:
A. ……
B. 溶液中的SCN-与Fe2+结合,促进FeCO3的溶解。
设计对比实验iii,证实假设B是主要原因。
①假设A是_____________。
②对比实验iii的步骤和现象:_________________________(按实验ii的图示方式呈现)。
(3)通过以上实验,说明该实验条件下盐溶液通过__________、___________可促进弱电解质的电离及难溶电解质的溶解。
【试题答案】
第一部分:共14小题,每小题3分,共42分。
1. D 2. A 3. D 4. C 5. B
6. B 7. B 8. B 9. A 10. D
11. D 12. B 13. C 14. D
第二部分:共5小题,共58分。
说明:其他合理答案均可参照本参考答案给分。
15. (每空2分,共10分)
(1)CO+NaOH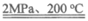 HCOONa
HCOONa
(2)Ca(OH)2(或CaO)(1分)
(3)Na2SO4(1分)
(4)加入H2SO4,H+将CaC2O4转化为H2C2O4,SO42-与Ca2+结合生成CaSO4,沉淀大部分Ca2+
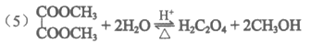
(6)总反应为:4CO+O2+2H2O→2H2C2O4,是原子利用率为100%的反应
16. (每空2分,共12分)
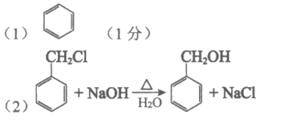
(3)羧基
(4)ab
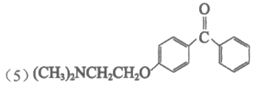
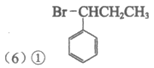 ②消去反应(1分)
②消去反应(1分)
17. (每空2分,共12分)
(1)MnCO3+(NH4)2SO4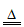 MnSO4+CO2↑+2NH3↑+H2O
MnSO4+CO2↑+2NH3↑+H2O
(2)加入MnO2将Fe2+氧化为Fe3+;调节pH将Fe3+转化为Fe(OH)3沉淀除去
(3)abc
(4)①4MnCO3+O2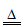 2Mn2O3+4CO2
2Mn2O3+4CO2
②分液(1分)
蒸馏(1分)
③3.16
18. (每空2分,共12分)
(1)SO4-+Fe2+=SO42-+Fe3+
(2)①2Fe3++(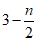 )SO
)SO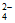 +nH2O
+nH2O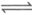 Fe2(OH)n(SO4)
Fe2(OH)n(SO4)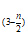 +nH+
+nH+
(3)①加入过量的KF溶液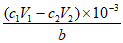
②i. 阴
ii. 电解过程中,阴极室中的OH-通过阴离子交换膜进入反应室,反应室中的SO42-通过阴离子交换膜进入阳极室,从而提高盐基度
19. (每空2分,共12分)
(1)①排除稀释对溶液颜色的影响
②MgSO4溶液促进了弱电解质Fe(SCN)3的电离
③b、c中的盐效应相当,Fe(SCN)3 Fe3++3SCN-,c中Fe2+结合SCN-生成Fe(SCN)2,使得c(SCN-)降低,平衡正向移动,红色变浅
Fe3++3SCN-,c中Fe2+结合SCN-生成Fe(SCN)2,使得c(SCN-)降低,平衡正向移动,红色变浅
(2)①KSCN溶液的盐效应促进FeCO3的溶解
(3)盐效应(1分)
化学反应(1分)