本试卷共30道小题,满分45分。考试时间45分钟。
可能用到的相对原子质量
H 1 C 12 O 16
第一部分
选择题(共12分)
1. 青团是清明时节的传统食品,下列制作青团的部分原料中,富含维生素的是
A. 绿色蔬菜汁 B. 植物油
C. 蔗糖 D. 糯米粉
2. 下列符号中,表示2个氢原子的是
A. H2 | B. 2H | C. 2H2 | D. 2H2O |
3. 下列不属于新能源的是
A. 潮汐能 | B. 太阳能 | C. 风能 | D. 煤 |
4. 下列物质在氧气中燃烧,火星四射、生成黑色固体的是
A. 铁丝 | B. 红磷 | C. 蜡烛 | D. 木炭 |
5. 氯化铜与氢氧化钠发生反应:CuCl2 + 2NaOH === Cu(OH)2 ↓ + 2NaCl,此反应属于
A. 化合反应 | B. 分解反应 | C. 置换反应 | D. 复分解反应 |
6. 切洋葱时可闻到刺激性气味,这说明
A. 分子在不停地运动 | B. 分子体积很小 |
C. 分子间有间隔 | D. 分子质量很小 |
7. 电解水实验如下图。下列说法正确的是
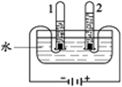
A. 产生H2与O2的体积比约为1:2 | B. 试管2中得到H2 |
C. 该实验说明水由H2和O2组成 | D. 生成氢气和氧气的质量比为1:8 |
8. 下列物质不能与CuSO4溶液反应的是
A. Fe | B. Mg | C. Ag | D. Zn |
9. 下列方法能鉴别氧气和空气的是
A. 闻气味 | B. 将燃着的木条伸入集气瓶中 |
C. 观察颜色 | D. 向瓶中倒入紫色石蕊溶液 |
10. 在密闭容器中,分别用压强和温度传感器测定铝与稀盐酸反应过程的图像如下。
下列结论不正确的是

A. 反应过程中有热量放出
B. 0~50 s时,变化不明显,是因为铝表面有一层致密氧化铝薄膜
C. 60~100 s气体压强升高,有温度升高的原因
D. 120~130 s压强不变,说明反应停止了
依据实验和溶解度曲线回答11~12题。
M、N两种固体的溶解度曲线如图甲。40℃时,将等质量的M、N两种固体,分别加入到盛有100g水的烧杯中,充分搅拌后,现象如图乙,降温到20℃时,现象如图丙。
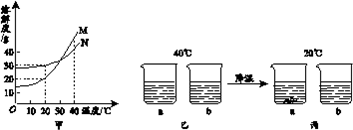
11. 将图丙烧杯a中的固体移除后,所得溶液的质量为
A. 100 g B. 110 g C. 120 g D. 130 g
12. 下列说法正确的是
A. 烧杯a中加入的固体为N
B. 40℃时烧杯a中溶液一定是饱和溶液
C. 40℃时烧杯b和20℃时烧杯b中溶质质量不相等
D. 40℃时烧杯a和20℃时烧杯b中溶液的溶质质量分数相等
第二部分
非选择题(共33分)
〖生活现象解释〗
13.(2分)2018年年底地铁6号线(西延)正式开通,使石景山区人民出行更加便捷。
(1)地铁建造需要大量钢铁。炼铁的原理是利用一氧化碳与氧化铁的反应,反应的化学方程式为______。
(2)地铁内安装了大量消火栓系统。该灭火系统以水为介质,水能灭火的原因是______。
14.(4分)食盐、食醋、小苏打、碳酸钙都是生活中常见物质。A、B两题均作答。
A | B |
(1)为使蛋糕更松软,焙制时加入适量_______。 (2)下列属于化学变化的是_______(填序号)。 A. 海水晾晒得到海盐 B. 粮食经微生物发酵酿造食醋 C. 大理石切割打磨制成建筑材料 | (1)为防止骨质疏松,可以服用含______的药片。 (2)小苏打可以缓解胃酸过多症,其原理用化学方程式表示为_______。 |
15. (2分)《千里江山图》是北宋王希孟创作的绢本设色画,其颜料选用各色天然矿石,描绘了祖国的锦绣河山。一些矿石的主要成分及颜色如下表。

矿石 | 蓝铜矿 | 孔雀石 | 雌黄 | 赭石 |
主要成分 | Cu3(OH)2(CO3)2 | Cu₂(OH)₂CO₃ | As2S3 | Fe2O3 |
颜色 | 蓝色 | 绿色 | 黄色 | 红色 |
(1)四种矿石主要成分中,属于氧化物的是______。
(2)蓝铜矿和孔雀石的主要成分在组成上具有的相同点是______。
〖科普阅读理解〗
16. (5分)阅读下面科普短文。
生活垃圾处理不当会造成环境的污染,我们能为赖以生存的环境做些什么呢?可以将生活垃圾分类,把可回收物和有害垃圾分别投入相应的垃圾箱。其实,还可以把厨余垃圾中的鲜垃圾用来制作“环保酵素“。
制作方法:按1:3:10的比例将红糖、鲜厨余(水果皮、菜叶等)、水混合装入桶中,盖盖发酵3个月,过滤出液体,得到环保酵素。
环保酵素在农业生产和日常生活等诸多方面都有着重要的作用。
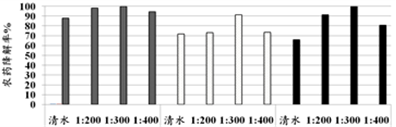
防城港市农产品质量安全检测中心对生长中的芥菜残留农药进行了研究。首先检测喷洒农药2小时后初始附着量,然后分四组分别喷洒:清水,1:200、1:300、1:400(环保酵素和水的体积比,下同)的酵素液,检测96 h后3种农药降解情况,结果如下图所示。
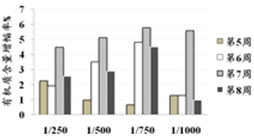
我国是农业大国,施用化学肥料是保证粮食高产、稳产的一种重要措施,但与此同时,长期施用化肥会造成土壤退化、生态环境污染等问题。玉溪师范学院资源环境学院研究人员分别用1:250、1:500、1:750、1:1000的酵素液(每周施浇3次)对土壤中有机质等含量进行了研究,结果如下图所示。
绿水青山就是金山银山。保护环境,从自身做起。
(原文作者李方志、韦文芳等,有删改)
依据文章内容,回答下列问题。
(1)生活中制作环保酵素,过滤液体时,常采用的工具是______。
(2)长期施用化肥会造成的后果是______。
(3)红糖主要成分化学式为C12H22O11,其相对分子质量是342,计算式为______。
(4)四组实验中,对芥菜中残留农药降解作用最好的是______。
(5)下列说法正确的是______(填序号)。
A. 环保酵素对土壤中有机质含量提高有一定的效果
B. 施浇环保酵素到第7周,土壤改良效果最佳
C. 环保酵素浓度越大,土壤改良效果越好
〖实际生产分析〗
17.(3分)许多制药厂、化工厂在生产中会产生大量的铁泥(主要含Fe,FeO,Fe2O3等物质),若以铁泥为原料制备FeSO4·7H2O,可实现废物利用。其主要流程如下。
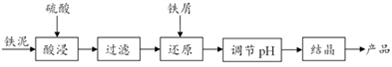
已知:FeO + H2SO4 === FeSO4+H2O;Fe + Fe2(SO4)3 === 3FeSO4
(1)酸浸过程中铁发生反应的化学方程式为________。
(2)还原过程中,元素化合价发生改变的是
。
(3)产品在结晶前需要调节pH。若pH过高需要加入______进行调节。
18.(2分)中科院大连化学物理研究所研制出新型多功能复合催化剂,可将二氧化碳转化为汽油,过程示意如下图。
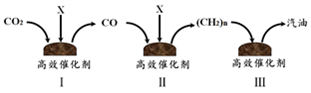
(1)X是一种单质,该物质是________。
(2)在一定条件下,I中反应生成的另外一种物质为生活中常见的化合物,该反应的化学方程式为________。
19. 科学家采用“组合转化“技术,可将二氧化碳在一定条件下转化为重要的化工原料乙烯,其反应的微观过程如图所示。
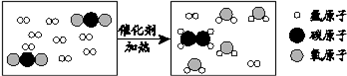
(1)乙烯的化学式为
。
(2)若88 g二氧化碳被转化,则参加反应的氢气的质量为
。
20. SCR技术可有效降低柴油发动机在空气过量条件下的氮氧化物排放,其工作原理如下图所示:

(1)上图所示物质中属于单质的是
。
 (2)尿素[CO(NH2)2]水溶液加热后,发生反应的化学方程式如下,请补全该反应:
(2)尿素[CO(NH2)2]水溶液加热后,发生反应的化学方程式如下,请补全该反应:
CO(NH2)2 + H2O ==== 2 NH3↑ +
。
(3)NO2转化为N2,氮元素的化合价变化为
。
〖基本实验及原理分析〗
21. (2分)用如图装置进行O2制取实验。
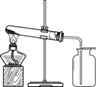
(1)KMnO4受热分解的化学方程式为______。
(2)用向上排空气法收集氧气的原因是______。
22. (2分)用如图装置进行CO2制取和性质的实验。
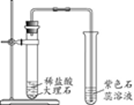
(1)制取二氧化碳的化学方程式为______。
(2)证明二氧化碳与水发生反应的现象是______。
23. (2分)实验小组同学配制50 g质量分数为15%的氯化钠溶液。
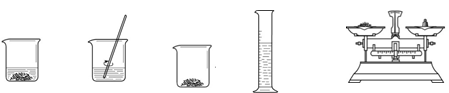
A B C D E
(1)需要氯化钠和水的质量分别为
。
(2)实验操作顺序为E、C、
。
24. (2分)用如图装置进行空气中氧气含量测定的实验。
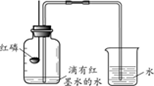
(1)证明空气中氧气含量约为1/5的实验现象是______。
(2)实验中观察到烧杯中的水变为红色,原因是______。
25.(3分)进行如下实验,研究氢氧化钙的化学性质。
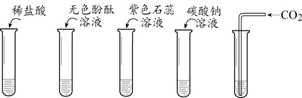
A B
C D
E
(1)溶液变为红色的是
(填序号)。
(2)没有明显现象试管中发生反应的化学方程式为______。
(3)两支试管中出现浑浊现象,其原因是______。
26. 为了验证锌、铁、铜的金属活动性强弱,同学们设计了如下图所示实验。
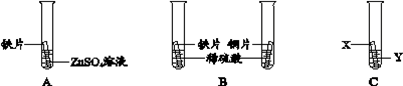
(1)实验A的目的是
。
(2)实验B能证明金属活动性铁强于铜的实验现象是
。
(3)实验C也能验证铁与铜的金属活动性强弱,则X、Y分别是
。
27. 利用下图所示装置进行实验。A、B均作答。
A | B |
A处观察到的现象为 |
A处观察到的现象为 |
28. 用如图所示装置测定空气中氧气的含量。管中预先装入适量的水,测得水面高度为a,加热粗铜丝,一段时间后白磷燃烧。燃烧停止,完全冷却后,测得水面高度为b。(已知除去胶塞部分管的长度为c)
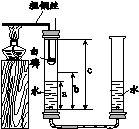
(1)白磷燃烧的化学反应方程式为
。
(2)由该实验测得空气中氧气的含量为
(用含a、b、c的代数式表示)
〖科学探究〗
29.(6分)鱼浮灵【主要成分是过碳酸钠(2Na2CO3·3H2O2)】是水产养殖中常见的增氧剂,溶于水后生成Na2CO3和H2O2,能迅速增加水体溶氧量,某课外小组用如图装置探究促进H2O2分解的因素。
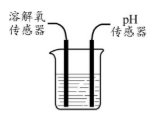
【查阅资料】H2O2常温下分解很慢。
NaCl溶于水解离出Na+和Cl–。
Na2CO3溶于水解离出Na+和CO32-,CO32-与水作用使溶液呈碱性。
【猜想与假设】1.Na+促进H2O2分解。
2.溶液的碱性促进H2O2分解。
【进行实验】
探究一:分别进行下列3个实验
(80mL蒸馏水中加入6.7g”鱼浮灵“,所得溶液中H2O2的浓度约为4%)。
实验 | 实验内容 | 实验结果 | |
pH | 溶解氧(mg/L) | ||
1 | ① 80 mL蒸馏水 | 6.96 | 5.68 |
② | 9.89 | 7.97 | |
2 | ① 80 mL 4%的H2O2溶液 | 6.01 | 6.44 |
② | 6.00 | 6.46 | |
③ | 8.14 | 9.11 | |
3 | 80 mL 4%的H2O2溶液中加少量NaOH溶液 | 9.26 | 10.97 |
【解释与结论】
(1)根据实验1的实验结果,加入“鱼浮灵“后,液体的变化是
。
(2)通过实验
,证明猜想1不成立。
(3)证明猜想2成立的依据是
。
探究二:向5个烧杯中分别加入80
mL4%的H2O2溶液,再分别滴加NaOH溶液,测得不同pH下的溶解氧情况如下表所示。
烧杯 | 1 | 2 | 3 | 4 | 5 |
pH | 8.00 | 8.59 | 9.29 | 10.43 | 11.47 |
溶解氧(mg/L) | 6.88 | 9.30 | 13.82 | 17.57 | 13.15 |
(4)探究二得出的结论是
。
【反思与评价】
(5)下列物质能加快H2O2分解的是
。
A. MnO2 B. NaCl C. NaOH D.Na2CO3
(6)探究一中,实验2-①与实验1-①对比,溶解氧增大的原因是
。
30. 实验课上,同学们利用澄清石灰水检验空气中的二氧化碳,实验中发现各组石灰水浑浊程度存在较大差异,于是设计实验探究影响石灰水浑浊程度的因素。
【进行实验】装置图如下所示。
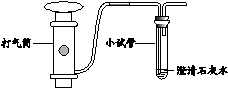
实验1:取饱和澄清石灰水进行实验。
实验序号 | 1-1 | 1-2 | 1-3 | 1-4 |
饱和澄清石灰水体积/mL | 2.0 | 1.5 | 1.0 | 0.5 |
缓慢通入2 L空气后的浑浊程度 | 不明显 | 明显 | 非常明显 | 明显 |
实验2:利用向饱和石灰水中添加蒸馏水来调节石灰水浓度进行实验
(溶液浓度变化引起的溶液密度变化忽略不计)。
实验序号 | 2-1 | 2-2 | 2-3 | 2-4 |
饱和澄清石灰水体积/mL | 2.0 | 1.5 | 1.0 | 0.5 |
加入蒸馏水体积/mL | 0 | a | b | c |
缓慢通入3 L空气后的浑浊程度 | 非常明显 | 明显 | 不明显 | 无现象 |
【解释与结论】
(1)小试管中发生反应的化学方程式为
。
(2)实验1的目的为
。
(3)实验2中a、b、c三处数据,设计合理的是
。
A. 0.5 0.5 0.5 B. 0.5 1.0 1.5
C. 1.0 1.5 2.0 D. 1.0 2.0 3.0
(4)实验2的结论是
。
【反思与评价】
(5)通过对比实验1-1和2-1,可得出影响石灰水浑浊程度的另一因素是
,理由是
。
参考答案
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
答案 | A | B | D | A | D | A | D | C | B | D | C | D |
13. (1)Fe2O3 + 3CO
高温
2Fe + 3CO2
(2)使温度降低至着火点以下(或隔绝氧气)
14. A:小苏打 B
B:碳酸钙 NaHCO3 + HCl
== NaCl
+ H2O + CO2↑
15. (1)Fe2O3
(2)都是由Cu、O、C、H四种元素组成
16. (1)纱布(或滤网等)
(2)土壤退化,生态环境污染等
(3)12×12+1×22+16×11
(4)1:300的酵素液
(5)AB
17. (1)Fe + H2SO4 == FeSO4 + H2↑
(2)Fe(或Fe和H)
(3)硫酸
18. (1)H2
(2)CO2 + H2
一定条件
CO+
H2O
19. (1)C2H4
(2)12 g
20. (1)O2、N2
(2)CO2↑
(3)+4价→零价
21 (1)2KMnO4
△
K2MnO4 + MnO2 + O2↑
(2)氧气的密度比空气略大
22. (1)CaCO3 + 2HCl
====
CaCl2 + H2O + CO2↑
(2)紫色石蕊溶液变红
23. (1)7.5 g和42.5 g
(2)DAB
24. (1)瓶中的液面上升了约1/5
(2)红磷燃烧放热,使瓶内压强增大,水流到烧杯中
25. (1)B
(2)Ca(OH)2 + 2HCl ==== CaCl2 + 2H2O
(3)均生成了难溶于水的碳酸钙
26. (1)验证锌和铁的金属活动性强弱
(2)铁片上有气泡产生,铜片无明显现象
(3)Fe、CuSO4 溶液(或Cu、FeSO4溶液)
27. A 红色棉球褪色
浓盐酸挥发出氯化氢气体,遇水形成盐酸,与氢氧化钠反应
B 棉球由紫色变成红色
 石灰石与稀盐酸反应产生二氧化碳,二氧化碳与水反应生成碳酸
石灰石与稀盐酸反应产生二氧化碳,二氧化碳与水反应生成碳酸
28. (1)4P + 5O2 === 2P2O5
(2)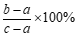
29. (1)pH和溶解氧增大
(2)2
(3)实验2加入碳酸钠、实验3加入氢氧化钠溶液后,pH增大,溶解氧增加
(4)当pH在8.00~11.47之间时,溶解氧先增大后减少
(5)ACD
(6)过氧化氢常温下分解放出氧气
30. (1)CO2 + Ca(OH)2 === CaCO3↓ + H2O
(2)探究石灰水体积对浑浊程度的影响。
(3)B
(4)在石灰水体积、通入空气体积相同的条件下,石灰水浓度越大,浑浊程度越明显。
(5)通入空气的体积
实验1-1和2-1中,石灰水体积和浓度相同,通入空气的体积不同,浑浊程度不同。