本试卷分为选择题和非选择题两部分,满分100分。考试时间90分钟。
可能用到的相对原子质量:H-1 N-14 O-16 K-39 Cu-64 Br-80 I-127
第I卷 (选择题 共42分)
本部分共14个小题,每小题3分,每小题只有一个选项符合题意
1. 用化学沉淀法除去粗盐中的杂质离子,不需要的操作是
A. 分液 B. 溶解 C. 过滤 D. 蒸发
2. 化学在疫情防控中发挥着重要作用,下列说法不正确的是
A. 二氧化氯可用于自来水消毒
B. 医用消毒酒精是95%的乙醇溶液
C. 医用防护口罩的材料之一是聚丙烯,聚丙烯属于高分子材料
D. 84消毒液和酒精混合消毒作用减弱,可能发生了复杂的化学反应
3. 对以下科学家的发明发现,分析不合理的是
A. 屠呦呦研究小组发现抗疟新药青蒿素,帮助很多人摆脱了疟疾的威胁
B. 侯德榜制碱法,最终制得纯碱的化学式为:NaHCO3
C. 阿伏加德罗提出分子学说,使人们对物质结构的认识发展到一个新的阶段
D. 门捷列夫发现元素周期律,使化学的研究变得有规律可循
4. 15N、N5+、NH5(为离子化合物,结构与NH4Cl相似)等均已被发现,下列说法正确的是
A. 15N 的原子结构示意图为: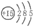
B. N5+中含36个电子
C. NH5既含离子键,又含共价键
D. NH5的电子式为:NH4+[:H]–
5. 下列各项比较中,一定相等的是
A. 相同物质的量Cu分别与足量浓硝酸和稀硝酸反应,生成气体的物质的量
B. 相同物质的量的Na2O和Na2O2中所含阴离子的数目
C. 相同质量的Fe分别与足量Cl2、S充分反应,转移的电子数
D. 相同物质的量浓度的NH4Cl和NH4HCO3溶液中的c(NH4+)
6. 下列除杂试剂选用正确且除杂过程不涉及氧化还原反应的是
物质(括号内为杂质) | 除杂试剂 | |
A | CH | CuSO4溶液 |
B | CO2(HCl) | 饱和Na2CO3溶液 |
C | 铜粉(铁粉) | 过量盐酸 |
D | Cl2(HCl) | H2O |
7. 脲醛树脂的合成与酚醛树脂类似,生成线型脲甲醛树脂的方程式为:
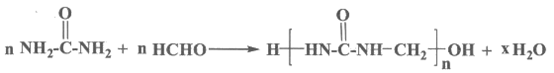
下列说法不正确的是
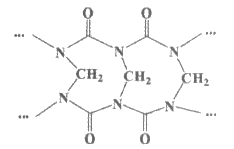
A. 网状的脲甲醛树脂以下图所示结构单元为主
B. 方程式中的化学计量数x=n-1
C. 脲甲醛树脂合成过程中可能存在中间体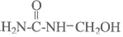
D. 通过质谱法测定线型脲甲醛树脂的平均相对分子质量,可得其聚合度
8. 结合元素周期律,根据下列事实所得推测不合理的是
事实 | 推测 | |
A | Na比Li活泼 | Cs比Na更活泼 |
B | N、P、As均为非金属元素 | 第VA元素均为非金属元素 |
C | H2O热稳定性强于H2S | H2S热稳定性强于H2Se |
D | Mg(OH)2碱性弱于NaOH | Al(OH)3碱性更弱 |
9. 多相催化反应是在催化剂表面通过吸附、解吸过程进行的。我国学者发现T℃时(各物质均为气态),甲醇与水在铜基催化剂上的反应机理和能量图如下:
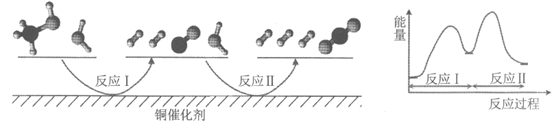
下列说法正确的是
A. 反应II的热化学方程式为:CO(g)+H2O(g)=H2(g)+CO2(g) △H=+a kJ/mol(a>0)
B. 1 mol CH3OH(g)和1 mol H2O(g) 的总能量大于1 mol CO2(g)和3 mol H2(g)的总能量
C. 选择优良的催化剂降低反应I和II的活化能,有利于减少过程中的能耗
D. CO(g)在反应中生成又消耗,CO(g)可认为是催化剂
10. 印刷电路板(PCB)是用腐蚀液将覆铜板上的部分铜腐蚀掉而制得。一种用FeCl3溶液制作PCB并将腐蚀后废液回收再生的流程如下:
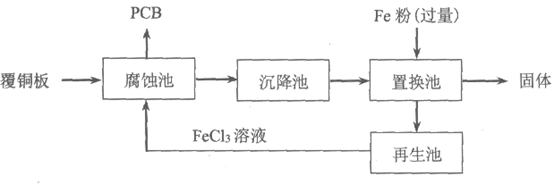
下列说法不正确的是
A. 腐蚀池中发生反应的化学方程式是:Cu+2FeCl3=CuCl2+2FeCl2
B. 腐蚀后的废液中,主要的金属阳离子有Fe3+、Cu2+、Fe2+
C. 置换池中发生的主要反应为:Fe+Cu2+=Cu+Fe2+和Fe+2Fe3+=3Fe2+
D. 再生池中加入酸化的H2O2,反应过程中pH降低
11. 室温下有下列四种溶液,下列叙述正确的是
编号 | ① | ② | ③ | ④ |
pH | 3 | 3 | 11 | 11 |
溶液 | 盐酸 | 醋酸溶液 | 氢氧化钠溶液 | 氨水 |
A. ①、②、③三种溶液的物质的量浓度大小为:①=③>②
B. 相同体积的①、②溶液分别与③溶液完全中和,消耗③溶液的体积:①>②
C. ②、③两溶液等体积混合,所得溶液中c(CH3COO–)>c(Na+)>c(H+)>c(OH–)
D. ①、③溶液以体积比为9:11混合,则混合溶液的pH=4
12. 潮湿环境、Cl–、溶解氧是造成青铜器锈蚀的主要环境因素,腐蚀严重的青铜器表面大多存在起催化作用的多孔催化层。图为青铜器发生电化学腐蚀的原理示意图,下列说法正确的是
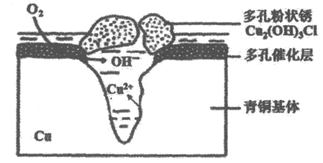
A. 腐蚀过程中,青铜基体是正极
B. 若有64gCu腐蚀,理论上耗氧体积为22.4L(标准状况)
C. 多孔催化层的形成加速了青铜器的腐蚀速率,是因为改变了反应的焓变
D. 环境中的Cl–、正负极产物作用生成多孔粉状锈,其离子方程式为:
2Cu2++3OH–+Cl–=Cu2(OH)3Cl ↓
13. 钠的燃烧产物中混有黑色物质,研究小组进行如下图所示的实验探究。下列推测不正确的是
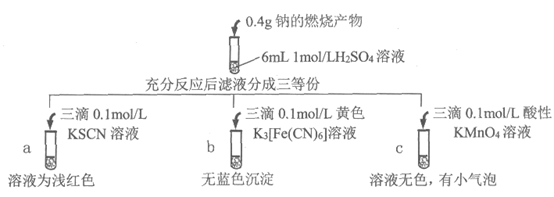
A. 过氧化钠与硫酸的反应可能有:Na2O2+2H+=2Na++H2O2
B. a试管中的现象说明燃烧前钠块中含有铁元素
C. c试管的溶液为无色,推测发生的反应为:
5H2O2+6H++2MnO4–=2Mn2++5O2 ↑+8H2O
D. 根据以上实验可判定:该实验中钠的燃烧产物里含Fe2O3,不含Fe3O4
14. SiHCl3在催化剂作用下主要发生反应:2SiHCl3(g) 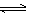 SiH2Cl2(g)+SiCl4(g) △H=+48 kJ·mol-1。已知:反应速率
SiH2Cl2(g)+SiCl4(g) △H=+48 kJ·mol-1。已知:反应速率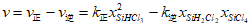 ,
,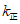 、
、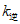 分别为正、逆向反应速率常数,x为物质的量分数,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。
分别为正、逆向反应速率常数,x为物质的量分数,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。
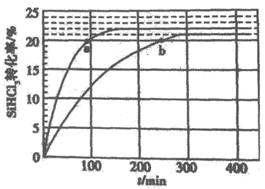
下列说法正确的是
A. 343K时反应物的平衡转化率为21%
B. a点的反应速率小于b点的反应速率
C. 343K时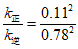
D. 由323K的平衡转化率数据,不能计算323K的平衡常数K
第II卷 (非选择题 共58分)
本部分共5小题,共58分
15. (9分)汽车尾气中NOx的生成和消除是科学家研究的重要课题。
(1)NOx能形成酸雨,NO2转化为HNO3的化学方程式是___________。
(2)汽车发动机工作时会引发N2(g)+O2(g)=2NO(g) △H=+180 kJ·mol-1,其能量变化示意图如下:
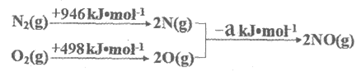
则NO中氮氧键的键能是________kJ·mol-1。
(3)用NH3可消除NO污染,反应原理为:4NH3+6NO 5N2+6H2O,以n(NH3):n(NO)分别为4:1、3:1、1:3投料,得到NO脱除率随温度变化的曲线如图所示:
5N2+6H2O,以n(NH3):n(NO)分别为4:1、3:1、1:3投料,得到NO脱除率随温度变化的曲线如图所示:
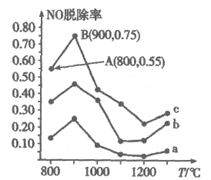
①曲线a对应的n(NH3):n(NO)=________。
②曲线c中NO的起始浓度为4×10-4 mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为_______mg/(m3·s)。
③由图可知,无论以何种比例反应,在温度超过900℃时NO脱除率都会骤然下降,可能的原因是__________(至少写两条)。
16. (7分)清代化学家徐寿创立了化学元素的中文名称和造字原则,推动了化学知识在中国的传播和应用。物质A由原子序数依次增大的短周期元素X、Y、Z组成,其中Z为金属元素,X、Y、Z简单离子的核外电子排布相同,物质A的结构式如图所示:
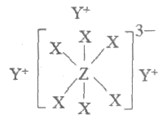
回答下列问题:
(1)Y、Z元素的名称为徐寿确定并使用至今,Y在周期表中的位置是________。
(2)比较X、Y、Z简单离子的半径大小(用对应离子符号表示)_______>_______>_______。
(3)在YZO2与YX的混合液中,通入足量CO2是工业制取A的一种方法,写出该反应的化学方程式________。
(4)与X同主族的元素溴和碘可以发生下列置换反应:Br2+2I–=2Br–+I2,I2+2BrO3–=2IO3–+Br2,这两个置换反应矛盾吗?简述理由________。
17. (12分)海水是巨大的化学资源宝库,利用海水可以获取很多物质。海水中主要离子有Na+、K+、Ca2+、Mg2+、Cl–、SO42-等。
利用1:淡水工业
(1)海水淡化的方法主要有________、电渗析法、离子交换法等。
(2)电渗析法是一种利用离子交换膜进行海水淡化的方法,其原理如左下图所示。
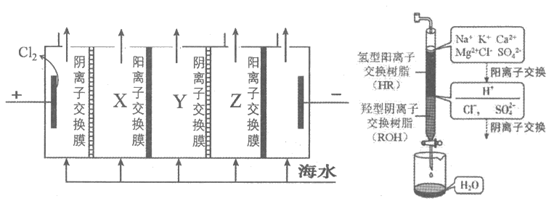
①淡水在______室(填X、Y或Z)形成后流出。
②一般海水不直接通入到阴极室中,原因是______。
(3)离子交换法净化海水模拟过程如右上图所示,氢型阳离子交换原理可表示为:
HR+Na+=NaR+H+,……。羟型阴离子交换树脂填充段存在的反应有______。
利用2:提溴工业
(4)用海水晒盐之后的盐卤可提取溴,提取流程如下:
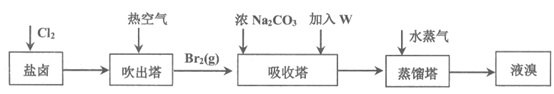
①用热空气将溴赶出,在吸收塔先用浓Na2CO3溶液吸收Br2,Br2歧化为Br–和BrO3–,再加入W溶液得到Br2。推测W是______。
②蒸馏塔中通入水蒸气加热,控制温度在90℃左右进行蒸馏的原因是______。
③将1 m3海水浓缩至1 L,使用该法最终得到38.4 g Br2,若总提取率为60%,则原海水中溴的浓度是______mg/L。
18. (15分)由化合物A制备可降解环保塑料PHB和一种医药合成中间体J的合成路线如下:
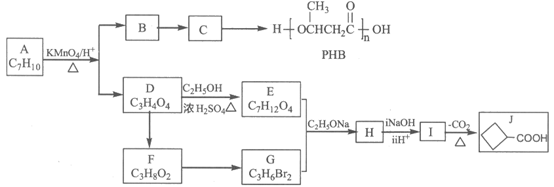
已知:
i.
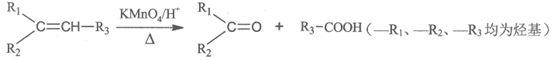
ii.
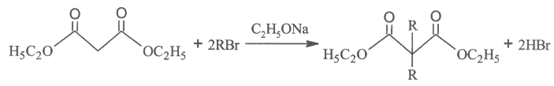
回答下列问题:
(1)C→PHB的反应类型是________。
(2)B中官能团的名称是________。
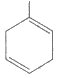
(3)A的结构简式是________。
(4)D→E的反应方程式是________。
(5)E+G→H的反应方程式是________。
(6)X是J的同分异构体,满足下列条件的有________种(不考虑顺反异构)。
①链状结构;
②既能发生银镜反应,又能发生水解反应。
其中核磁共振氢谱有三组峰,且峰面积之比为6:1:1的结构简式是________。
(7)已知: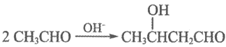
以乙烯为起始原料,选用必要的无机试剂合成C,写出合成路线。
19. (15分)”84消毒液”广泛应用于杀菌消毒,其有效成分是NaClO。实验小组制备消毒液,并利用其性质探索制备碘水的方法。
资料:i. HClO的电离常数为Ka=4.7×10-8;
H2CO3的电离常数为K1=4.3×10-7、K2=5.6×10-11。
ii. 碘的化合物主要以I–和IO3–的形式存在,IO3–+5I–+6H+=3I2+3H2O。
iii. 碘单质能与I–反应:I2+I–
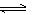 I3–(I3–低浓度时显黄色,高浓度时为棕色)。
I3–(I3–低浓度时显黄色,高浓度时为棕色)。
I. 制备消毒液(夹持装置略)
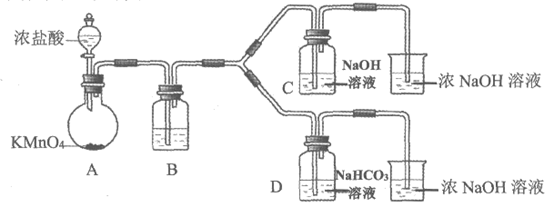
(1)制备NaClO消毒液的装置是________(填C或D)。
(2)制备完成后,向C装置的溶液中添加NaOH、Na2SiO3等物质,得到与某品牌成份相同的消毒液,用平衡移动原理解释NaOH的作用________。
(3)结合资料i,写出D中反应的化学方程式_________。
II. 利用消毒液的性质探究碘水的制备方法
将某品牌”84消毒液”稀释10倍,各取100 mL于三个烧杯中,设计如下实验方案制备碘水:
方案 | 操作 | 现象 | 反应后加淀粉溶液 |
1 | 烧杯1溶液中加入9g KI固体 | 溶液为橙黄色 | …… |
2 | 烧杯2溶液中加入9g KI固体 再加入1 mo/L盐酸10mL | 溶液颜色快速加深,呈紫红色 | 变蓝 |
3 | 烧杯3溶液中加入少量KI固体(小于0.5g) | 振荡后溶液保持无色 | 不变蓝 |
(4)对比不同方案的实验现象,得出制取碘水的最佳方法要关注的因素是______。
(5)针对烧杯3″滴加淀粉溶液不变蓝”的原因,提出两种假设:
假设1:过量的NaClO将反应生成的I2氧化为IO3–。
设计实验证实了假设1成立。NaClO氧化I2生成IO3–的离子方程式是______。
假设2:生成的I2在碱性溶液中不能存在。
设计实验a证实了假设2成立,实验a的操作及现象是______。
(6)某小组检验烧杯3所得溶液中含IO3–:取烧杯3所得无色溶液少许,加入稀硫酸酸化的KI溶液,反应后再滴加淀粉溶液,发现溶液变蓝。该实验方案能否证明烧杯3所得溶液中存在IO3–,说明理由______。
(7)预测烧杯1反应后加淀粉溶液的实验现象,结合方程式说明预测依据______。
参考答案
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
答案 | A | B | B | C | B | A | A | B | C | D | C | D | D | C |
15. (9分)
(1)3NO2+H2O=2HNO3+NO或4NO2+O2+2H2O=4HNO3 …………………(2分)
(2)632 …………………………………………………………………(2分)
(3)①1:3 ……………………………………………………………………(1分)
②1×10-4 ……………………………………………………………………(2分)
③i. 催化剂的活性下降;ii. 氨气可能发生分解;iii. 反应为放热反应,温度高反应速率快,达到平衡后平衡逆向移动。(答案合理即可) ………………(2分)
16. (7分)
(1)第三周期第IA族 …………………………………………………(1分)
(2)F–>Na+>Al3+……………………………………………………………………(2分)
(3)NaAlO2+6NaF+4CO2+2H2O=Na3AlF6+4NaHCO3 ……………………(2分)
(4)不矛盾。前者Br2是氧化剂,I2是氧化产物,氧化剂的氧化性大于氧化产物;后者I2是还原剂,Br2是还原产物,还原剂的还原性大于还原产物。(不矛盾;前者是”Br”得电子倾向强于”I”,后者是”I”失电子倾向强于”Br”)…………………(2分)
17. (12分)
(1)蒸馏法 ………………………………………………………(1分)
(2)①X、Z ………………………………………………………(2分)
②海水中含有较多的Mg2+、Ca2+等阳离子,阴极电解产生OH–,容易生成Mg(OH)2和Ca(OH)2等沉淀附着在电极表面或堵塞阳离子交换膜(答案合理即可)(2分)
(3)ROH+Cl–=RCl+OH–;2ROH+SO42-=R2SO4+2OH–;H++OH–=H2O ………(2分)
(答对2个即可)
(4)①硫酸 ……………………………………………………………(1分)
②温度过低不利于溴的蒸出,温度过高会蒸出较多水蒸气…………(2分)
③64 ……………………………………………………………………(2分)
18. (15分)
(1)缩聚(聚合)反应 ………………………………………………………………(1分)
(2)酮羰基、羧基 ………………………………………………………………(2分)
(3) …………………………………………(2分)
…………………………………………(2分)
(4)HOOCCH2COOH+2C2H5OH C2H5OOCCH2COOC2H5+2H2O …(2分)
C2H5OOCCH2COOC2H5+2H2O …(2分)
(5)C2H5OOCCH2COOC2H5+BrCH2CH2CH2Br 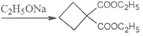 +2HBr …(2分)
+2HBr …(2分)
(6)8 ………………………………………………………………………(2分)
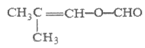 ………………(2分)
………………(2分)
(7)H2C=CH2
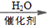 CH3CH2OH
CH3CH2OH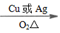 CH3CHO
CH3CHO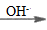
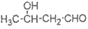

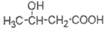 ……… (2分)
……… (2分)
19. (15分)
(1)C …………………………………………………………(2分)
(2)NaOH使ClO–+H2O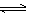 OH–+HClO平衡逆移,ClO–的量增多,HClO量减少,消毒液更稳定 …………………………(2分)
OH–+HClO平衡逆移,ClO–的量增多,HClO量减少,消毒液更稳定 …………………………(2分)
(3)Cl2+NaHCO3=HClO+NaCl+CO2 ……………………………………………(2分)
(4)溶液的酸碱性;消毒液和KI的相对用量(合理即可)………………(2分)
(5)5ClO–+I2+H2O=2IO3–+5Cl–+2H+ ………………………………………(2分)
向与烧杯3 pH相同的NaOH溶液中加入滴有淀粉溶液的碘水,振荡,蓝色褪去
………………………………………………………………(2分)
(6)不能,溶液中存在大量ClO–的干扰,ClO–也可将I–氧化为I2使溶液变蓝 …(2分)
(7)”变蓝,因为发生反应ClO–+2I–+H2O=I2+Cl–+2OH–(和I2+I–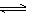 I3–),溶液中存在I2单质”或”变蓝,溶液显橙黄色,肯定存在有色离子I2或I3–,反应生成的I2存在平衡I2+I–
I3–),溶液中存在I2单质”或”变蓝,溶液显橙黄色,肯定存在有色离子I2或I3–,反应生成的I2存在平衡I2+I–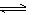 I3–,有I2会变蓝”;或”不变蓝,I2在碱性溶液中不存在,发生反应3I2+6OH–=IO3–+5I–+3 H2O”(合理即可)………………………(1分)
I3–,有I2会变蓝”;或”不变蓝,I2在碱性溶液中不存在,发生反应3I2+6OH–=IO3–+5I–+3 H2O”(合理即可)………………………(1分)

 CH
CH