本试卷共24道小题,满分45分。
可能用到的相对原子质量:H 1 C 12 O 16
第一部分 选择题(每小题1分,共12分)
(每小题只有1个选项符合题意。)
1.空气成分中,体积分数约占21%的是
A.氧气 B.氮气 C.二氧化碳 D.稀有气体
2.下列人体所必需的元素中,缺乏会引起骨质疏松的是
A.铁 B.钙 C.碘 D.锌
3.下列是人体中几种体液的正常pH,酸性最强的是
A.胆汁(6.8~7.4) B.唾液(6.6~7.1)
C.血液(7.35~7.45) D.胃液(0.8~1.5)
4.下列符号中,表示2个氢原子的是
A.H2 B.2H C.2H+ D.2H2
5.下列实验操作中,不正确的是
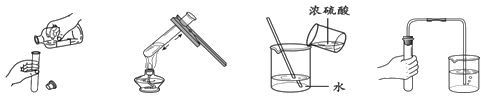
A.倾倒液体 B.加热液体 C.稀释浓硫酸 D.检查气密性
6.下列做法中,错误的是
A.酒精灯中的酒精洒在桌面燃烧起来,立即用湿抹布盖灭
B.天然气泄漏,应立即关闭阀门,开窗通风
C.电器着火,立即用水灭火
D.乘坐地铁,禁止携带鞭炮等易燃物品
7.下列物质的用途中,利用其化学性质的是
A.液氮用作冷冻剂 B.干冰用于人工降雨
C.氧气用于气焊 D.浓硫酸用作干燥剂
8.下列物质不能与盐酸反应的是
A.NaCl B.NaOH C.CaCO3 D.Zn
9.2020 年全球爆发的”新冠肺炎”威胁着人们的身体健康。过氧乙酸可以起到消毒杀菌的作用。其化学式为C2H4O3下列有关过氧乙酸的叙述不正确的是
A.过氧乙酸是由碳、氢、氧三种元素组成的
B.过氧乙酸中碳、氢、氧三种元索的质量比为6:1:12
C.一个过氧乙酸分子中含有9个原子
D.过氧乙酸可以消毒杀菌,是由于过氧乙酸中含有臭氧分子的缘故
10.电解水实验装置如图所示。下列说法不正确的是
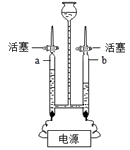
A.a中收集到的气体是氢气 B.b中收集到的气体可以燃烧
C.水不是由一种元素组成的 D.水在通电条件下可以分解生成氢气和氧气
11.下列有关金属的实验,说法不正确的是
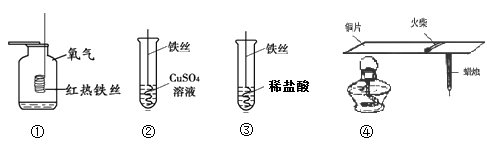
A.①中细铁丝燃烧生成的黑色固体物质是氧化铁
B.实验②可以验证铁的金属活动性强于铜
C.③中有气泡产生
D.④能说明铜具有导热性
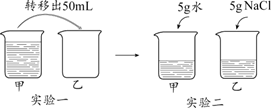
12.温度不变,对100 mL氯化钠饱和溶液进行如图所示实验。下列结论不正确的是
A.实验一后,甲和乙中溶质质量分数相等 |
B.实验二后,乙溶液溶质质量分数增大 |
C.实验二后,甲溶液变为不饱和溶液 |
D.实验二后,甲和乙溶液中溶质质量相等 |
第二部分 非选择题(33分)
〖生活现象解释〗
13.(2分)4月永定河春季生态补水工作正式启动,干涸25年的河道首次实现全线通水。
(1)河水属于__________(填”纯净物”或”混合物”)
(2)河水下泄过程中有部分水蒸发掉,水变成水蒸气的过程中,不发生变化的是____(填字母序号)。
A.分子质量 B.分子种类 C.分子间隔
14.(3分)食盐、食醋、小苏打、碳酸钙都是生活中常见物质。回答下列问题:
(1)为使蛋糕更松软,焙制时加入适量_______。
(2)下列属于化学变化的是_______(填序号)。
A. 海水晾晒得到海盐
B. 粮食经微生物发酵酿造食醋
C. 大理石切割打磨制成建筑材料
(3)小苏打可以缓解胃酸过多症,其原理用化学方程式表示为_______。
15.(2分)工业上利用天然气”捕获”二氧化碳,以减少碳排放。该反应的微观示意图如下:

(1)在图中横线处补全相应微粒的图示。
(2)依据生活经验写出一条减少二氧化碳排放的措施____。
〖科普阅读理解〗
16.(5分)阅读下面科普短文。
新版《北京市生活垃圾管理条例》5月1日正式施行,全面推行生活垃圾分类。生活垃圾分为四大类:可回收物、厨余垃圾、有害垃圾和其他垃圾。
表1 2019年北京市某转运站生活垃圾组成的质量分数(%)
厨余 | 纸类 | 塑料 | 玻璃 | 金属 | 木竹 | 砖瓦 | 纺织类 | 灰土类 |
39-53 | 17-24 | 18-26 | 0.9-1.9 | 0.1-0.3 | 1.7-6.1 | 0.8-2 | 1.1-4.4 | 1-4.9 |
截止至2019末,北京常住人口2100万,每人每天可产生垃圾1.3kg,每天产生垃圾总量2.77万吨。北京市生活垃圾卫生填埋场库容趋于饱和,面对紧迫形势,开展垃圾分类、垃圾减量势在必行。垃圾分类既可以改善生活环境又有利于资源循环利用。
目前全球垃圾处理基本就是三个渠道:填埋、焚烧、堆肥。填埋可分为卫生和不卫生填埋。焚烧是最易引起民众反感的处理方法,但实际并非如此。焚烧是垃圾处理中实现三化最
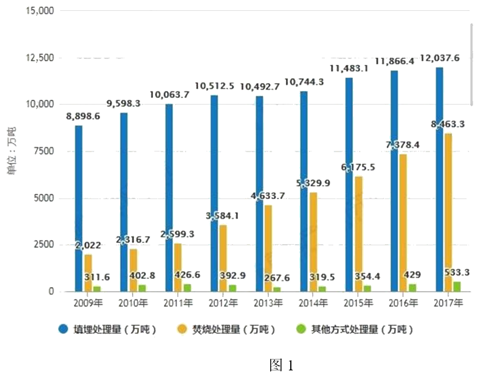
好的方法,即:无害化、减量化、资源化,垃圾焚烧将成为未来生活垃圾处理的主流方式。图1是2009-2017年我国生活垃圾无害化处理量结构分布情况。让我们大家都携起手来,共同参与垃圾分类,一起来建设绿色美好的家园!
(1)垃圾分类的目的是______。
(2)下列垃圾归类不合理的是________ 。
A | B | C | D | |
垃圾 | 废易拉罐 | 废塑料瓶 | 废荧光灯管 | 茶叶渣 |
垃 圾 分 类 |
|
|
|
|
(3)由表1可知,该转运站生活垃圾中数量最多的是________。
(4)从图1中信息可知2009-2017年________处理量明显升高。
(5)下列说法正确的是__________(填序号)。
A.垃圾焚烧产生大量污染空气的物质,故不宜采用此方法
B.将垃圾分类回收是垃圾处理的发展方向
C.垃圾处理常用的方法是填埋、焚烧、堆肥
D.焚烧垃圾实现了垃圾处理的无害化、减量化、资源化
〖生产实际分析〗
17.(2分)工业制备蔗糖的流程如下图所示。
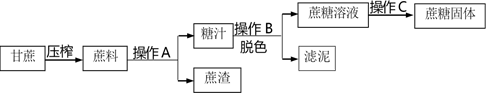
(1)操作A名称是________。
(2)关于工业制备蔗糖,下列说法正确的是________(选填序号)。
A.甘蔗中不含人体所需的营养素
B.在实验室中进行操作A、C都要用到玻璃棒,其作用不同
C.为得到更多的蔗糖固体,进行操作C时应将水分蒸干再停止加热
18.(2分)工业烟气脱硫中采用”双碱法”脱硫的工业流程如下:
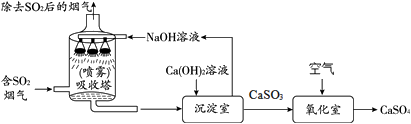
- 吸收塔中,用NaOH溶液吸收SO2生成亚硫酸钠(Na2SO3)和水,则Na2SO3中硫元素的化合价为______。
(2)沉淀室中发生了复分解反应,请写出此反应的化学方程式______。
〖基本实验及其原理分析〗
19.(2分)用下图装置进行实验。
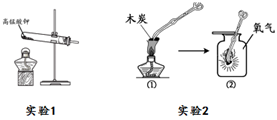
- 实验1中高锰酸钾分解的化学方程式____________________
(2)实验2中,对比①②可得到的结论是______。
20.(2分)实验小组同学配制50 g质量分数为15%的氯化钠溶液。

(1)需要氯化钠和水的质量分别为____。
(2)实验操作顺序为E、C、____。
21.(2分)用下图所示装置研究燃烧条件和测定空气中氧气含量实验。
已知:白磷的着火点为40℃。
实验装置
实验步骤和现象
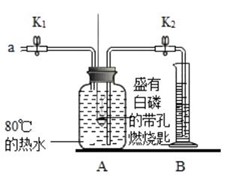
步骤Ⅰ:检查装置气密性,气密性良好。
步骤Ⅱ:将盛有白磷的带孔燃烧匙伸入A瓶中,白磷不燃烧
步骤Ⅲ:向A瓶中加满80℃的热水,塞紧瓶塞,白磷不燃烧。
步骤Ⅳ:打开K1和K2,
从a口向瓶中鼓入空气,待瓶中液面低于燃烧匙底部时,关闭K1和K2此时进入量筒B中水的体积为200ml,观察到A瓶中白磷燃烧。(1)对比步骤Ⅱ和Ⅳ的现象可知,可燃物的燃烧条件之一是________。
(2)待装置冷却至室温后,打开K2,可观察到量筒中液面的刻度为________,说明空气中氧气的体积约占1/5。
22.(2分)用下列实验研究酸与碱的反应。

(1)实验一中溶液由红色变为无色。用化学方程式解释该现象产生的原因:____。
(2)实验二在滴加盐酸过程中,多次测量溶液的pH。证明反应发生的依据是____。
23.(3分)实验室用下图装置制取CO2并研究CO2性质。将稀盐酸推入C装置中。
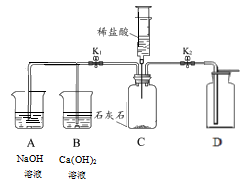
(1)打开K2,用D装置收集CO2的依据是____。__________
(2)关闭K2打开K1,其中一个烧杯中产生白色沉淀,写出该反应的化学方程式______;另一烧杯中无明显现象,为了证明反应的发生可以再向该烧杯中滴加适量的__________。
〖科学探究〗
24.(6分)Na2CO3溶液具有碱性,可清洗油污,碱性越强,去油污的效果越好,小菁决定对影响Na2CO3溶液碱性的因素展开探究。
[进行实验]
实验一: 用不同温度的水,配制溶质质量分数分别为2%、6%和10%的Na2CO3溶液,依次测量溶液pH,记录数据如下表:
实验编号
a1
a2
a3
b1
b2
b3
c1
c2
c3
溶质质量分数
2%
2%
2%
6%
6%
6%
10%
10%
10%
水的温度(℃)
20
40
60
20
50
60
20
40
70
溶液pH
10.90
11.18
11.26
11.08
11.27
11.30
11.22
11.46
11.50
实验二: 将10%的Na2CO3溶液从20℃持续升温到70℃,所测得的pH如下表:
温度(℃)
20
30
40
50
60
70
溶液pH
11.22
11.35
11.46
11.48
11.50
11.50
[解释与结论]
(1)碳酸钠俗称是_______。
(2)要证明Na2CO3溶液的溶质质量分数变化与pH变化关系,可选择最佳的一组实验是_____(填实验编号),其结论是____。
(3)实验二的目的是_____。
[反思与评价]
(4))小菁将Na2CO3粉末洒在有油污的餐具上,再加适量热水,进行擦洗,达到较好的洗涤效果,这是因为___________。
(5)解释Na2CO3溶液显碱性的反应如下,请补全该反应的化学方程式:
Na2CO3 + H2O = NaHCO3 + ____
【试题答案】
第一部分 选择题
题号
1
2
3
4
5
6
7
8
9
10
11
12
答案
A
B
D
B
A
C
C
A
D
A
A
B
第二部分 非选择题
〖生活现象解释〗
13.(2分)(1)混合物 (2)AB
14.(3分)(1)小苏打 (2)B
(3) NaHCO3 + HCl
= NaCl
+ H2O + CO2↑
15.(2分)(1)
 (2)公共交通出行等
(2)公共交通出行等〖科普阅读理解〗
16.(5分)
- 垃圾分类既可以改善生活环境又有利于资源循环利用
(2)B (3)厨余垃圾 (4)焚烧 (5)BCD
〖生产实际分析〗
17. (2分)(1)过滤 (2)B
18. (2分)(1)+4 (2)Ca(OH)2+Na2SO3= CaSO3↓
+2NaOH〖基本实验及其原理分析〗
19.(2分)(1)2KMnO4
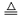 K2MnO4 +MnO2 +O2↑
K2MnO4 +MnO2 +O2↑(2)氧气浓度越大,木炭燃烧越剧烈(合理给分)
20.(2分)(1)7.5 g和42.5 g (2)DAB
21.(2分)(1)温度要达到着火点(2) 160mL
22.(2分)(1)NaOH + HCl === NaCl + H2O (2)pH由大于7逐渐变为等于7(或小于7)
23. (3分)(1)二氧化碳密度比空气大且不与空气中成分发生反应
(2)CO2 + Ca(OH)2 =
CaCO3↓+H2O ,稀盐酸(或氢氧化钙、氯化钙等)〖科学探究〗
24. (6分)(1)纯碱 (2)
a1、b1、c1;;在温度相同的条件下,碳酸钠溶液的溶质质量分数越大,溶液pH越大,碱性越强(3)探究温度对碳酸钠溶液碱性强弱的影响
(4)温度越高,碳酸钠溶液的pH越大,碱性越强 (5)NaOH




