本试卷共100分。考试时长90分钟。
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S 32 Cl 35.5 Cu 64 I 127
第一部分(选择题 共42分)
本部分共14小题,每小题3分,共42分。在每小题列出的4个选项中,选出最符合题目要求的一项。
1. 下列行为不合理或不符合安全要求的是
A. 用较热的纯碱溶液清洗碗筷上的油污
B. 向室内空气中喷洒高浓度酒精进行消毒
C. 用稀释的84消毒液漂白白色棉织物上的污渍
D. 油锅炒菜着火时,关掉炉灶燃气阀门,盖上锅盖
2. 对下列过程的化学用语表述正确的是
A. 把钠加入水中,有气体生成:2Na+H2O=Na2O+H2↑
B. 用稀硫酸做导电实验,灯泡发光:H2O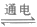 H++OH-
H++OH-
C. 向Al2(SO4)3溶液中滴加氨水,生成白色沉淀:Al3++3OH-=Al(OH)3↓
D. 用电子式表示NaCl的形成过程: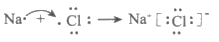
3. 下列图示装置所表示的实验中,没有发生氧化还原反应的是
|
|
|
|
A. 蘸有浓盐酸和浓氨水的玻璃棒靠近 | B. 铝丝伸入硫酸铜溶液中 | C. 测定空气中氧气含量 | D. 向蔗糖中加入浓硫酸 |
4. 阅读体检报告呈现的部分内容,判断下列说法不正确的是
项目名称 | 检查结果 | 单位 | 参考范围 |
钾 | 4.1 | mmol/L | 3.5~5.5 |
钙 | 2.15 | mmol/L | 2.13~2.70 |
胱抑素C | 0.78 | mg/L | 0.59~1.03 |
尿素 | 4.18 | mmol/L | 2.78~7.14 |
甘油三酯 | 1.50 | mmol/L | 0.45~1.70 |
A. 体检指标均以物质的量浓度表示
B. 表中所示的检查项目均正常
C. 尿素是蛋白质的代谢产物
D. 甘油三酯的结构可表示为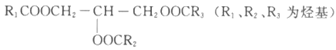
5. 硒(34Se)元素是人体必需的微量元素之一,与溴同周期。下列说法不正确的是
A. 原子半径由大到小顺序:Se>Br>Cl
B. 氢化物的稳定性:硒化氢<水<氟化氢
C. SeO2和NaOH溶液反应生成Na2SeO4和水
D. SeO2既可发生氧化反应,又可发生还原反应
6. 下列实验操作中选用的部分仪器,不正确的是
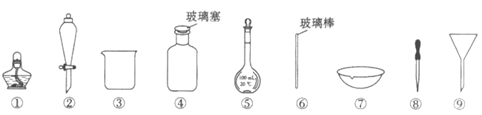
A. 盛放NaOH溶液,选用④
B. 从食盐水中获得食盐,选用①、⑥、⑦
C. 分离I2的四氯化碳溶液和水,选用②、③
D. 配制100mL 0.1mol·L-1NaCl溶液,选用③、⑤、⑥和⑧
7. 已知:①C2H6(g)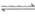 C2H4(g)+H2(g)
C2H4(g)+H2(g)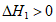
②C2H6(g)+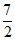 O2(g)=2CO2(g)+3H2O(1)
O2(g)=2CO2(g)+3H2O(1) 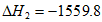 kJ·mol-1
kJ·mol-1
③C2H4(g)+3O2(g)=2CO2(g)+2H2O(1) 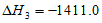 kJ·mol-1
kJ·mol-1
下列叙述正确的是
A. 升温或加压均能提高①中乙烷的转化率
B. ①中断键吸收的能量小于成键放出的能量
C. 用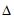 H2和
H2和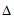 H3可计算出①中的
H3可计算出①中的 H1
H1
D. 推测1mol C2H2(g)完全燃烧放出的热量小于1411.0kJ
8. 已知苯可以进行如下转化:
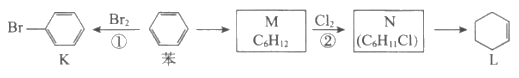
下列叙述正确的是
A. 用蒸馏水可鉴别苯和化合物K
B. 化合物M与L互为同系物
C. ①、②反应发生的条件均为光照
D. 化合物L能发生加成反应,不能发生取代反应
9. 常温常压下,下列实验方案能达到实验目的的是
实验目的 | 实验方案 | |
A | 证明苯酚有弱酸性 | 向苯酚浊液中加入NaOH溶液 |
B | 证明葡萄糖中含有羟基 | 向葡萄糖溶液中加入高锰酸钾酸性溶液 |
C | 比较镁和铝的金属性强弱 | 用pH试纸分别测量MgCl2和AlCl3溶液的pH |
D | 测定过氧化钠样品(含少量氧化钠)的纯度 | 向a g样品中加入足量水,测量产生气体的体积 |
10. 科研人员提出CeO2催化合成DMC经历三步反应,示意图如下:
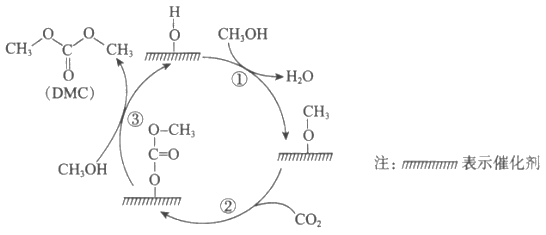
下列说法正确的是
A. ①、②、③中均有O—H的断裂
B. 生成DMC总反应的原子利用率为100%
C. 该催化剂可有效提高反应物的平衡转化率
D. DMC与过量NaOH溶液反应生成CO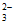 和甲醇
和甲醇
11. 25℃时,浓度均为0.1mol·L-1的几种溶液的pH如下:
溶液 | ①CH3COONa | ②NaHCO3 | ③CH3COONH4 |
pH | 8.9 | 8.3 | 7.0 |
下列说法不正确的是
A. ①中,c(Na+)=c(CH3COO-)+c(CH3COOH)
B. 由①②可知,CH3COO-的水解程度大于HCO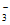 的水解程度
的水解程度
C. ③中,c(CH3COO-)=c(NH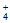 )<0.1mol·L-1
)<0.1mol·L-1
D. 推测25℃,0.1mol·L-1NH4HCO3溶液的pH<8.3
12. 如图所示装置,两个相同的玻璃管中盛满NaCl稀溶液(滴有酚酞),a、b为多孔石墨电极。闭合S1一段时间后,a附近溶液逐渐变红;断开S1,闭合S2,电流表指针发生偏转。下列分析不正确的是
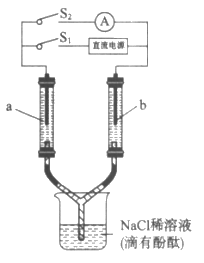
A. 闭合S1时,a附近的红色逐渐向下扩散
B. 闭合S1时,a附近液面比b附近的低
C. 断开S1、闭合S2时,b附近黄绿色变浅
D. 断开S1、闭合S2时,a上发生反应:H2-2e-=2H+
13. 取某品牌加碘食盐(其包装袋上的部分说明如下)配成溶液,加入少量淀粉和稀盐酸后分成2份于试管中,分别进行下列实验。
配料 | 含碘量(以I计) | 食用方法 |
精制盐、碘酸钾、亚铁氰化钾(抗结剂) | (35±15)mg/kg | 待食品熟后加入碘盐 |
①加入FeCl2溶液,振荡,溶液由无色变蓝色。
②加入KI溶液,振荡,溶液由无色变蓝色。
下列分析合理的是
A. 碘酸钾的化学式为KIO4,受热易分解
B. ①或②都能说明食盐中含碘酸钾,其还原产物为I2
C. 一袋(200g)食盐中含I为5×10-5mol时,符合该包装说明
D. 食盐中添加碘酸钾与亚铁氰化钾的目的均与反应速率有关
14. 298 K时,0.180 mol·L-1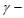 羟基丁酸水溶液发生如下反应,生成
羟基丁酸水溶液发生如下反应,生成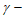 丁内酯:
丁内酯:
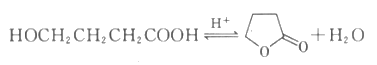
不同时刻测得γ-丁内酯的浓度如下表:
| 20 | 50 | 80 | 100 | 120 | 160 | 220 |
|
| 0.024 | 0.050 | 0.071 | 0.081 | 0.090 | 0.104 | 0.116 | 0.132 |
注:该条件下副反应、溶液体积变化忽略不计。
下列分析正确的是
A. 增大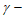 羟基丁酸的浓度可提高
羟基丁酸的浓度可提高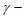 丁内酯的产率
丁内酯的产率
B. 298 K时,该反应的平衡常数为2.75
C. 反应至120 min时,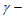 羟基丁酸的转化率<50%
羟基丁酸的转化率<50%
D. 80~120 min的平均反应速率:v(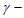 丁内酯)>
丁内酯)>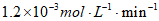
第二部分(综合题 共58分)
本部分共5小题. 共58分。
15. (11分)文物是人类宝贵的历史文化遗产,我国文物资源丰富,但保存完好的铁器比青铜器少得多,研究铁质文物的保护意义重大。
(1)下图的铁刃铜钺中,铁质部分比铜质部分锈蚀严重,其主要原因是_____________________。

(2)已知:
i. 铁质文物在潮湿的土壤中主要发生吸氧腐蚀,表面生成疏松的FeOOH;
ii. 铁质文物在干燥的土壤中表面会生成致密的Fe2O3,过程如下:

①i中O2参与反应的电极反应式和化学方程式是____________________、_____________________。
②若ii中每一步反应转化的铁元素的质量相等,则三步反应中电子转移数之比为_______________________。
③结合已知信息分析,铁质文物在潮湿的土壤中比在干燥的土壤中锈蚀严重的主要原因是_________________________。
(3)【资料1】Cl-体积小穿透能力强,可将致密氧化膜转化成易溶解的氯化物而促进铁质文物继续锈蚀。
【资料2】Cl-、Br-、I-促进铁器皿继续锈蚀的能力逐渐减弱。
①写出铁质文物表面的致密氧化膜被氯化钠破坏的化学方程式____________________。
②结合元素周期律解释”资料2″的原因是_____________________。
(4)从潮湿土壤出土或海底打捞的铁质文物必须进行脱氯处理:用稀NaOH溶液反复浸泡使Cl-渗出后,取最后一次浸泡液加入试剂______________________(填化学式)检验脱氯处理是否达标。
(5)经脱氯、干燥处理后的铁质文物再”覆盖”一层透明的高分子膜可以有效防止其在空气中锈蚀。下图为其中一种高分子膜的片段:
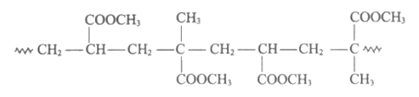
该高分子的单体是_________________。
16. (13分)研究来源于真菌的天然产物L的合成对抗肿瘤药物研发有着重要意义。其合成路线主要分为两个阶段:
Ⅰ. 合成中间体F
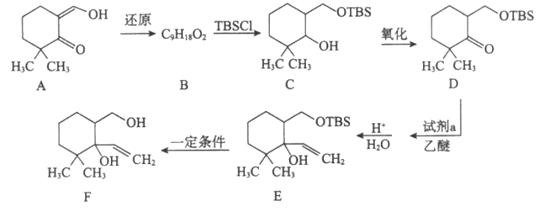
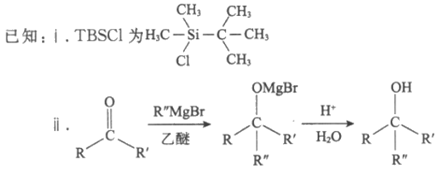
(1)A中含氧官能团名称是___________________。
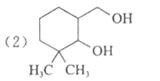
(2)B的结构简式是__________________。
(3)试剂a是__________________。
(4)TBSCl的作用是__________________。
Ⅱ. 合成有机物L
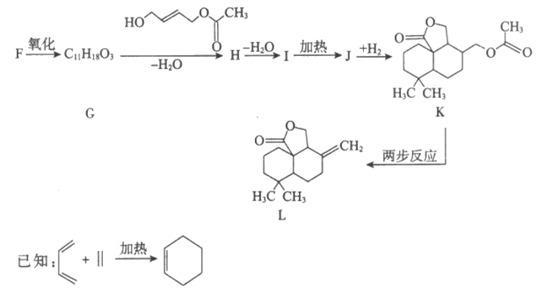
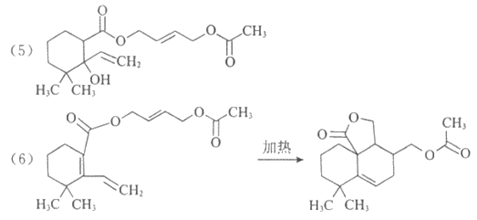
(5)H中含有两个酯基,H的结构简式是__________________。
(6)I→J的反应方程式是__________________。
(7)K→L的转化中,两步反应的反应类型依次是__________________、__________________。
17. (10分)绿色植物标本用醋酸铜[(CH2COO)2Cu]处理后颜色更鲜艳、稳定。某化学小组制备醋酸铜晶体并测定产品中铜的含量,实验如下。
Ⅰ. 醋酸铜晶体的制备
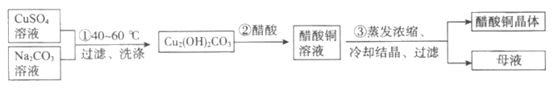
(1)①中,用离子方程式表示产物中OH-的来源是__________________。
(2)②中,化学方程式是__________________。
(3)③中采用的实验方法依据醋酸铜的性质是:__________________。
Ⅱ. 测定产品中铜的含量
i. 取a g醋酸铜产品于具塞锥形瓶中,用稀醋酸溶解,加入过量KI溶液,产生CuI沉淀,溶液呈棕黄色;
ii. 用b mol·L-1Na2S2O3标准溶液滴定i中的浊液至浅黄色时,加入几滴淀粉溶液,溶液变蓝,继续用Na2S2O3标准溶液滴定至蓝色近于消失;
iii. 向ii所得浊液中加入KSCN溶液,充分摇动,溶液蓝色加深;
iv. 继续用Na2S2O3标准溶液滴定iii中浊液至终点,消耗标准溶液V mL。
已知:①I2+2S2O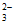 =2I-+S4O
=2I-+S4O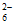 ,Na2S2O3溶液和Na2S4O6溶液的颜色均为无色;
,Na2S2O3溶液和Na2S4O6溶液的颜色均为无色;
②CuI易吸附I2,CuSCN难溶于水且不吸附I2。被吸附的I2不与淀粉显色。
(4)i中发生反应的离子方程式是__________________。
(5)结合离子方程式说明,iii中加入KSCN的目的是__________________。
(6)醋酸铜产品中铜元素的质量分数是__________________。
18. (11分)液相催化还原法去除水体中NO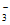 是一项很有前景的技术。某科研小组研究该方法中固体催化剂Pd-Cu/TiO2的制备和催化条件,结果如下。
是一项很有前景的技术。某科研小组研究该方法中固体催化剂Pd-Cu/TiO2的制备和催化条件,结果如下。
Ⅰ. 制备Pd-Cu/TiO2的反应过程如下图所示,光照使TiO2发生电荷分离,将金属Pd沉积在TiO2表面。再用类似方法沉积Cu,得到在TiO2纳米颗粒表面紧密接触的Pd-Cu纳米簇。
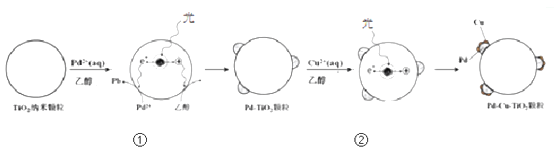
(1)该过程中,乙醇发生_____________(填”氧化”或”还原”)反应。
(2)请在②中补全光照条件下形成Pd-Cu纳米簇的反应过程示意图。
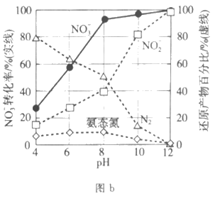
Ⅱ. Pd-Cu/TiO2分步催化还原机理如图a所示。其他条件相同,不同pH时,反应1小时后NO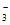 转化率和不同产物在总还原产物中所占的物质的量的百分比如图b所示。
转化率和不同产物在总还原产物中所占的物质的量的百分比如图b所示。
(3)该液相催化还原法中所用的还原剂是__________________。
(4)i的离子方程式是__________________。
(5)研究表明,OH-在Pd表面与NO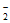 竞争吸附,会降低Pd吸附NO
竞争吸附,会降低Pd吸附NO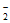 的能力,但对Pd吸附H的能力影响不大。
的能力,但对Pd吸附H的能力影响不大。
①随pH增大,N2和氨态氮在还原产物中的百分比均减小,原因是__________________,导致ii的化学反应速率降低。
②随pH减小,还原产物中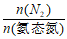 的变化趋势是_________,说明Pd表面吸附的NO
的变化趋势是_________,说明Pd表面吸附的NO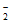 和H的比值变大,对反应__________________(用离子方程式表示)更有利。
和H的比值变大,对反应__________________(用离子方程式表示)更有利。
(6)使用Pd-Cu/TiO2,通过调节溶液pH,可将NO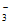 尽可能多的转化为N2,具体方法是________________。
尽可能多的转化为N2,具体方法是________________。
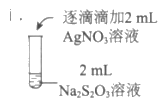
19.(13分)”硫代硫酸银”(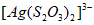 )常用于切花保鲜,由AgNO3溶液(0.1mol·
)常用于切花保鲜,由AgNO3溶液(0.1mol·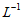 、pH=6)和Na2S2O3溶液(0.1mol·L-1、pH=7)现用现制。某小组探究其配制方法。
、pH=6)和Na2S2O3溶液(0.1mol·L-1、pH=7)现用现制。某小组探究其配制方法。
【实验一】
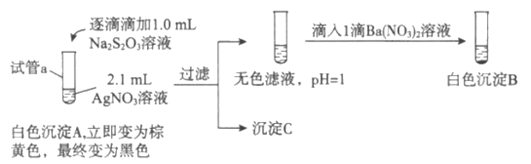
(1)A为Ag2S2O3。写出生成A的离子方程式:__________________。
(2)对实验现象的分析得出,试管a中充分反应后一定生成了_______________(填离子符号),进而推测出沉淀C可能为Ag2S、Ag、s或它们的混合物。做出推测的理由是__________________。
(3)若试管a中物质充分反应后不过滤,继续加入1.1mL Na2S2O3溶液,振荡、静置,黑色沉淀不溶解,清液中逐渐出现乳白色浑浊,有刺激性气味产生。用离子方程式解释产生白色浑浊的原因:__________________。
结论:Ag2S2O3不稳定,分解所得固体不溶于Na2S2O3溶液。
【实验二】已知:Ag2S2O3+3S2O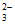
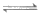 2[Ag(S2O3)2]3-(无色)
2[Ag(S2O3)2]3-(无色)
实验操作 | 实验现象 |
| 白色沉淀生成,振荡后迅速溶解,得到无色清液; 滴加至约1mL时清液开始略显棕黄色,有丁达尔现象; 超过1.5mL后,产生少量白色沉淀,立即变为棕黄色,最终变为黑色; 滴加完毕,静置,得到黑色沉淀,上层清液pH=5 |
| 白色沉淀生成,立即变为棕黄色,充分振荡后得到棕黄色清液,有丁达尔现象 |
(4)用平衡移动原理解释实验i中加入1.5mL AgNO3后产生白色沉淀的原因__________________。
(5)实验i中,当加入0.5mL AgNO3溶液时,得到无色清液,若放置一段时间,无明显变化。结合化学反应速率分析该现象与ii不同的原因是__________________。
(6)简述用0.1mol·L-1AgNO3溶液和0.1mol·L-1Na2S2O3溶液配制该保鲜剂时,试剂的投料比和操作:___________________。
【试题答案】
注:学生答案与本答案不符时,合理答案给分
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
答案 | B | D | A | A | C | A | D |
题号 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
答案 | A | D | D | B | D | C | B |
15. (11分)
(1)铁比铜活泼
(2)①O2+4e-+2H2O=4OH- 4Fe(OH)2+O2=4FeOOH+2H2O
②6:2:1
③铁质文物在潮湿环境中表面生成疏松的FeOOH,水、氧气能通过孔隙使铁继续发生吸氧锈蚀;在干燥空气中形成致密的Fe2O3,隔绝了铁与水和氧气的接触,阻碍锈蚀
(3)①Fe2O3+6NaCl+3H2O=6NaOH+2FeCl3(Fe2O3+H2O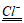 2FeOOH)
2FeOOH)
②氯、溴、碘同主族,形成的阴离子随电子层数增加半径增大(或体积增大),穿透能力减弱
(4)HNO3和AgNO3
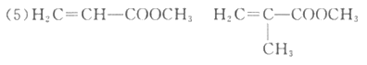
16. (13分)
(1)羰基 羟基
(3)H2C=CHMgBr
(4)保护—CH2OH
(7)水解反应、消去反应
17. (10分)
(1)CO +H2O
+H2O OH-+HCO
OH-+HCO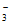
(2)Cu2(OH)2CO3+4CH3COOH=2(CH3COO)2Cu+3H2O+CO2↑
(3)醋酸铜的溶解度随温度变化较大,温度越高溶解度越大,温度降低溶解度减小
(4)2Cu2++4I-=2CuI↓+I2
(5)因为CuSCN不吸附I2,通过反应CuI+SCN-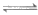 CuSCN+I-,使CuI吸附的I2释放出来与Na2S2O3反应
CuSCN+I-,使CuI吸附的I2释放出来与Na2S2O3反应
(6)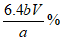
18. (11分)
(1)氧化
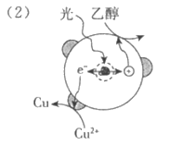
(3)H2
(4)Cu+NO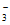 =NO
=NO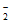 +CuO或H2+NO
+CuO或H2+NO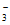
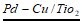 NO
NO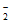 +H2O
+H2O
(5)①Pd表面单位面积吸附的NO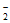 数目减小
数目减小
②增大 2NO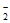 +6H=N2+2H2O+2OH-
+6H=N2+2H2O+2OH-
(6)先调节溶液的pH到12,待NO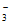 几乎完全转化为NO
几乎完全转化为NO 后,调节pH到4
后,调节pH到4
19. (13分)
(1)2Ag++S2O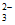 =Ag2S2O3↓
=Ag2S2O3↓
(2)H+、SO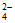
得到的SO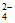 是氧化产物,必然要生成其他还原产物
是氧化产物,必然要生成其他还原产物
(3)S2O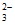 +2H+=S↓+SO2↑+H2O
+2H+=S↓+SO2↑+H2O
(4)过量Ag+与S2O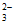 结合,使c(S2O
结合,使c(S2O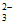 )降低,Ag2S2O3+3S2O
)降低,Ag2S2O3+3S2O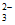
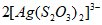 逆向移动,析出沉淀
逆向移动,析出沉淀
(5)逐滴滴加AgNO3时,Ag2S2O3的溶解速率大于分解速率;迅速混合时部分Ag2S2O3来不及溶解即发生分解,分解产物不能再溶于Na2S2O3
(6)Na2S2O3和AgNO3物质的量之比大于2:1,在不断搅拌下将AgNO3溶液缓缓加入到Na2S2O3溶液中